El caso
Una mujer de 49 años con obesidad mórbida acudió al servicio de urgencias con dificultad respiratoria y distensión abdominal. En el momento de la presentación, su presión arterial era de 100/60 mm Hg, con una frecuencia cardíaca de 110, una frecuencia respiratoria de 24 y una saturación de pulsoximetría (SpO2) del 86% en aire ambiente. La troponina T estaba elevada a 0,3 ng/mL. La tomografía computarizada (TC) de tórax con contraste intravenoso mostró una embolia pulmonar (EP) en silla de ruedas con dilatación del ventrículo derecho (VD). La TC de abdomen/pelvis reveló una masa uterina muy grande con linfadenopatía difusa.
Se inició rápidamente la infusión de heparina. El ecocardiograma demostró una distensión del VD. Los hallazgos en la ecografía dúplex de las extremidades inferiores eran consistentes con una trombosis venosa profunda (TVP) aguda que afectaba a la vena femoral común izquierda y a la vena poplítea derecha. La biopsia de un ganglio linfático supraclavicular mostró un carcinoma indiferenciado de alto grado, probablemente de origen uterino.
Preguntas clínicas
¿Qué opciones terapéuticas, si es que hay alguna, deben considerarse además de la anticoagulación sistémica estándar? ¿Existe un papel para:
1. Trombólisis sistémica?
2. Trombólisis dirigida por catéter (TDC)?
3. Colocación de un filtro en la vena cava inferior (VCI)?
¿Cuál es el tratamiento adecuado de la EP «submasiva»?
En el caso de la TEP masiva, en la que el trombo se localiza en la vasculatura pulmonar central y se asocia a hipotensión por deterioro del gasto cardíaco, la trombólisis sistémica, la embolectomía y el TDC están indicados como medidas potencialmente salvadoras de la vida. Sin embargo, la evidencia es menos clara cuando la embolia pulmonar es grande y ha provocado tensión en el VD, pero sin inestabilidad hemodinámica manifiesta. Esto se conoce comúnmente como una PE de riesgo intermedio o «submasiva». La embolia pulmonar submasiva según las directrices de la Asociación Americana del Corazón (AHA) es:1
Una embolia pulmonar aguda sin hipotensión sistémica (presión arterial sistólica inferior a 90 mm Hg) pero con disfunción del VD o necrosis miocárdica. La disfunción del VD se define por la presencia de al menos una de las siguientes características:
– Dilatación del VD (diámetro apical del VD de 4 cámaras dividido por el diámetro del VI mayor de 0.9) o disfunción sistólica del VD en la ecocardiografía;
– Dilatación del VD en la TC, elevación del BNP (superior a 90 pg/mL), elevación del pro-BNP N-terminal (superior a 500 pg/mL);
– Cambios electrocardiográficos (nuevo bloqueo de rama derecha completo o incompleto, elevación o depresión del ST anteroseptal o inversión de la onda T anteroseptal).
La necrosis miocárdica se define como la elevación de la troponina I (superior a 0,4 ng/mL) o la elevación de la troponina T (superior a 0,1 ng/mL).
¿Por qué la EP submasiva tiene importancia clínica?
En 1999, el análisis del Registro Cooperativo Internacional de Embolia Pulmonar (ICOPER) reveló que la disfunción del VD en los pacientes con EP se asociaba con un riesgo de mortalidad a los 3 meses casi duplicado (cociente de riesgos 2,0, 1,3-2,9).2 Dado este aumento del riesgo, se podría sacar la conclusión lógica de que debemos tratar la EP submasiva de forma más agresiva que la EP sin tensión del VD. Pero, ¿resultará esto necesariamente en un mejor resultado para el paciente, dado el 3% de riesgo de hemorragia intracraneal asociado al tratamiento trombolítico?
En el escenario clínico anterior, el paciente cumplía la definición de EP submasiva. Aunque la paciente no experimentó hipotensión sistémica, tenía dilatación del VD en la TC, disfunción sistólica del VD en la ecografía, así como un nivel elevado de troponina T. La AHA recomienda que se considere la trombólisis sistémica y el TDC para los pacientes con TEP submasiva aguda si tienen pruebas clínicas de pronóstico adverso, incluido el empeoramiento de la insuficiencia respiratoria, la disfunción grave del VD o la necrosis miocárdica importante y el bajo riesgo de complicaciones hemorrágicas (clase IIB; nivel de evidencia C).1
La actualización de las directrices del Colegio Americano de Médicos del Tórax (CHEST) de 20163 recomienda el tratamiento trombolítico administrado sistémicamente en lugar de la ausencia de tratamiento en pacientes seleccionados con EP aguda que se deterioran después de iniciar el tratamiento anticoagulante, pero que aún no han desarrollado hipotensión y que tienen un bajo riesgo de hemorragia (recomendación de grado 2C).
Trombólisis sistémica
La trombólisis sistémica se administra como una infusión trombolítica intravenosa administrada durante un período de tiempo. Los fármacos trombolíticos aprobados por la Administración de Alimentos y Medicamentos (FDA) incluyen actualmente el activador tisular del plasminógeno (tPA)/alteplasa, la estreptoquinasa y la uroquinasa.
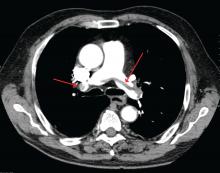 James Heilman, MD (utilizado bajo licencia Creative Commons)
James Heilman, MD (utilizado bajo licencia Creative Commons)
Una gran embolia pulmonar en la bifurcación de la arteria pulmonar (embolia en silla de montar).
En el ensayo aleatorizado y doble ciego Pulmonary Embolism-3 de 2002,4 Konstantinides y sus colegas compararon heparina más tPA frente a heparina más placebo en 256 pacientes con EP submasiva. El criterio de valoración clínico primario de muerte o intensificación de los cuidados en el hospital fue del 11,0% en el grupo de tPA frente al 24,6% en el grupo de placebo (p = 0,006); la diferencia se debió en gran medida a la intensificación de los cuidados, definida como el uso de vasopresores, trombólisis de rescate, ventilación mecánica, parada cardíaca y necesidad de embolectomía quirúrgica. Tal vez sea sorprendente que no haya habido casos de ictus hemorrágico en ninguno de estos grupos. El ensayo demostró que la trombólisis sistémica en la embolia pulmonar submasiva se asoció con un menor riesgo de muerte y de intensificación del tratamiento.
La eficacia de la trombólisis de baja dosis se estudió en el MOPETT 2013,5 un estudio unicéntrico, prospectivo, aleatorizado y abierto, en el que 126 participantes que presentaban una embolia pulmonar submasiva según los síntomas y los datos de la angiografía por TC o de la gammagrafía de ventilación/perfusión recibieron 50 mg de tPA más heparina o anticoagulación con heparina sola. El punto final compuesto de hipertensión pulmonar y EP recurrente a los 28 meses fue del 16% en el grupo de tPA en comparación con el 63% en el grupo de control (p. inferior a 0,001). La trombólisis sistémica se asoció con un menor riesgo de hipertensión pulmonar y EP recurrente, aunque no se observó ningún beneficio de mortalidad en este pequeño estudio.
En el ensayo aleatorizado y doble ciego PEITHO (n = 1.006) de 20146 en el que se comparó tenecteplasa más heparina frente a heparina en los pacientes con EP submasiva, los resultados primarios de muerte y descompensación hemodinámica se produjeron en el 2,6% del grupo de tenecteplasa, frente al 5,6% del grupo de placebo (p = 0,02). El tratamiento trombolítico se asoció a una tasa de ictus hemorrágico del 2%, mientras que el ictus hemorrágico en el grupo placebo fue del 0,2% (p = 0,03). En este caso, la trombólisis sistémica se asoció con un 3% menos de riesgo de muerte e inestabilidad hemodinámica, pero también con un 1,8% más de riesgo de ictus hemorrágico.
Trombólisis dirigida por catéter (TDC)
La TDC se desarrolló originalmente para tratar las trombosis arteriales, de injertos de diálisis y de venas profundas, pero ahora está aprobada por la FDA para el tratamiento de la EP aguda submasiva o masiva.
Se pasa un cable a través del émbolo y se coloca un catéter de infusión de múltiples orificios, a través del cual se infunde un fármaco trombolítico durante 12-24 horas. Se cree que la administración directa del fármaco en el trombo es tan eficaz como la terapia sistémica, pero con un menor riesgo de hemorragia. Si está indicada una eliminación más rápida del trombo debido a una gran carga de coágulos y a la inestabilidad hemodinámica, pueden utilizarse terapias mecánicas, como la fragmentación y la aspiración, como complemento del TDC. Sin embargo, estas técnicas mecánicas conllevan el riesgo de lesión de la arteria pulmonar, por lo que sólo deben utilizarse como último recurso. Se puede añadir un cable emisor de ultrasonidos al catéter de infusión de múltiples orificios para acelerar la trombólisis mediante la disrupción ultrasónica del trombo, una técnica conocida como trombólisis mejorada por ultrasonidos (EKOS).7,10
El ensayo ULTIMA 2014,8 un estudio pequeño, aleatorizado y abierto de la trombólisis dirigida por catéter asistida por ultrasonidos (USAT, el término puede utilizarse indistintamente con EKOS) frente a la anticoagulación con heparina sola en 59 pacientes, se diseñó para estudiar si la primera estrategia era mejor para mejorar la medida de resultado primaria de la relación VD/VL en pacientes con TEP submasiva. La reducción media del cociente VD/VL fue de 0,30 +/- 0,20 en el grupo de USAT en comparación con 0,03 +/- 0,16 en el grupo de heparina (p inferior a 0,001). Sin embargo, no se observaron diferencias significativas en la mortalidad o la hemorragia en los grupos a los 90 días de seguimiento.
El ensayo PERFECT 2015,9 un estudio multicéntrico basado en un registro, inscribió prospectivamente a 101 pacientes que recibieron CDT como tratamiento de primera línea para la EP masiva y submasiva. Entre los pacientes con EP submasiva, el 97,3% tuvo «éxito clínico» con este tratamiento, definido como estabilización de la hemodinámica, mejora de la hipertensión pulmonar y de la tensión cardíaca derecha, y supervivencia hasta el alta hospitalaria. No se produjeron hemorragias importantes ni hemorragias intracraneales. Los análisis de subgrupos de este estudio que compararon el USAT con el CDT estándar no revelaron diferencias significativas en los cambios medios de la presión pulmonar, las dosis trombolíticas medias o los tiempos medios de infusión.
Un ensayo multicéntrico prospectivo de un solo brazo, el SEATTLE II 2015,10 evaluó la eficacia del EKOS en una muestra de 159 pacientes. Los pacientes con EP masiva y submasiva recibieron aproximadamente 24 mg de tPA infundidos a través de un catéter durante 12-24 horas. El resultado primario de eficacia fue la disminución de la relación RV/LV medida por TC de tórax desde la línea de base en comparación con las 48 horas posteriores al procedimiento. La relación antes y después del procedimiento fue de 1,55 frente a 1,13, respectivamente (p. inferior a 0,001), lo que indica que EKOS redujo la dilatación del VD. No se observó ninguna hemorragia intracraneal y los investigadores no comentaron los resultados a largo plazo, como la mortalidad o la calidad de vida. El estudio estaba limitado por la falta de un grupo de comparación, como la anticoagulación con heparina como monoterapia, o la trombólisis sistémica o el TDC estándar.
El tratamiento de la EP submasiva varía entre las distintas instituciones. Sencillamente, no existen datos adecuados que comparen la trombólisis sistémica de baja dosis, la TDC, la EKOS y la anticoagulación con heparina estándar para hacer recomendaciones firmes. Algunos investigadores consideran que la trombólisis sistémica de baja dosis es probablemente tan buena como las costosas terapias trombolíticas basadas en catéteres.11,12 El tratamiento trombolítico de baja dosis puede ir seguido del uso de inhibidores directos del factor Xa por vía oral para el mantenimiento de la actividad antitrombótica.13
Línea de fondo
En nuestra institución, el equipo de radiología intervencionista examina caso por caso a los pacientes que cumplen los criterios de EP submasiva. Utilizamos los datos angiográficos pulmonares (naturaleza y extensión del trombo), la estabilidad clínica y el análisis de otras condiciones comórbidas para decidir la mejor modalidad de tratamiento para un paciente individual. Nuestro equipo prefiere la EKOS para los pacientes con EP submasiva, así como para los pacientes con EP masiva y como procedimiento de rescate para los pacientes a los que les ha fallado la trombólisis sistémica.
Hasta que se disponga de más datos que respalden unas directrices firmes, creemos que establecer equipos multidisciplinares compuestos por radiólogos intervencionistas, intensivistas, cardiólogos y cirujanos vasculares es prudente para tomar decisiones individualizadas y conseguir los mejores resultados para nuestros pacientes.14
Filtro de VCI
Dado que la paciente en este caso ya tiene una EP submasiva, ¿puede tolerar una carga adicional de coágulos en caso de que su TVP restante embolice de nuevo? Hay un papel para el filtro de VCI?
La implantación de filtros de VCI ha aumentado significativamente en los últimos 30 años, sin evidencia de calidad que justifique su uso.15
La terapia antitrombótica de 2016 para la enfermedad de TEV: CHEST Guideline and Expert Panel Report lo dice claramente: En pacientes con TVP aguda de la pierna o EP que son tratados con anticoagulantes, no se recomienda el uso de un filtro VCI (Grado 1B).3 Esta recomendación se basa en los resultados del ensayo aleatorio Prevention du Risque d’Embolie Pulmonaire par Interruption Cave (PREPIC),16 y en el ensayo aleatorio PREPIC 2, publicado recientemente,17 que muestran que en pacientes anticoagulados con EP y TVP, la colocación simultánea de un filtro de VCI durante 3 meses no redujo la EP recurrente, incluida la EP mortal.
Las directrices de CHEST establecen que no se debe colocar un filtro de VCI de forma rutinaria como complemento en pacientes con EP y TVP. Sin embargo, ¿qué ocurre en el subgrupo de pacientes con EP submasiva o masiva en los que otra EP sería catastrófica? Se carece de datos clínicos en este ámbito.
Deshpande et al. informaron sobre una serie de seis pacientes con EP masiva e inestabilidad cardiopulmonar; todos los pacientes recibieron un filtro VCI con anticoagulación. El resultado a corto plazo fue excelente, pero no se realizó un seguimiento a largo plazo.18 Kucher y sus colegas informaron de que en el ICOPER de 2006, de los 108 pacientes con EP masiva con una presión arterial sistólica inferior a 90 mm Hg, 11 pacientes recibieron la colocación de un filtro de VCI complementario. Ninguno de estos 11 pacientes desarrolló una EP recurrente en 90 días y 10 de ellos sobrevivieron al menos 90 días; la colocación de un filtro de VCI se asoció a una reducción de la mortalidad a 90 días. En este estudio, la colocación de un filtro VCI fue decidida en su totalidad por los médicos de los distintos centros.19 En un estudio de 2012 en el que se examinaron las tasas de letalidad en 3.770 pacientes con EP aguda a los que se les practicó una embolectomía pulmonar, los datos mostraron que, tanto en los pacientes inestables como en los estables, las tasas de letalidad fueron menores en los que recibieron un filtro VCI.20
Aunque los datos anteriores son favorables a la colocación de un filtro VCI adjunto en pacientes con EP masiva, al menos en los resultados a corto plazo, el pequeño tamaño y la falta de aleatorización impiden establecer directrices basadas en la evidencia. Las directrices del CHEST de 2016 señalan que, dado que no se sabe con certeza si es beneficioso colocar un filtro de VCI de forma adyuvante en pacientes anticoagulados con EP grave, en este subgrupo específico de pacientes puede no aplicarse la recomendación contra la inserción de un filtro de VCI en pacientes con EP aguda que están anticoagulados.3
Línea de fondo
No existe una directriz basada en la evidencia sobre si los filtros de VCI deben colocarse de forma adjunta en pacientes con EP submasiva o masiva; sin embargo, basándose en el consenso de los expertos, puede ser apropiado colocar un filtro de VCI como complemento de la anticoagulación en pacientes con EP grave. La decisión debe ser individualizada en función de las características de cada paciente, sus preferencias y la experiencia institucional.
En nuestro caso, con la esperanza de prevenir una mayor carga embólica, el paciente recibió un filtro de VCI al día siguiente de su presentación. A pesar del inicio de la anticoagulación con heparina, la paciente permaneció taquicárdica y taquipneica, lo que motivó la derivación a un TDC. El equipo de radiología intervencionista no consideró que fuera una buena candidata, dada su hemorragia vaginal persistente y el carcinoma uterino ampliamente metastásico. Se le cambió a enoxaparina terapéutica después de que no se considerara apropiada ninguna otra intervención invasiva. Su estado respiratorio no mejoró y se inició una presión positiva de dos niveles en las vías respiratorias. Teniendo en cuenta la naturaleza terminal de su cáncer, finalmente optó por seguir los cuidados de confort y murió poco después.
Agradecimientos
Los autores desean agradecer a Benjamin A. Hohmuth, MD, A. Joseph Layon, MD, y Luis L. Nadal, MD, por su revisión del artículo y sus valiosos comentarios.
El Dr. Wenqian Wang, el Dr. Vedamurthy y el Dr. Wang trabajan en el departamento de medicina hospitalaria de The Medicine Institute, Geisinger Health System, Danville, Penn. Póngase en contacto con el Dr. Wenqian Wang en .
Puntos clave
– Utilice los datos angiográficos pulmonares, la estabilidad clínica y el análisis de otras afecciones comórbidas para decidir la mejor modalidad de tratamiento.
– Nuestro equipo prefiere la trombólisis mejorada por ultrasonidos (EKOS) para los pacientes con EP submasiva, los pacientes con EP masiva y como procedimiento de rescate para los pacientes en los que falla la trombólisis sistémica.
– Establecer equipos multidisciplinarios compuestos por radiólogos intervencionistas, intensivistas, cardiólogos y cirujanos vasculares es prudente para tomar decisiones individualizadas.
– Puede ser apropiado colocar un filtro de VCI como complemento de la anticoagulación en pacientes con EP grave.
1. Jaff MR, McMurtry MS, Archer SL, et al. Manejo de la embolia pulmonar masiva y submasiva, la trombosis venosa profunda iliofemoral y la hipertensión pulmonar tromboembólica crónica: declaración científica de la American Heart Association. Circulation. 2011;123:1788-1830.
2. Goldhaber SZ, Visani L, De Rosa M. Acute pulmonary embolism: clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER). Lancet. 1999;353:1386-9.
3. Kearon C, Akl EA, Ornelas J, et al. Antithrombotic Therapy for VTE Disease: Guía CHEST e informe del panel de expertos. Chest. 2016;149:315-52.
4. Konstantinides S, Geibel A, Heusel G, Heinrich F, Kasper W. Management Strategies and Prognosis of Pulmonary Embolism-3 Trial Investigators. Heparin plus alteplase compared with heparin alone in patients with submassive pulmonary embolism. N Engl J Med. 2002;347:1143-50.
5. Sharifi M, Bay C, Skrocki L, Rahimi F, Mehdipour M, Investigadores de «MOPETT». Embolia pulmonar moderada tratada con trombólisis (del ensayo «MOPETT»). Am J Cardiol. 2013;111:273-7.
6. Meyer G, Vicaut E, Danays T, et al. Fibrinolysis for patients with intermediate-risk pulmonary embolism. N Engl J Med. 2014;370:1402-11.
7. Kuo WT. Terapia endovascular para la embolia pulmonar aguda. J Vasc Interv Radiol 2012;23:167-79. e164
8. Kucher N, Boekstegers P, Muller OJ, et al. Ensayo aleatorio y controlado de trombólisis asistida por catéter para la embolia pulmonar aguda de riesgo intermedio. Circulation. 2014;129:479-86.
9. Kuo WT, Banerjee A, Kim PS, et al. Pulmonary Embolism Response to Fragmentation, Embolectomy, and Catheter Thrombolysis (PERFECT): Initial Results From a Prospective Multicenter Registry. Chest. 2015;148:667-73.
10. Piazza G, Hohlfelder B, Jaff MR, et al. A Prospective, Single-Arm, Multicenter Trial of Ultrasound-Facilitated, Catheter-Directed, Low-Dose Fibrinolysis for Acute Massive and Submassive Pulmonary Embolism: El estudio SEATTLE II. JACC Cardiovasc Interv. 2015;8:1382-92.
11. Sharifi M. Trombólisis sistémica de dosis completa, media dosis y dirigida por catéter para la embolia pulmonar. Cuándo usar y cómo elegir? Curr Treat Options Cardiovasc Med. 2016;18:31.
12. Wang C, Zhai Z, Yang Y, et al. Eficacia y seguridad del activador del plasminógeno de tipo tisular recombinante en dosis bajas para el tratamiento del tromboembolismo pulmonar agudo: un ensayo aleatorizado, multicéntrico y controlado. Chest. 2010;137:254-62.
13. Sharifi M, Vajo Z, Freeman W, Bay C, Sharifi M, Schwartz F. Transformación y simplificación del tratamiento de la embolia pulmonar: trombólisis de «dosis segura» más nuevos anticoagulantes orales. Lung. 2015;193:369-74.
14. Kabrhel C, Rosovsky R, Channick R, et al. A Multidisciplinary Pulmonary Embolism Response Team: Experiencia inicial de 30 meses con un enfoque novedoso para la prestación de atención a pacientes con embolia pulmonar submasiva y masiva. Chest. 2016;150:384-93.
15. Lessne ML, Sing RF. Contrapunto: ¿Los beneficios superan los riesgos para la mayoría de los pacientes bajo consideración de filtros de vena cava inferior? No. Chest. 2016; 150(6):1182-4.
16. El grupo de estudio PREPIC. Seguimiento de ocho años de pacientes con filtros permanentes de vena cava en la prevención de la embolia pulmonar: el estudio aleatorizado PREPIC (Prevention du Risque d’Embolie Pulmonaire par Interruption Cave). Circulation. 2005;112(3):416-22.
17. Mismetti P, Laporte S, Pellerin O, et al. Effect of a retrievable inferior vena cava filter plus anticoagulation vs. anticoagulation alone on risk of recurrent pulmonary embolism: a randomized clinical trial. JAMA. 2015. 313(16):1627-35.
18. Deshpande KS, Hatem C, Karwa M, et al. El uso del filtro de vena cava inferior como modalidad de tratamiento para la embolia pulmonar masiva. A case series and review of pathophysiology. Respir Med. 2002.96(12):984-9.
19. Kucher N, Rossi E, De Rosa M, et al. Massive Pulmonary embolism. Circulation. 2006;113(4):577-82.
20. Stein P, Matta F. Case Fatality Rate with Pulmonary Embolectomy for Acute Pulmonary Embolism. Am J Med. 2012;125:471-7.