The case
A 49-year-old morbidly obese woman presented to the emergency department with shortness of breath and abdominal distention. Przy przyjęciu jej ciśnienie tętnicze wynosiło 100/60 mm Hg, częstość akcji serca 110, częstość oddechów 24, a saturacja (SpO2) 86% na powietrzu atmosferycznym. Poziom troponiny T był podwyższony i wynosił 0,3 ng/mL. Tomografia komputerowa (CT) klatki piersiowej z dożylnym podaniem kontrastu wykazała siodłową zatorowość płucną (PE) z poszerzoną prawą komorą (RV). Tomografia komputerowa jamy brzusznej i miednicy ujawniła bardzo dużą masę macicy z rozsianą limfadenopatią.
Natychmiast rozpoczęto wlew heparyny. Echokardiogram wykazał odkształcenie RV. Wyniki badania USG duplex kończyn dolnych wskazywały na ostrą zakrzepicę żył głębokich (DVT) obejmującą lewą żyłę udową wspólną i prawą żyłę podkolanową. Biopsja węzła chłonnego nadobojczykowego wykazała niezróżnicowany rak wysokiego stopnia, najprawdopodobniej pochodzenia macicznego.
Pytania kliniczne
Jakie, jeśli w ogóle, opcje terapeutyczne należy rozważyć poza standardową antykoagulacją ogólnoustrojową? Czy istnieje rola dla:
1. Trombolizę ogólnoustrojową?
2. Trombolizę przezcewnikową (CDT)?
3. Założenie filtra do żyły głównej dolnej (IVC)?
Jakie jest właściwe postępowanie w przypadku „submasywnej” zatorowości płucnej?
W przypadku masywnej zatorowości płucnej, w której skrzeplina znajduje się w centralnej części naczyń płucnych i wiąże się z niedociśnieniem z powodu upośledzonego rzutu serca, wskazane jest zastosowanie trombolizy systemowej, embolektomii i CDT jako metod potencjalnie ratujących życie. Dowody są jednak mniej jednoznaczne, gdy ZP jest duży i doprowadził do obciążenia RV, ale bez jawnej niestabilności hemodynamicznej. Taka sytuacja jest powszechnie znana jako zatorowość płucna pośredniego ryzyka lub „submasywna”. Submasywna zatorowość płucna według wytycznych American Heart Association (AHA) to:1
Okres ostrej zatorowości płucnej bez niedociśnienia systemowego (skurczowe ciśnienie tętnicze poniżej 90 mm Hg), ale z dysfunkcją RV lub martwicą mięśnia sercowego. Dysfunkcja RV jest definiowana przez obecność co najmniej jednego z następujących objawów:
– Poszerzenie RV (koniuszkowa 4-jamowa średnica RV podzielona przez średnicę LV większa niż 0.9) lub dysfunkcja skurczowa RV w badaniu echokardiograficznym;
– Poszerzenie RV w badaniu CT, podwyższenie stężenia BNP (większe niż 90 pg/ml), podwyższenie stężenia N-końcowego pro-BNP (większe niż 500 pg/ml);
– Zmiany elektrokardiograficzne (nowy pełny lub niepełny blok prawej odnogi pęczka Hisa, przednio-wschodnie uniesienie lub obniżenie odcinka ST lub przednio-wschodnie odwrócenie załamka T).
Martwica mięśnia sercowego jest definiowana jako podwyższony poziom troponiny I (większy niż 0,4 ng/ml) lub podwyższony poziom troponiny T (większy niż 0,1 ng/ml).
Dlaczego submasywna zatorowość płucna ma znaczenie kliniczne?
W 1999 roku analiza International Cooperative Pulmonary Embolism Registry (ICOPER) wykazała, że dysfunkcja RV u pacjentów z ZP wiązała się z prawie dwukrotnym wzrostem 3-miesięcznego ryzyka śmiertelności (hazard ratio 2,0, 1,3-2,9).2 Biorąc pod uwagę to zwiększone ryzyko, można by wyciągnąć logiczny wniosek, że musimy leczyć submasywną ZP bardziej agresywnie niż ZP bez obciążenia RV. Ale czy to koniecznie spowoduje lepsze wyniki dla pacjenta, biorąc pod uwagę 3% ryzyko krwotoku wewnątrzczaszkowego związane z terapią trombolityczną?
W powyższym scenariuszu klinicznym pacjent spełniał definicję submasywnej ZP. Chociaż u pacjentki nie wystąpiło systemowe niedociśnienie tętnicze, miała poszerzenie RV w CT, dysfunkcję skurczową RV w echo oraz podwyższony poziom Troponiny T. Oprócz rozpoczęcia leczenia przeciwkrzepliwego, co jeszcze należy zrobić, aby zwiększyć prawdopodobieństwo dobrego rokowania?
AHA zaleca rozważenie trombolizy systemowej i CDT u pacjentów z ostrą submasywną ZP, jeśli istnieją dowody kliniczne na niekorzystne rokowanie, w tym pogorszenie niewydolności oddechowej, ciężką dysfunkcję RV lub poważną martwicę mięśnia sercowego oraz niskie ryzyko powikłań krwotocznych (klasa IIB; poziom dowodów C).1
Aktualizacja wytycznych American College of Chest Physicians (CHEST) z 2016 roku3 zaleca systemowo podawaną terapię trombolityczną w porównaniu z brakiem terapii u wybranych pacjentów z ostrą PE, których stan pogarsza się po rozpoczęciu leczenia przeciwkrzepliwego, ale u których nie wystąpiło jeszcze niedociśnienie tętnicze i u których ryzyko krwawienia jest niskie (zalecenie stopnia 2C).
Tromboliza systemowa
Tromboliza systemowa jest podawana jako dożylny wlew trombolityczny dostarczany przez pewien okres czasu. Leki trombolityczne zatwierdzone przez Food and Drug Administration obejmują obecnie tkankowy aktywator plazminogenu (tPA)/alteplazę, streptokinazę i urokinazę.
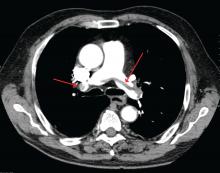 James Heilman, MD (wykorzystane na licencji Creative Commons)
James Heilman, MD (wykorzystane na licencji Creative Commons)
Duży zator płucny w rozwidleniu tętnicy płucnej (zator siodłowy).
W przeprowadzonym w 2002 roku randomizowanym, podwójnie zaślepionym badaniu Pulmonary Embolism-3 Trial,4 Konstantinides i współpracownicy porównali heparynę plus tPA z heparyną plus placebo u 256 pacjentów z submasywną PE. Pierwszorzędowy kliniczny punkt końcowy w postaci zgonu lub konieczności rozszerzenia opieki w szpitalu wynosił 11,0% w grupie tPA w porównaniu z 24,6% w grupie placebo (P = .006); różnica ta wynikała w dużej mierze z rozszerzenia opieki, zdefiniowanego jako użycie wazopresorów, trombolizy ratunkowej, wentylacji mechanicznej, zatrzymania akcji serca i wymogu embolektomii chirurgicznej. Być może zaskakujące jest to, że w żadnej z tych grup nie odnotowano przypadków udaru krwotocznego. W badaniu tym wykazano, że tromboliza systemowa w submasywnej ZP wiąże się z mniejszym ryzykiem zgonu i eskalacji leczenia.
Skuteczność trombolizy w małej dawce badano w badaniu MOPETT 2013,5 jednoośrodkowym, prospektywnym, randomizowanym, otwartym badaniu, w którym 126 uczestników, u których stwierdzono submasywną ZP na podstawie objawów i danych angiograficznych z tomografii komputerowej lub badania wentylacji/perfuzji, otrzymało albo 50 mg tPA plus heparynę, albo samą antykoagulację heparyną. Złożony punkt końcowy w postaci nadciśnienia płucnego i nawrotu ZP w ciągu 28 miesięcy wynosił 16% w grupie otrzymującej tPA w porównaniu z 63% w grupie kontrolnej (P mniej niż .001). Tromboliza systemowa wiązała się z mniejszym ryzykiem wystąpienia nadciśnienia płucnego i nawrotu ZP, chociaż w tym małym badaniu nie zaobserwowano korzyści w zakresie śmiertelności.
W randomizowanym, podwójnie zaślepionym badaniu PEITHO (n = 1 006) z 2014 roku6 porównującym tenekteplazę plus heparynę z heparyną u pacjentów z submasywną PE, pierwszorzędowe wyniki w postaci zgonu i dekompensacji hemodynamicznej wystąpiły u 2,6% w grupie otrzymującej tenekteplazę, w porównaniu z 5,6% w grupie placebo (P = .02). Leczenie trombolityczne wiązało się z 2% odsetkiem udaru krwotocznego, podczas gdy udar krwotoczny w grupie placebo wynosił 0,2% (P = .03). W tym przypadku tromboliza systemowa była związana z 3% mniejszym ryzykiem zgonu i niestabilności hemodynamicznej, ale również z 1,8% zwiększonym ryzykiem udaru krwotocznego.
Tromboliza kierowana cewnikiem (CDT)
CDT została pierwotnie opracowana w celu leczenia zakrzepicy tętnic, przeszczepów dializacyjnych i żył głębokich, ale obecnie jest zatwierdzona przez FDA do leczenia ostrej submasywnej lub masywnej zatorowości płucnej.
Przez zator przeprowadza się drut i umieszcza wielootworowy cewnik infuzyjny, przez który w ciągu 12-24 godzin podawany jest lek trombolityczny. Uważa się, że bezpośrednie dostarczenie leku do skrzepliny jest równie skuteczne jak terapia systemowa, ale wiąże się z mniejszym ryzykiem krwawienia. Jeśli z powodu dużego obciążenia skrzepliny i niestabilności hemodynamicznej wskazane jest szybsze usunięcie skrzepliny, jako uzupełnienie CDT można zastosować terapie mechaniczne, takie jak fragmentacja i aspiracja. Te mechaniczne techniki wiążą się jednak z ryzykiem uszkodzenia tętnicy płucnej i dlatego powinny być stosowane tylko w ostateczności. Do wielootworowego cewnika infuzyjnego można dodać drut emitujący ultradźwięki, aby przyspieszyć trombolizę poprzez ultradźwiękowe rozbicie skrzepliny – technika ta znana jest jako tromboliza wspomagana ultradźwiękami (EKOS).7,10
Badanie ULTIMA 2014,8 małe, randomizowane, otwarte badanie Ultrasound-Assisted Catheter Directed Thrombolysis (USAT, termin ten może być stosowany zamiennie z EKOS) w porównaniu z samą antykoagulacją heparyną u 59 pacjentów, zostało zaprojektowane w celu zbadania, czy ta pierwsza strategia jest lepsza w zakresie poprawy pierwotnego wskaźnika RV/LV u pacjentów z submasywną PE. Średnia redukcja stosunku RV/LV wynosiła 0,30 +/- 0,20 w grupie USAT w porównaniu do 0,03 +/- 0,16 w grupie heparyny (P mniej niż .001). Nie zaobserwowano jednak istotnej różnicy w śmiertelności lub krwawieniu w grupach w 90-dniowej obserwacji.
The PERFECT 2015 Trial,9 wieloośrodkowe badanie oparte na rejestrze, prospektywnie włączyło 101 pacjentów, którzy otrzymali CDT jako terapię pierwszego rzutu dla masywnej i submasywnej PE. Wśród pacjentów z submasywną ZP u 97,3% stwierdzono „sukces kliniczny” tego leczenia, definiowany jako stabilizacja hemodynamiki, poprawa w zakresie nadciśnienia płucnego i obciążenia prawego serca oraz przeżycie do wypisu ze szpitala. Nie odnotowano poważnych krwawień ani krwotoków wewnątrzczaszkowych. Analizy podgrup w tym badaniu porównujące USAT ze standardową CDT nie wykazały istotnych różnic w średnich zmianach ciśnienia płucnego, średnich dawkach trombolitycznych lub średnich czasach infuzji.
W prospektywnym, jednoramiennym, wieloośrodkowym badaniu SEATTLE II 2015,10 oceniano skuteczność EKOS w próbie 159 pacjentów. Pacjenci zarówno z masywnym, jak i submasywnym PE otrzymywali około 24 mg tPA wlewanego przez cewnik w ciągu 12-24 godzin. Pierwszorzędowym wynikiem skuteczności było zmniejszenie stosunku RV/LV mierzonego w TK klatki piersiowej od wartości wyjściowej w porównaniu z 48 godzinami po zabiegu. Stosunek przed i po zabiegu wynosił odpowiednio 1,55 versus 1,13 (P mniej niż .001), wskazując, że EKOS zmniejszył poszerzenie RV. Nie zaobserwowano krwawienia wewnątrzczaszkowego, a badacze nie wypowiedzieli się na temat długoterminowych wyników, takich jak śmiertelność czy jakość życia. Ograniczeniem badania był brak grupy porównawczej, takiej jak antykoagulacja heparyną jako monoterapia, tromboliza systemowa lub standardowa CDT.
Terapia submasywnej PE różni się w zależności od instytucji. Po prostu nie ma wystarczających danych porównujących trombolizę systemową w małej dawce, CDT, EKOS i standardową antykoagulację heparyną, aby sformułować wiążące zalecenia. Niektórzy badacze uważają, że systemowa tromboliza w małej dawce jest prawdopodobnie równie dobra jak drogie terapie trombolityczne oparte na cewnikach.11,12 Po terapii trombolitycznej w małej dawce można zastosować doustne bezpośrednie inhibitory czynnika Xa w celu utrzymania aktywności przeciwzakrzepowej.13
Dolna granica
W naszym ośrodku zespół radiologii interwencyjnej bada pacjentów, którzy spełniają kryteria submasywnej zatorowości płucnej, indywidualnie. Wykorzystujemy dane z angiografii płucnej (charakter i rozległość skrzepliny), stabilność kliniczną i analizę innych chorób współistniejących, aby zdecydować o najlepszej metodzie leczenia dla danego pacjenta. Nasz zespół preferuje EKOS u pacjentów z submasywną ZP, jak również u pacjentów z masywną ZP oraz jako procedurę ratunkową u pacjentów, u których nie powiodła się tromboliza systemowa.
Dopóki nie będzie dostępnych więcej danych, które mogłyby stanowić podstawę do opracowania wiążących wytycznych, uważamy, że tworzenie multidyscyplinarnych zespołów składających się z radiologów interwencyjnych, intensywistów, kardiologów i chirurgów naczyniowych jest rozsądne, aby podejmować zindywidualizowane decyzje i osiągać najlepsze wyniki u naszych pacjentów.14
Filtr IVC
Ponieważ pacjentka w tym przypadku ma już submasywną PE, czy może tolerować dodatkowe obciążenie skrzepem w przypadku ponownej embolizacji pozostałej DVT? Czy istnieje rola dla filtra IVC?
Wszczepianie filtrów IVC znacznie wzrosło w ciągu ostatnich 30 lat, bez wysokiej jakości dowodów uzasadniających ich stosowanie.15
The 2016 Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report stwierdza jednoznacznie: U pacjentów z ostrą DVT kończyny dolnej lub PE, którzy są leczeni antykoagulantami, stosowanie filtra IVC nie jest zalecane (stopień 1B).3 Zalecenie to opiera się na wynikach randomizowanego badania Prevention du Risque d’Embolie Pulmonaire par Interruption Cave (PREPIC),16 oraz niedawno opublikowanego randomizowanego badania PREPIC 2,17 w których wykazano, że u leczonych antykoagulacyjnie pacjentów z ZP i DVT jednoczesne założenie filtra IVC na 3 miesiące nie zmniejszyło częstości nawrotów ZP, w tym ZP ze skutkiem śmiertelnym.
Wytyczne CHEST stwierdzają, że filtr IVC nie powinien być rutynowo zakładany jako uzupełnienie leczenia u pacjentów z ZP i DVT. Co jednak z podgrupą pacjentów z submasywną lub masywną ztp, u których kolejna ztp miałaby katastrofalne skutki? Brakuje danych klinicznych w tym zakresie.
Deshpande i wsp. przedstawili serię sześciu pacjentów z masywną ZP i niestabilnością krążeniowo-oddechową; wszyscy otrzymali filtr IVC z antykoagulacją. Wynik krótkoterminowy był doskonały, ale nie przeprowadzono długoterminowej obserwacji.18 Kucher i współpracownicy donieśli, że w badaniu ICOPER w 2006 roku spośród 108 pacjentów z masywną zatorowością płucną ze skurczowym ciśnieniem tętniczym poniżej 90 mm Hg u 11 pacjentów założono filtr IVC. U żadnego z tych 11 pacjentów nie doszło do nawrotu ZP w ciągu 90 dni, a 10 z nich przeżyło co najmniej 90 dni; założenie filtra IVC wiązało się ze zmniejszeniem 90-dniowej śmiertelności. W tym badaniu o założeniu filtra IVC decydowali wyłącznie lekarze z różnych ośrodków.19 W badaniu z 2012 r. analizującym śmiertelność wśród 3770 pacjentów z ostrą zatorowością płucną, u których wykonano embolektomię płucną, dane wykazały, że zarówno u pacjentów niestabilnych, jak i stabilnych śmiertelność była mniejsza u tych, u których założono filtr IVC.20
Chociaż powyższe dane są korzystne dla adiunktywnego zakładania filtra IVC u pacjentów z masywną PE, przynajmniej w odniesieniu do wyników krótkoterminowych, niewielki rozmiar i brak randomizacji wykluczają ustalenie wytycznych opartych na dowodach. W wytycznych CHEST z 2016 r. zwrócono uwagę, że ponieważ nie ma pewności, czy założenie filtra dożylnego u pacjentów z ciężką zatorowością płucną poddawanych antykoagulacji przynosi korzyści, w tej szczególnej podgrupie pacjentów zalecenie, aby nie zakładać filtra dożylnego u pacjentów z ostrą zatorowością płucną poddawanych antykoagulacji, może nie mieć zastosowania.3
Dolna granica
Nie ma wytycznych opartych na dowodach dotyczących tego, czy filtr IVC powinien być zakładany jako uzupełnienie antykoagulacji u pacjentów z submasywną lub masywną zatorowością płucną; jednak na podstawie konsensusu ekspertów może być wskazane założenie filtra IVC jako uzupełnienie antykoagulacji u pacjentów z ciężką zatorowością płucną. Decyzja powinna być zindywidualizowana w oparciu o charakterystykę każdego pacjenta, jego preferencje i doświadczenie instytucjonalne.
W naszym przypadku, w nadziei na zapobieżenie dalszemu obciążeniu zatorowemu, pacjent otrzymał filtr IVC dzień po prezentacji. Pomimo rozpoczęcia antykoagulacji heparyną, pacjentka pozostawała tachykardyczna i tachypatyczna, co skłoniło ją do skierowania na CDT. Zespół radiologii interwencyjnej nie uznał jej za dobrą kandydatkę, biorąc pod uwagę utrzymujące się krwawienie z pochwy i raka macicy z dużymi przerzutami. Po uznaniu, że dalsza interwencja inwazyjna nie jest wskazana, pacjentka została przełączona na terapeutyczną enoksaparynę. Jej stan oddechowy nie uległ poprawie i rozpoczęto stosowanie żółciowego dodatniego ciśnienia w drogach oddechowych. Biorąc pod uwagę terminalny charakter jej raka, ostatecznie zdecydowała się na opiekę komfortową i zmarła wkrótce potem.
Podziękowania
Autorzy chcieliby podziękować Benjaminowi A. Hohmuthowi, MD, A. Josephowi Layonowi, MD, i Luisowi L. Nadal, MD, za recenzję artykułu i nieocenione uwagi.
Dr Wenqian Wang, dr Vedamurthy i dr Wang pracują na oddziale medycyny szpitalnej w The Medicine Institute, Geisinger Health System, Danville, Penn. Skontaktuj się z dr Wenqian Wang pod adresem .
Kluczowe punkty
– Wykorzystaj dane z angiografii płucnej, stabilność kliniczną i analizę innych chorób współistniejących, aby podjąć decyzję o najlepszej metodzie leczenia.
– Nasz zespół preferuje trombolizę wspomaganą ultrasonograficznie (EKOS) u pacjentów z ZP podmasywnym, masywnym oraz jako procedurę ratunkową u pacjentów, u których nie powiodła się tromboliza systemowa.
– Tworzenie wielodyscyplinarnych zespołów składających się z radiologów interwencyjnych, intensywistów, kardiologów i chirurgów naczyniowych jest wskazane w celu podejmowania zindywidualizowanych decyzji.
– Założenie filtra IVC jako uzupełnienie antykoagulacji u pacjentów z ciężką ZP może być właściwe.
1. Jaff MR, McMurtry MS, Archer SL, et al. Management of massive and submassive pulmonary embolism, iliofemoral deep vein thrombosis, and chronic thromboembolic pulmonary hypertension: a scientific statement from the American Heart Association. Circulation. 2011;123:1788-1830.
2. Goldhaber SZ, Visani L, De Rosa M. Acute pulmonary embolism: clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER). Lancet. 1999;353:1386-9.
3. Kearon C, Akl EA, Ornelas J, et al. Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report. Chest. 2016;149:315-52.
4. Konstantinides S, Geibel A, Heusel G, Heinrich F, Kasper W. Management Strategies and Prognosis of Pulmonary Embolism-3 Trial Investigators. Heparin plus alteplase compared with heparin alone in patients with submassive pulmonary embolism. N Engl J Med. 2002;347:1143-50.
5. Sharifi M, Bay C, Skrocki L, Rahimi F, Mehdipour M, „MOPETT” Investigators. Moderate pulmonary embolism treated with thrombolysis (from the „MOPETT” Trial). Am J Cardiol. 2013;111:273-7.
6. Meyer G, Vicaut E, Danays T, et al. Fibrinolysis for patients with intermediate-risk pulmonary embolism. N Engl J Med. 2014;370:1402-11.
7. Kuo WT. Endovascular therapy for acute pulmonary embolism. J Vasc Interv Radiol 2012;23:167-79. e164
8. Kucher N, Boekstegers P, Muller OJ, et al. Randomized, controlled trial of ultrasound-assisted catheter-directed thrombolysis for acute intermediate-risk pulmonary embolism. Circulation. 2014;129:479-86.
9. Kuo WT, Banerjee A, Kim PS, et al. Pulmonary Embolism Response to Fragmentation, Embolectomy, and Catheter Thrombolysis (PERFECT): Initial Results From a Prospective Multicenter Registry. Chest. 2015;148:667-73.
10. Piazza G, Hohlfelder B, Jaff MR, et al. A Prospective, Single-Arm, Multicenter Trial of Ultrasound-Facilitated, Catheter-Directed, Low-Dose Fibrinolysis for Acute Massive and Submassive Pulmonary Embolism: The SEATTLE II Study. JACC Cardiovasc Interv. 2015;8:1382-92.
11. Sharifi M. Systemic Full Dose, Half Dose, and Catheter Directed Thrombolysis for Pulmonary Embolism. When to Use and How to Choose? Curr Treat Options Cardiovasc Med. 2016;18:31.
12. Wang C, Zhai Z, Yang Y, et al. Efficacy and safety of low dose recombinant tissue-type plasminogen activator for the treatment of acute pulmonary thromboembolism: a randomized, multicenter, controlled trial. Chest. 2010;137:254-62.
13. Sharifi M, Vajo Z, Freeman W, Bay C, Sharifi M, Schwartz F. Transforming and simplifying the treatment of pulmonary embolism: „safe dose” thrombolysis plus new oral anticoagulants. Lung. 2015;193:369-74.
14. Kabrhel C, Rosovsky R, Channick R, et al. A Multidisciplinary Pulmonary Embolism Response Team: Initial 30-Month Experience With a Novel Approach to Delivery of Care to Patients With Submassive and Massive Pulmonary Embolism. Chest. 2016;150:384-93.
15. Lessne ML, Sing RF. Counterpoint: Do the Benefits Outweigh the Risks for Most Patients Under Consideration for inferior vena cava filters? No. Chest. 2016; 150(6):1182-4.
16. The PREPIC Study Group. Eight-year follow-up of patients with permanent vena cava filters in the prevention of pulmonary embolism: the PREPIC (Prevention du Risque d’Embolie Pulmonaire par Interruption Cave) randomized study. Circulation. 2005;112(3):416-22.
17. Mismetti P, Laporte S, Pellerin O, et al. Effect of a retrievable inferior vena cava filter plus anticoagulation vs. anticoagulation alone on risk of recurrent pulmonary embolism: a randomized clinical trial. JAMA. 2015. 313(16):1627-35.
18. Deshpande KS, Hatem C, Karwa M, et al. The use of inferior vena cava filter as a treatment modality for massive pulmonary embolism. A case series and review of pathophysiology. Respir Med. 2002.96(12):984-9.
19. Kucher N, Rossi E, De Rosa M, et al. Massive Pulmonary embolism. Circulation. 2006;113(4):577-82.
20. Stein P, Matta F. Case Fatality Rate with Pulmonary Embolectomy for Acute Pulmonary Embolism. Am J Med. 2012;125:471-7.