Le cas
Une femme de 49 ans souffrant d’obésité morbide s’est présentée aux urgences avec un essoufflement et une distension abdominale. À la présentation, sa tension artérielle était de 100/60 mm Hg avec une fréquence cardiaque de 110, une fréquence respiratoire de 24 et une saturation oxymétrique du pouls (SpO2) de 86 % à l’air ambiant. La troponine T était élevée à 0,3 ng/mL. La tomodensitométrie (TDM) du thorax avec contraste intraveineux a révélé une embolie pulmonaire (EP) en selle avec un ventricule droit (VD) dilaté. La tomographie abdominale/pelvienne a révélé une très grosse masse utérine avec des lymphadénopathies diffuses.
La perfusion d’héparine a été commencée rapidement. L’échocardiogramme a démontré une déformation du VR. Les résultats de l’échographie duplex des extrémités inférieures étaient compatibles avec des thromboses veineuses profondes (TVP) aiguës impliquant la veine fémorale commune gauche et la veine poplitée droite. La biopsie d’un ganglion lymphatique supraclaviculaire a révélé un carcinome indifférencié de haut grade très probablement d’origine utérine.
Questions cliniques
Quelles options thérapeutiques, le cas échéant, devraient être envisagées au-delà de l’anticoagulation systémique standard ? Y a-t-il un rôle pour :
1. La thrombolyse systémique ?
2. la thrombolyse dirigée par cathéter (CDT) ?
3. la pose d’un filtre sur la veine cave inférieure (VCI) ?
Quelle est la prise en charge appropriée de l’EP » submassive » ?
Dans le cas d’une EP massive, où le thrombus est situé dans le système vasculaire pulmonaire central et associé à une hypotension due à une altération du débit cardiaque, la thrombolyse systémique, l’embolectomie et la TCD sont indiquées comme mesures potentiellement salvatrices. Cependant, les preuves sont moins claires lorsque l’EP est de grande taille et a entraîné une tension du VR, mais sans instabilité hémodynamique manifeste. C’est ce qu’on appelle communément une EP à risque intermédiaire ou « submassive ». Selon les lignes directrices de l’American Heart Association (AHA), l’EP submassive est:1
Une EP aiguë sans hypotension systémique (pression artérielle systolique inférieure à 90 mm Hg) mais avec une dysfonction du VR ou une nécrose du myocarde. Le dysfonctionnement du VR est défini par la présence d’au moins un des éléments suivants :
– Dilatation du VR (diamètre apical du VR à 4 chambres divisé par le diamètre du VG supérieur à 0.9) ou dysfonction systolique du VR à l’échocardiographie ;
– Dilatation du VR au scanner, élévation du BNP (supérieure à 90 pg/mL), élévation du pro-BNP N-terminal (supérieure à 500 pg/mL) ;
– Modifications électrocardiographiques (nouveau bloc de branche droit complet ou incomplet, élévation ou dépression ST antéroseptale, ou inversion d’onde T antéroseptale).
La nécrose myocardique est définie par une élévation de la troponine I (supérieure à 0,4 ng/mL) ou une élévation de la troponine T (supérieure à 0,1 ng/mL).
Pourquoi l’EP submassive a-t-elle une importance clinique ?
En 1999, l’analyse de l’International Cooperative Pulmonary Embolism Registry (ICOPER) a révélé que le dysfonctionnement du VR chez les patients atteints d’EP était associé à un quasi-doublement du risque de mortalité à 3 mois (hazard ratio 2,0, 1,3-2,9).2 Compte tenu de cette augmentation du risque, on pourrait tirer la conclusion logique que nous devons traiter l’EP submassive de manière plus agressive que l’EP sans contrainte du VR. Mais cela se traduira-t-il nécessairement par un meilleur résultat pour le patient compte tenu du risque de 3 % d’hémorragie intracrânienne associé au traitement thrombolytique ?
Dans le scénario clinique ci-dessus, le patient répondait bien à la définition de l’EP submassive. Bien que la patiente n’ait pas souffert d’hypotension systémique, elle présentait une dilatation du ventricule droit au scanner, une dysfonction systolique du ventricule droit à l’écho ainsi qu’un taux de troponine T élevé. Outre la mise en place d’un traitement anticoagulant, que faut-il faire de plus pour augmenter sa probabilité de bon résultat ?
L’AHA recommande d’envisager une thrombolyse systémique et une TCD pour les patients atteints d’EP aiguë submassive s’ils présentent des signes cliniques de pronostic défavorable, notamment une aggravation de l’insuffisance respiratoire, un dysfonctionnement grave du VR ou une nécrose myocardique majeure et un faible risque de complications hémorragiques (classe IIB ; niveau de preuve C).1
La mise à jour 2016 des lignes directrices de l’American College of Chest Physicians (CHEST)3 recommande un traitement thrombolytique administré par voie systémique plutôt que l’absence de traitement chez certains patients atteints d’EP aiguë dont l’état se détériore après l’instauration d’un traitement anticoagulant mais qui n’ont pas encore développé d’hypotension et qui présentent un faible risque hémorragique (recommandation de grade 2C).
Trombolyse systémique
La thrombolyse systémique est administrée sous forme de perfusion thrombolytique intraveineuse délivrée sur une période de temps. Les médicaments thrombolytiques approuvés par la Food and Drug Administration comprennent actuellement l’activateur tissulaire du plasminogène (tPA)/altéplase, la streptokinase et l’urokinase.
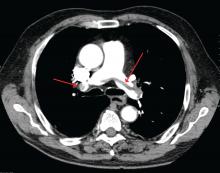 James Heilman, MD (utilisé sous licence Creative Commons)
James Heilman, MD (utilisé sous licence Creative Commons)
Une grosse embolie pulmonaire à la bifurcation de l’artère pulmonaire (embolie en selle).
Dans l’essai Pulmonary Embolism-3 de 2002, randomisé et en double aveugle,4 Konstantinides et ses collègues ont comparé l’héparine plus tPA à l’héparine plus placebo chez 256 patients présentant une EP submassive. Le critère d’évaluation clinique principal, à savoir le décès ou l’escalade des soins à l’hôpital, était de 11,0 % dans le groupe tPA contre 24,6 % dans le groupe placebo (P = 0,006) ; la différence était due en grande partie à l’escalade des soins, définie comme le recours à des vasopresseurs, à une thrombolyse de secours, à une ventilation mécanique, à un arrêt cardiaque et à la nécessité d’une embolectomie chirurgicale. Il est peut-être surprenant de constater qu’aucun cas d’AVC hémorragique n’a été enregistré dans l’un ou l’autre de ces groupes. L’essai a démontré que la thrombolyse systémique dans les cas d’EP submassive était associée à un risque plus faible de décès et d’escalade thérapeutique.
L’efficacité de la thrombolyse à faible dose a été étudiée dans l’étude MOPETT 2013,5 une étude monocentrique, prospective, randomisée, ouverte, dans laquelle 126 participants considérés comme ayant une EP submassive sur la base de symptômes et de données angiographiques CT ou de scintigraphie de ventilation/perfusion ont reçu soit 50 mg de tPA plus héparine, soit une anticoagulation par héparine seule. Le critère composite d’hypertension pulmonaire et d’EP récurrente à 28 mois était de 16 % dans le groupe tPA contre 63 % dans le groupe témoin (P inférieur à 0,001). La thrombolyse systémique a été associée à un risque plus faible d’hypertension pulmonaire et d’EP récurrente, bien qu’aucun avantage en termes de mortalité n’ait été observé dans cette petite étude.
Dans l’essai randomisé en double aveugle PEITHO (n = 1 006) de 20146 comparant la tenecteplase plus l’héparine à l’héparine chez les patients atteints d’EP submassive, les résultats primaires de décès et de décompensation hémodynamique sont survenus dans 2,6 % du groupe tenecteplase, contre 5,6 % dans le groupe placebo (P = 0,02). Le traitement thrombolytique a été associé à un taux d’AVC hémorragique de 2 %, alors que l’AVC hémorragique dans le groupe placebo était de 0,2 % (P = 0,03). Dans ce cas, la thrombolyse systémique a été associée à un risque inférieur de 3 % de décès et d’instabilité hémodynamique, mais aussi à un risque accru de 1,8 % d’AVC hémorragique.
Thrombolyse dirigée par cathéter (TDC)
La TDC a été développée à l’origine pour traiter les thromboses artérielles, les thromboses de greffons de dialyse et les thromboses veineuses profondes, mais elle est maintenant approuvée par la FDA pour le traitement de l’EP aiguë submassive ou massive.
Un fil est passé à travers l’embole et un cathéter de perfusion à plusieurs trous est placé, à travers lequel un médicament thrombolytique est perfusé sur 12-24 heures. L’administration directe du médicament dans le thrombus est considérée comme aussi efficace que le traitement systémique, mais avec un risque de saignement plus faible. Si une élimination plus rapide du thrombus est indiquée en raison d’une charge importante de caillots et d’une instabilité hémodynamique, des thérapies mécaniques, telles que la fragmentation et l’aspiration, peuvent être utilisées en complément de la CDT. Cependant, ces techniques mécaniques comportent un risque de lésion de l’artère pulmonaire et ne doivent donc être utilisées qu’en dernier recours. Un fil émettant des ultrasons peut être ajouté au cathéter de perfusion multitrou pour accélérer la thrombolyse en perturbant le thrombus par ultrasons, une technique connue sous le nom de thrombolyse améliorée par ultrasons (EKOS).7,10
L’essai ULTIMA 20148, une petite étude randomisée et ouverte sur la thrombolyse assistée par cathéter (USAT, le terme peut être utilisé de manière interchangeable avec EKOS) par rapport à l’anticoagulation à l’héparine seule chez 59 patients, a été conçu pour étudier si la première stratégie était plus efficace pour améliorer le critère d’évaluation primaire du rapport RV/LV chez les patients atteints d’EP submassive. La réduction moyenne du rapport RV/LV était de 0,30 +/- 0,20 dans le groupe USAT par rapport à 0,03 +/- 0,16 dans le groupe héparine (P inférieur à 0,001). Cependant, aucune différence significative en termes de mortalité ou d’hémorragie n’a été observée dans les groupes lors du suivi à 90 jours.
L’essai PERFECT 2015,9 une étude multicentrique basée sur un registre, a recruté de manière prospective 101 patients qui ont reçu une CDT comme traitement de première intention pour une EP massive et submassive. Parmi les patients atteints d’EP submassive, 97,3 % ont connu un » succès clinique » avec ce traitement, défini par la stabilisation de l’hémodynamique, l’amélioration de l’hypertension pulmonaire et de la tension cardiaque droite, et la survie jusqu’à la sortie de l’hôpital. Il n’y a pas eu de saignement majeur ni d’hémorragie intracrânienne. Les analyses de sous-groupes de cette étude comparant l’USAT à la CDT standard n’ont pas révélé de différence significative dans les changements de pression pulmonaire moyenne, les doses thrombolytiques moyennes ou les temps de perfusion moyens.
Un essai prospectif multicentrique à un bras, SEATTLE II 2015,10 a évalué l’efficacité d’EKOS sur un échantillon de 159 patients. Les patients présentant à la fois une EP massive et submassive ont reçu environ 24 mg de tPA en perfusion via un cathéter sur 12 à 24 heures. Le principal critère d’efficacité était la diminution du rapport RV/LV mesuré par tomodensitométrie thoracique par rapport à la valeur de base et 48 heures après l’intervention. Le rapport avant et après l’intervention était de 1,55 contre 1,13 respectivement (P inférieur à 0,001), ce qui indique que EKOS a réduit la dilatation du VR. Aucune hémorragie intracrânienne n’a été observée et les investigateurs n’ont pas fait de commentaires sur les résultats à long terme tels que la mortalité ou la qualité de vie. L’étude a été limitée par l’absence d’un groupe de comparaison, tel que l’anticoagulation avec l’héparine en monothérapie, ou la thrombolyse systémique ou la TCD standard.
Le traitement de l’EP submassive varie entre les différentes institutions. Il n’existe tout simplement pas de données suffisantes comparant la thrombolyse systémique à faible dose, le CDT, l’EKOS et l’anticoagulation standard à l’héparine pour faire des recommandations fermes. Certains chercheurs estiment que la thrombolyse systémique à faible dose est probablement aussi bonne que les thérapies thrombolytiques coûteuses basées sur le cathéter.11,12 Le traitement thrombolytique à faible dose peut être suivi de l’utilisation d’inhibiteurs directs du facteur Xa par voie orale pour le maintien de l’activité antithrombotique.13
Ligne de fond
Dans notre institution, l’équipe de radiologie interventionnelle examine au cas par cas les patients qui répondent aux critères d’EP submassive. Nous utilisons les données de l’angiographie pulmonaire (nature et étendue du thrombus), la stabilité clinique et l’analyse des autres comorbidités pour décider de la meilleure modalité de traitement pour un patient donné. Notre équipe préfère l’EKOS pour les patients atteints d’EP submassive ainsi que pour les patients atteints d’EP massive et comme procédure de sauvetage pour les patients qui ont échoué la thrombolyse systémique.
En attendant que davantage de données soient disponibles pour soutenir des directives fermes, nous pensons que la mise en place d’équipes multidisciplinaires composées de radiologues interventionnels, d’intensivistes, de cardiologues et de chirurgiens vasculaires est prudente pour prendre des décisions individualisées et obtenir les meilleurs résultats pour nos patients14.
Filtre IVC
Puisque la patiente dans ce cas a déjà une EP submassive, peut-elle tolérer une charge supplémentaire de caillots si sa TVP restante embolise à nouveau ? Y a-t-il un rôle pour le filtre IVC ?
L’implantation de filtres IVC a augmenté de manière significative au cours des 30 dernières années, sans que des preuves de qualité ne justifient leur utilisation.15
Le traitement antithrombotique 2016 pour la maladie TEV : CHEST Guideline and Expert Panel Report l’affirme clairement : Chez les patients présentant une TVP aiguë de la jambe ou une EP et traités par anticoagulants, l’utilisation d’un filtre VCI n’est pas recommandée (grade 1B).Cette recommandation est basée sur les résultats de l’essai randomisé PREPIC (Prevention du Risque d’Embolie Pulmonaire par Interruption Cave),16 et de l’essai randomisé PREPIC 2 récemment publié,17 qui montrent tous deux que chez les patients anticoagulés souffrant d’EP et de TVP, la pose simultanée d’un filtre IVC pendant 3 mois ne réduit pas les EP récurrentes, y compris les EP mortelles.
Les directives de la CHEST stipulent qu’un filtre IVC ne doit pas être placé systématiquement comme adjuvant chez les patients souffrant d’EP et de TVP. Cependant, qu’en est-il du sous-groupe de patients présentant une EP submassive ou massive chez qui une autre EP serait catastrophique ? Les données cliniques manquent dans ce domaine.
Deshpande et al. ont rapporté une série de six patients présentant une EP massive et une instabilité cardiopulmonaire ; les patients ont tous reçu un filtre IVC avec une anticoagulation. Les résultats à court terme étaient excellents, mais aucun suivi à long terme n’a été effectué.18 Kucher et ses collègues ont rapporté que dans le cadre de l’étude ICOPER de 2006, sur les 108 patients souffrant d’EP massive avec une pression artérielle systolique inférieure à 90 mm Hg, 11 patients ont reçu un filtre IVC en complément. Aucun de ces 11 patients n’a développé d’EP récurrente dans les 90 jours et 10 d’entre eux ont survécu au moins 90 jours ; la pose d’un filtre IVC a été associée à une réduction de la mortalité à 90 jours. Dans cette étude, la mise en place d’un filtre à CIV était entièrement décidée par les médecins des différents sites.19 Dans une étude de 2012 examinant les taux de létalité chez 3 770 patients atteints d’EP aiguë ayant subi une embolectomie pulmonaire, les données ont montré que, tant chez les patients instables que chez les patients stables, les taux de létalité étaient plus faibles chez ceux qui avaient reçu un filtre à CIV20.
Bien que les données ci-dessus soient favorables à la pose d’un filtre IVC en appoint chez les patients atteints d’EP massive, du moins en ce qui concerne les résultats à court terme, la petite taille et l’absence de randomisation empêchent l’établissement de lignes directrices fondées sur des preuves. Les lignes directrices 2016 du CHEST soulignent qu’étant donné qu’il n’est pas certain qu’il y ait un avantage à placer un filtre IVC de manière adjuvante chez les patients anticoagulés atteints d’EP grave, dans ce sous-groupe spécifique de patients, la recommandation contre l’insertion d’un filtre IVC chez les patients atteints d’EP aiguë qui sont anticoagulés pourrait ne pas s’appliquer3.
La ligne de fond
Il n’y a pas de ligne directrice fondée sur des preuves quant à savoir si les filtres IVC devraient être placés de manière adjuvante chez les patients présentant une EP submassive ou massive ; cependant, sur la base d’un consensus d’experts, il peut être approprié de placer un filtre IVC en tant qu’adjuvant à l’anticoagulation chez les patients présentant une EP grave. La décision doit être individualisée en fonction des caractéristiques, des préférences et de l’expertise institutionnelle de chaque patient.
Dans notre cas, dans l’espoir de prévenir une charge embolique supplémentaire, le patient a reçu un filtre IVC le jour suivant la présentation. Malgré l’initiation de l’anticoagulation avec de l’héparine, elle est restée tachycardique et tachypnéique, ce qui a incité à référer la patiente pour un CDT. L’équipe de radiologie interventionnelle a estimé qu’elle n’était pas une bonne candidate, étant donné ses saignements vaginaux persistants et son carcinome utérin largement métastatique. Elle est passée à l’énoxaparine thérapeutique après qu’aucune autre intervention invasive n’ait été jugée appropriée. Son état respiratoire ne s’est pas amélioré et une pression positive à deux niveaux a été mise en place. Compte tenu de la nature terminale de son cancer, elle a finalement choisi de poursuivre des soins de confort et est décédée peu de temps après.
Reconnaissance
Les auteurs tiennent à remercier Benjamin A. Hohmuth, MD, A. Joseph Layon, MD, et Luis L. Nadal, MD, pour leur révision de l’article et leurs précieux commentaires.
Le Dr Wenqian Wang, le Dr Vedamurthy et le Dr Wang sont basés dans le département de médecine hospitalière de The Medicine Institute, Geisinger Health System, Danville, Penn. Contactez le Dr Wenqian Wang à .
Points clés
– Utilisez les données angiographiques pulmonaires, la stabilité clinique et l’analyse des autres conditions comorbides pour décider de la meilleure modalité de traitement.
– Notre équipe préfère la thrombolyse améliorée par ultrasons (EKOS) pour les patients atteints d’EP submassive, les patients atteints d’EP massive et comme procédure de secours pour les patients qui échouent à la thrombolyse systémique.
– La mise en place d’équipes multidisciplinaires composées de radiologues interventionnels, d’intensivistes, de cardiologues et de chirurgiens vasculaires est prudente pour prendre des décisions individualisées.
– Il peut être approprié de placer un filtre IVC en complément de l’anticoagulation chez les patients atteints d’EP grave.
1. Jaff MR, McMurtry MS, Archer SL, et al. Gestion de l’embolie pulmonaire massive et submassive, de la thrombose veineuse profonde iliofémorale et de l’hypertension pulmonaire thromboembolique chronique : déclaration scientifique de l’American Heart Association. Circulation. 2011;123:1788-1830.
2. Goldhaber SZ, Visani L, De Rosa M. Embolie pulmonaire aiguë : résultats cliniques dans le registre international coopératif des embolies pulmonaires (ICOPER). Lancet. 1999;353:1386-9.
3. Kearon C, Akl EA, Ornelas J, et al. Antithrombotic Therapy for VTE Disease : Ligne directrice de CHEST et rapport du groupe d’experts. Chest. 2016;149:315-52.
4. Konstantinides S, Geibel A, Heusel G, Heinrich F, Kasper W. Management Strategies and Prognosis of Pulmonary Embolism-3 Trial Investigators. Héparine plus alteplase par rapport à l’héparine seule chez les patients souffrant d’embolie pulmonaire submassive. N Engl J Med. 2002;347:1143-50.
5. Sharifi M, Bay C, Skrocki L, Rahimi F, Mehdipour M, « MOPETT » Investigators. Embolie pulmonaire modérée traitée par thrombolyse (d’après l’essai « MOPETT »). Am J Cardiol. 2013;111:273-7.
6. Meyer G, Vicaut E, Danays T, et al. Fibrinolyse pour les patients présentant une embolie pulmonaire à risque intermédiaire. N Engl J Med. 2014;370:1402-11.
7. Kuo WT. Traitement endovasculaire de l’embolie pulmonaire aiguë. J Vasc Interv Radiol 2012;23:167-79. e164
8. Kucher N, Boekstegers P, Muller OJ, et al. Essai randomisé et contrôlé de la thrombolyse dirigée par cathéter assistée par ultrasons pour l’embolie pulmonaire aiguë à risque intermédiaire. Circulation. 2014;129:479-86.
9. Kuo WT, Banerjee A, Kim PS, et al. Réponse de l’embolie pulmonaire à la fragmentation, l’embolectomie et la thrombolyse par cathéter (PERFECT) : Initial Results From a Prospective Multicenter Registry. Chest. 2015;148:667-73.
10. Piazza G, Hohlfelder B, Jaff MR, et al. A Prospective, Single-Arm, Multicenter Trial of Ultrasound-Facilitated, Catheter-Directed, Low-Dose Fibrinolysis for Acute Massive and Submassive Pulmonary Embolism : L’étude SEATTLE II. JACC Cardiovasc Interv. 2015;8:1382-92.
11. Sharifi M. Thrombolyse systémique à dose complète, à demi-dose et dirigée par cathéter pour l’embolie pulmonaire. Quand utiliser et comment choisir ? Curr Treat Options Cardiovasc Med. 2016;18:31.
12. Wang C, Zhai Z, Yang Y, et al. Efficacité et sécurité de l’activateur tissulaire recombinant du plasminogène à faible dose pour le traitement de la thromboembolie pulmonaire aiguë : un essai randomisé, multicentrique et contrôlé. Chest. 2010;137:254-62.
13. Sharifi M, Vajo Z, Freeman W, Bay C, Sharifi M, Schwartz F. Transformer et simplifier le traitement de l’embolie pulmonaire : thrombolyse à « dose sûre » plus nouveaux anticoagulants oraux. Lung. 2015;193:369-74.
14. Kabrhel C, Rosovsky R, Channick R, et al. Une équipe multidisciplinaire d’intervention en cas d’embolie pulmonaire : Initial 30-Month Experience With a Novel Approach to Delivery of Care to Patients With Submassive and Massive Pulmonary Embolism. Chest. 2016;150:384-93.
15. Lessne ML, Sing RF. Contrepoint : Les avantages l’emportent-ils sur les risques pour la plupart des patients envisagés pour les filtres de la veine cave inférieure ? Non. Chest. 2016 ; 150(6):1182-4.
16. Le groupe d’étude PREPIC. Suivi à huit ans des patients ayant reçu des filtres permanents de la veine cave dans la prévention de l’embolie pulmonaire : l’étude randomisée PREPIC (Prevention du Risque d’Embolie Pulmonaire par Interruption Cave). Circulation. 2005;112(3):416-22.
17. Mismetti P, Laporte S, Pellerin O, et al. Effect of a retrievable inferior vena cava filter plus anticoagulation vs anticoagulation alone on risk of recurrent pulmonary embolism : a randomized clinical trial. JAMA. 2015. 313(16):1627-35.
18. Deshpande KS, Hatem C, Karwa M, et al. L’utilisation du filtre de la veine cave inférieure comme modalité de traitement de l’embolie pulmonaire massive. A case series and review of pathophysiology. Respir Med. 2002.96(12):984-9.
19. Kucher N, Rossi E, De Rosa M, et al. Massive Pulmonary embolism. Circulation. 2006;113(4):577-82.
20. Stein P, Matta F. Taux de létalité avec l’embolectomie pulmonaire pour l’embolie pulmonaire aiguë. Am J Med. 2012;125:471-7.