Az eset
Egy 49 éves, kórosan elhízott nő légszomjjal és hasi puffadással jelentkezett a sürgősségi osztályon. A megjelenéskor a vérnyomása 100/60 mm Hg volt, a szívfrekvencia 110, a légzésszám 24, a pulzoximetriás szaturáció (SpO2) 86% volt szobai levegőn. A troponin T értéke 0,3 ng/ml volt. A mellkas komputertomográfiája (CT) intravénás kontrasztanyaggal nyerges tüdőembóliát (PE) mutatott, kitágult jobb kamra (RV) mellett. A hasi/medencei CT nagyon nagy méhtestet mutatott ki diffúz nyirokcsomó-érzéssel.
A heparin infúziót azonnal megkezdték. Az echokardiogram RV-törzset mutatott. Az alsó végtagok duplex ultrahangvizsgálata akut mélyvénás trombózist (DVT) állapított meg, amely a bal közös combvénát és a jobb poplitealis vénát érintette. Egy supraclavicularis nyirokcsomó biopsziája magas fokú differenciálatlan karcinómát mutatott ki, amely valószínűleg méh eredetű.
Klinikai kérdések
Milyen terápiás lehetőségeket kell fontolóra venni a szokásos szisztémás antikoaguláción túl? Van-e szerepe:
1. Szisztémás trombolízis?
2. Katéteres trombolízis (CDT)?
3. Inferior vena cava (IVC) szűrő behelyezése?
Mi a “szubmasszív” PE megfelelő kezelése?
Masszív PE esetén, amikor a trombus a központi tüdőérben helyezkedik el, és a csökkent szívteljesítmény miatt hipotenzióval jár, a szisztémás trombolízis, az embolektómia és a CDT potenciálisan életmentő intézkedésként javallott. A bizonyítékok azonban kevésbé egyértelműek, ha a PE nagyméretű, és RV-terheléshez vezetett, de nyílt hemodinamikai instabilitás nélkül. Ezt általában köztes kockázatú vagy “szubmasszív” PE-nek nevezik. A szubmasszív PE az American Heart Association (AHA) irányelvei alapján:1
Az akut PE szisztémás hipotenzió nélkül (90 mm Hg alatti szisztolés vérnyomás), de RV diszfunkcióval vagy szívizomelhalással jár. A RV-diszfunkciót az alábbiak közül legalább az egyik jelenléte határozza meg:
– RV-tágulat (apikális 4 kamrai RV-átmérő osztva az LV-átmérővel nagyobb, mint 0.9) vagy RV szisztolés diszfunkció az echokardiográfián;
– RV tágulat a CT-n, BNP emelkedés (több mint 90 pg/ml), N-terminális pro-BNP emelkedés (több mint 500 pg/ml);
– Elektrokardiográfiás változások (új teljes vagy nem teljes jobb ági blokk, anteroseptalis ST emelkedés vagy depresszió, vagy anteroseptalis T-hullám inverzió).
A miokardiális nekrózis emelkedett troponin I (0,4 ng/ml-nél nagyobb) vagy emelkedett troponin T (0,1 ng/ml-nél nagyobb) értékkel definiált.
Miért van klinikai jelentősége a szubmasszív PE-nek?
1999-ben az International Cooperative Pulmonary Embolism Registry (ICOPER) elemzése kimutatta, hogy a PE-ben szenvedő betegek RV-diszfunkciója a 3 hónapos halálozási kockázat közel kétszeresével jár együtt (hazard ratio 2,0, 1,3-2,9).2 Tekintettel erre a fokozott kockázatra, levonható a logikus következtetés, hogy a szubmasszív PE-t agresszívebben kell kezelni, mint a RV-törzset nem mutató PE-t. De vajon ez szükségszerűen jobb kimenetelt eredményez-e a beteg számára, tekintve a trombolítikus terápiához társuló koponyaűri vérzés 3%-os kockázatát?
A fenti klinikai forgatókönyvben a beteg megfelelt a szubmasszív PE definíciójának. Bár a beteg nem tapasztalt szisztémás hipotenziót, a CT-n RV-tágulatot, az ultrahangon RV-szisztolés diszfunkciót, valamint emelkedett Troponin T-szintet mutatott. Az antikoaguláns terápia megkezdésén kívül mit kellene még tenni a jó kimenetel valószínűségének növelése érdekében?
Az AHA azt javasolja, hogy akut szubmasszív PE-ben szenvedő betegeknél fontolják meg a szisztémás trombolízist és a CDT-t, ha klinikai bizonyíték van a kedvezőtlen prognózisra, beleértve a súlyosbodó légzési elégtelenséget, súlyos RV-diszfunkciót vagy jelentős szívizomelhalást, valamint a vérzéses szövődmények alacsony kockázatát (IIB osztály; C bizonyossági szint).1
A 2016-ban frissített Amerikai Mellkasi Orvosok Kollégiumának (CHEST) iránymutatása3 a szisztémásan alkalmazott trombolítikus terápiát ajánlja a terápia mellőzésével szemben olyan kiválasztott, akut PE-ben szenvedő betegek esetében, akiknél az antikoaguláns kezelés megkezdése után romlik a helyzet, de még nem alakult ki hipotenzió, és akiknél alacsony a vérzésveszély (2C fokozatú ajánlás).
Szisztémás trombolízis
A szisztémás trombolízist intravénás trombolytikus infúzió formájában adják, amelyet egy bizonyos időn keresztül adnak be. A Food and Drug Administration által engedélyezett trombolytikus gyógyszerek közé jelenleg a szöveti plazminogénaktivator (tPA)/altepláz, a sztreptokináz és az urokináz tartozik.
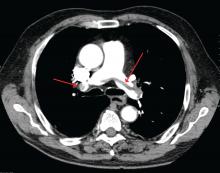 James Heilman, MD (Creative Commons licenc alapján használt)
James Heilman, MD (Creative Commons licenc alapján használt)
Nagy tüdőembólia a tüdőartéria bifurkációjánál (nyeregembólia).
A 2002-es randomizált, kettős vak Pulmonáris embólia-3 vizsgálatban4 Konstantinides és munkatársai 256 szubmasszív PE-ben szenvedő betegnél hasonlították össze a heparin plusz tPA-t a heparin plusz placebóval. Az elsődleges klinikai végpont, a halál vagy a kórházi ellátás fokozódása 11,0% volt a tPA-csoportban, szemben a placebocsoport 24,6%-ával (P = .006); a különbséget nagyrészt az ellátás fokozódása okozta, amelyet vazopresszorok, mentő trombolízis, gépi lélegeztetés, szívmegállás és sebészeti embolektómia igénybevételeként definiáltak. Talán meglepő módon egyik csoportban sem fordult elő vérzéses stroke. A vizsgálat kimutatta, hogy a szubmasszív PE-ben a szisztémás trombolízis a halálozás és a kezelés eszkalációjának alacsonyabb kockázatával járt együtt.
A kis dózisú trombolízis hatékonyságát a MOPETT 2013-ban5 vizsgálták, egy egyközpontú, prospektív, randomizált, nyílt címkés vizsgálatban, amelyben 126 résztvevő, akiknél a tünetek és a CT-angiográfiás vagy a lélegeztető/perfúziós vizsgálat adatai alapján szubmasszív PE-t állapítottak meg, vagy 50 mg tPA-t és heparint, vagy csak heparin antikoagulációt kapott. A pulmonális hipertónia és az ismétlődő PE összetett végpontja 28 hónap után a tPA-csoportban 16% volt, míg a kontrollcsoportban 63% (P kevesebb mint 0,001). A szisztémás trombolízis a pulmonális hipertónia és a kiújuló PE alacsonyabb kockázatával járt együtt, bár ebben a kis vizsgálatban nem mutatkozott előny a mortalitás szempontjából.
A 2014-es randomizált, kettős vak PEITHO vizsgálatban (n = 1006),6 amelyben a tenectepláz plusz heparin és a heparin összehasonlítása történt a szubmasszív PE-ben szenvedő betegeknél, a halál és a hemodinamikai dekompenzáció elsődleges kimenetele a tenectepláz csoport 2,6%-ában fordult elő, szemben a placebocsoport 5,6%-ával (P = .02). A trombolítikus terápia a vérzéses stroke 2%-os arányával járt együtt, míg a placebocsoportban a vérzéses stroke aránya 0,2% volt (P = .03). Ebben az esetben a szisztémás trombolízis a halál és a hemodinamikai instabilitás 3%-kal alacsonyabb kockázatával, de a vérzéses stroke 1,8%-kal megnövekedett kockázatával is társult.
Katéteres irányított trombolízis (CDT)
A CDT-t eredetileg artériás, dialízisgraft- és mélyvénás trombózisok kezelésére fejlesztették ki, de ma már az FDA az akut szubmasszív vagy masszív PE kezelésére is engedélyezte.
Az emboluson keresztül egy drótot vezetnek, és egy többlyukú infúziós katétert helyeznek el, amelyen keresztül 12-24 órán keresztül trombolytikus gyógyszert infundálnak. A gyógyszer közvetlen bejuttatását a trombusba úgy gondolják, hogy ugyanolyan hatékony, mint a szisztémás kezelés, de kisebb a vérzés kockázata. Ha a nagy rögterhelés és a hemodinamikai instabilitás miatt gyorsabb trombuseltávolítás indokolt, a CDT kiegészítéseként mechanikus terápiák, például a fragmentálás és az aspiráció is alkalmazható. Ezek a mechanikus technikák azonban a tüdőartéria sérülésének kockázatával járnak, ezért csak végső megoldásként alkalmazhatók. A trombolízis felgyorsítása érdekében a többlyukú infúziós katéterhez ultrahangot kibocsátó drótot lehet hozzáadni, amely a trombus ultrahanggal történő megbontásával gyorsítja a trombolízist, ez az ultrahanggal megerősített trombolízis (EKOS) néven ismert technika.7,10
Az ULTIMA 2014 vizsgálat,8 egy kis létszámú, randomizált, nyílt vizsgálat az ultrahanggal segített katéteres trombolízis (USAT, a kifejezés felcserélhető az EKOS-szal) és a csak heparin antikoaguláció összehasonlítására 59 betegnél, annak vizsgálatára irányult, hogy az előbbi stratégia jobban javítja-e az RV/LV arány elsődleges kimeneti mutatóját szubmasszív PE-s betegeknél. Az RV/LV arány átlagos csökkenése 0,30 +/- 0,20 volt az USAT csoportban, szemben a heparin csoport 0,03 +/- 0,16 értékével (P kevesebb mint 0,001). A 90 napos követés során azonban a csoportok között nem volt szignifikáns különbség a halálozásban vagy a vérzésben.
A PERFECT 2015 Trial,9 egy multicentrikus, regiszter alapú vizsgálat, prospektívan 101 beteget vett fel, akik masszív és szubmasszív PE első vonalbeli terápiájaként CDT-t kaptak. A szubmasszív PE-ben szenvedő betegek 97,3%-ánál találtak “klinikai sikert” ezzel a kezeléssel, amelyet a hemodinamika stabilizálódásaként, a pulmonális hipertónia és a jobb szívfél terhelésének javulásaként, valamint a kórházi elbocsátásig tartó túlélésként definiáltak. Nem volt súlyos vérzés vagy intrakraniális vérzés. Ebben a vizsgálatban az USAT-ot a standard CDT-vel összehasonlító alcsoportelemzések nem mutattak szignifikáns különbséget az átlagos pulmonális nyomásváltozás, az átlagos trombolítikus dózisok vagy az átlagos infúziós idő tekintetében.
Egy prospektív, egykarú, multicentrikus vizsgálat, a SEATTLE II 2015,10 159 betegből álló mintán értékelte az EKOS hatékonyságát. A masszív és szubmasszív PE-ben szenvedő betegek körülbelül 24 mg tPA-t kaptak katéteren keresztül infundálva 12-24 órán keresztül. Az elsődleges hatékonysági eredmény a mellkas CT-vel mért RV/LV arány csökkenése volt a kiindulási értékhez képest az eljárást követő 48 órához képest. Az eljárás előtti és utáni arány 1,55, illetve 1,13 volt (P kevesebb, mint 0,001), ami azt jelzi, hogy az EKOS csökkentette az RV-tágulást. Nem észleltek intrakraniális vérzést, és a vizsgálók nem nyilatkoztak a hosszú távú eredményekről, például a halálozásról vagy az életminőségről. A vizsgálatot korlátozta, hogy nem volt összehasonlító csoport, például heparinnal történő antikoaguláció monoterápiaként, vagy szisztémás trombolízis, illetve standard CDT.
A szubmasszív PE kezelése intézményenként eltérő. Egyszerűen nincsenek megfelelő adatok az alacsony dózisú szisztémás trombolízis, a CDT, az EKOS és a standard heparin antikoaguláció összehasonlítására ahhoz, hogy határozott ajánlásokat lehessen tenni. Egyes kutatók úgy vélik, hogy az alacsony dózisú szisztémás trombolízis valószínűleg ugyanolyan jó, mint a drága katéteres trombolytikus terápiák.11,12 Az alacsony dózisú trombolytikus terápiát szájon át szedhető direkt Xa-faktor gátlók alkalmazása követheti az antitrombotikus aktivitás fenntartása érdekében.13
Végeredmény
Intézményünkben az intervenciós radiológiai csoport eseti alapon szűri a szubmasszív PE kritériumainak megfelelő betegeket. A pulmonális angiográfiás adatok (a trombus jellege és kiterjedése), a klinikai stabilitás és az egyéb társbetegségek elemzése alapján döntünk az egyes betegek számára legjobb kezelési módról. Csapatunk előnyben részesíti az EKOS-t a szubmasszív PE-s betegeknél, valamint a masszív PE-s betegeknél és mentőeljárásként a szisztémás trombolízist sikertelenül alkalmazó betegeknél.
Amíg nem áll rendelkezésre több adat a határozott irányelvek alátámasztására, úgy érezzük, hogy a beavatkozó radiológusokból, intenzív orvosokból, kardiológusokból és érsebészekből álló multidiszciplináris csoportok létrehozása bölcs dolog az egyéni döntések meghozatalához és a betegek számára a legjobb eredmények eléréséhez.14.
IVC-szűrő
Mivel a betegnek ebben az esetben már van szubmasszív PE-je, elviselheti-e a további rögterhelést, ha a megmaradt DVT-je ismét embolizálódik? Van-e szerepe az IVC-szűrőnek?
Az IVC-szűrők beültetése jelentősen megnőtt az elmúlt 30 évben, anélkül, hogy minőségi bizonyítékok igazolnák alkalmazásukat.15
A 2016-os Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report egyértelműen kimondja: A láb akut DVT-jében vagy PE-ben szenvedő, antikoagulánsokkal kezelt betegeknél az IVC-szűrő alkalmazása nem javasolt (1B fokozat).3 Ez az ajánlás a Prevention du Risque d’Embolie Pulmonaire par Interruption Cave (PREPIC) randomizált vizsgálat16 és a nemrégiben közzétett PREPIC 2 randomizált vizsgálat17 eredményein alapul, amelyek mindkettő azt mutatja, hogy az antikoagulált PE-ben és DVT-ben szenvedő betegeknél az IVC-szűrő 3 hónapra történő egyidejű elhelyezése nem csökkentette az ismétlődő PE-t, beleértve a halálos kimenetelű PE-t.
A CHEST irányelvek szerint az IVC-szűrőt nem szabad rutinszerűen, kiegészítésként elhelyezni PE-ben és DVT-ben szenvedő betegeknél. Mi a helyzet azonban a szubmasszív vagy masszív PE-ben szenvedő betegek azon alcsoportjában, akiknél egy újabb PE katasztrofális lenne? Ezen a területen hiányoznak a klinikai adatok.
Deshpande és munkatársai hat masszív PE-ben és kardiopulmonális instabilitásban szenvedő betegről számoltak be; a betegek mindegyike IVC-szűrőt kapott antikoaguláció mellett. A rövid távú kimenetel kiváló volt, de hosszú távú követést nem végeztek.18 Kucher és munkatársai arról számoltak be, hogy a 2006-os ICOPER-ből 108 masszív PE-s beteg közül, akiknél a szisztolés artériás nyomás 90 mm Hg alatt volt, 11 beteg kapott kiegészítő IVC-szűrő behelyezést. E 11 beteg közül egynél sem alakult ki 90 napon belül kiújuló PE, és közülük 10 beteg legalább 90 napot túlélt; az IVC-szűrő behelyezése a 90 napos mortalitás csökkenésével járt együtt. Ebben a vizsgálatban az IVC-szűrő beültetéséről teljes mértékben a különböző helyszíneken dolgozó orvosok döntöttek.19 Egy 2012-es vizsgálatban, amely a halálozási arányt vizsgálta 3770 akut PE-ben szenvedő, tüdőembolektómiában részesülő betegnél, az adatok azt mutatták, hogy mind az instabil, mind a stabil betegeknél alacsonyabb volt a halálozási arány azoknál, akik IVC-szűrőt kaptak.20
Noha a fenti adatok kedvezőek a masszív PE-ben szenvedő betegeknél a kiegészítő IVC-szűrő beültetésével kapcsolatban, legalábbis a rövid távú eredmények tekintetében, a kis méret és a randomizáció hiánya kizárja a bizonyítékokon alapuló irányelvek kidolgozását. A 2016-os CHEST-irányelvek rámutatnak, hogy mivel bizonytalan, hogy a súlyos PE-ben szenvedő, antikoagulált betegeknél előnyös-e az IVC-szűrő kiegészítő behelyezése, a betegek ezen speciális alcsoportjában nem feltétlenül érvényes az IVC-szűrő behelyezése elleni ajánlás az akut PE-ben szenvedő, antikoagulált betegeknél3.
Legvégső sor
Nincs bizonyítékokon alapuló irányelv arra vonatkozóan, hogy az IVC-szűrőt kiegészítő jelleggel be kell-e helyezni szubmasszív vagy masszív PE-ben szenvedő betegeknél; a szakértői konszenzus alapján azonban a súlyos PE-ben szenvedő betegeknél az IVC-szűrő beültetése az antikoaguláció kiegészítéseként indokolt lehet. A döntést egyénre szabottan, az egyes betegek jellemzői, preferenciái és az intézményi szakértelem alapján kell meghozni.
Esetünkben a további embóliaterhelés megelőzésének reményében a beteg a megjelenést követő napon IVC-szűrőt kapott. A heparinnal történő antikoaguláció megkezdése ellenére tachycard és tachypneás maradt, ami CDT-re való beutalásra késztette. Az intervenciós radiológiai csapat nem érezte úgy, hogy a nő jó jelölt lenne, tekintettel a tartós hüvelyi vérzésre és a széles körben metasztatikus méhkarcinómára. Terápiás enoxaparinra állították át, miután további invazív beavatkozást nem tartottak indokoltnak. Légzési állapota nem javult, és kétfokozatú pozitív légúti nyomást kezdtek alkalmazni. Figyelembe véve rákjának terminális jellegét, végül a kényelmi ellátást választotta, és nem sokkal később meghalt.
Köszönet
A szerzők köszönetet mondanak Benjamin A. Hohmuth, MD, A. Joseph Layon, MD és Luis L. Nadal, MD, a cikk átnézéséért és felbecsülhetetlen értékű visszajelzéseikért.
Dr. Wenqian Wang, Dr. Vedamurthy és Dr. Wang a The Medicine Institute, Geisinger Health System, Danville, Penn. Dr. Wenqian Wang elérhetősége: .
Főbb pontok
– A pulmonális angiográfiás adatok, a klinikai stabilitás és az egyéb társbetegségek elemzése alapján döntse el a legjobb kezelési módot.
– Csapatunk az ultrahanggal megerősített trombolízist (EKOS) részesíti előnyben szubmasszív PE betegeknél, masszív PE betegeknél és mentőeljárásként a szisztémás trombolízist nem alkalmazó betegeknél.
– Intervenciós radiológusokból, intenzív orvosokból, kardiológusokból és érsebészekből álló multidiszciplináris csapatok létrehozása bölcs dolog az egyénre szabott döntések meghozatalához.
– Súlyos PE-ben szenvedő betegeknél az antikoaguláció kiegészítéseként célszerű lehet IVC-szűrő behelyezése.
1. Jaff MR, McMurtry MS, Archer SL, et al. Management of massive and submassive pulmonary embolism, iliofemoralis deep vein thrombosis, and chronic thromboembolic pulmonary hypertension: a scientific statement from the American Heart Association. Circulation. 2011;123:1788-1830.
2. Goldhaber SZ, Visani L, De Rosa M. Acute pulmonary embolism: clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER). Lancet. 1999;353:1386-9.
3. Kearon C, Akl EA, Ornelas J, et al. Antithrombotic Therapy for VTE Disease: CHEST irányelv és a szakértői testület jelentése. Chest. 2016;149:315-52.
4. Konstantinides S, Geibel A, Heusel G, Heinrich F, Kasper W. Management Strategies and Prognosis of Pulmonary Embolism-3 Trial Investigators. Heparin plusz altepláz összehasonlítva a csak heparinnal szubmasszív tüdőembóliás betegeknél. N Engl J Med. 2002;347:1143-50.
5. Sharifi M, Bay C, Skrocki L, Rahimi F, Mehdipour M, “MOPETT” Investigators. Trombolízissel kezelt mérsékelt tüdőembólia (a “MOPETT” vizsgálatból). Am J Cardiol. 2013;111:273-7.
6. Meyer G, Vicaut E, Danays T, et al. Fibrinolysis for patients with intermediate-risk pulmonary embolism. N Engl J Med. 2014;370:1402-11.
7. Kuo WT. Az akut tüdőembólia endovaszkuláris terápiája. J Vasc Interv Radiol 2012;23:167-79. e164
8. Kucher N, Boekstegers P, Muller OJ, et al. Randomized, controlled trial of ultrasound-assisted catheter-directed thrombolysis for acute intermediate-risk pulmonary embolism. Circulation. 2014;129:479-86.
9. Kuo WT, Banerjee A, Kim PS, et al. Pulmonary Embolism Response to Fragmentation, Embolectomy, and Catheter Thrombolysis (PERFECT): Initial Results From a Prospective Multicenter Registry. Chest. 2015;148:667-73.
10. Piazza G, Hohlfelder B, Jaff MR, et al. A Prospective, Single-Arm, Multicenter Trial of Ultrasound-Facilitated, Catheter-Directed, Low-Dose Fibrinolysis for Acute Massive and Submassive Pulmonary Embolism: A SEATTLE II tanulmány. JACC Cardiovasc Interv. 2015;8:1382-92.
11. Sharifi M. Szisztémás teljes dózisú, fél dózisú és katéteres irányítású trombolízis tüdőemboliára. Mikor használjuk és hogyan válasszuk? Curr Treat Options Cardiovasc Med. 2016;18:31.
12. Wang C, Zhai Z, Yang Y, et al. Az alacsony dózisú rekombináns szöveti típusú plazminogénaktivátor hatékonysága és biztonságossága az akut pulmonális tromboembólia kezelésében: randomizált, multicentrikus, kontrollált vizsgálat. Chest. 2010;137:254-62.
13. Sharifi M, Vajo Z, Freeman W, Bay C, Sharifi M, Schwartz F. A tüdőembólia kezelésének átalakítása és egyszerűsítése: “biztonságos dózisú” trombolízis és új orális antikoagulánsok. Lung. 2015;193:369-74.
14. Kabrhel C, Rosovsky R, Channick R, et al. A Multidisciplinary Pulmonary Embolism Response Team: Initial 30-month Experience With a Novel Approach to Delivery of Care to Patients With Submassive and Massive Pulmonary Embolism. Chest. 2016;150:384-93.
15. Lessne ML, Sing RF. Ellenpont: Vajon a vena cava inferior szűrő alkalmazását fontolgató legtöbb beteg esetében az előnyök meghaladják a kockázatokat? No. Chest. 2016; 150(6):1182-4.
16. A PREPIC tanulmánycsoport. A tüdőembólia megelőzésére tartós vena cava szűrővel ellátott betegek nyolcéves követése: a PREPIC (Prevention du Risque d’Embolie Pulmonaire par Interruption Cave) randomizált tanulmány. Circulation. 2005;112(3):416-22.
17. Mismetti P, Laporte S, Pellerin O, et al. Retrievable inferior vena cava filter plus antikoaguláció vs. csak antikoaguláció hatása a visszatérő tüdőembólia kockázatára: randomizált klinikai vizsgálat. JAMA. 2015. 313(16):1627-35.
18. Deshpande KS, Hatem C, Karwa M, et al. A vena cava inferior szűrő alkalmazása a masszív tüdőembólia kezelési módjaként. Esetsorozat és a patofiziológia áttekintése. Respir Med. 2002.96(12):984-9.
19. Kucher N, Rossi E, De Rosa M, et al. Massive Pulmonary embolism. Circulation. 2006;113(4):577-82.
20. Stein P, Matta F. Case Fatality Rate with Pulmonary Embolectomy for Acute Pulmonary Embolism. Am J Med. 2012;125:471-7.