Tapaus
49-vuotias sairaalloisen lihava nainen tuli päivystyspoliklinikalle hengenahdistuksen ja vatsan turvotuksen vuoksi. Esittelyhetkellä hänen verenpaineensa oli 100/60 mmHg, sykkeen ollessa 110, hengitystaajuuden ollessa 24 ja pulssioksimetrisen saturaation (SpO2) ollessa 86 % huoneilmassa. Troponiini T oli koholla 0,3 ng/ml. Rintakehän tietokonetomografia (TT) suonensisäisellä kontrastiaineella osoitti satulaisen keuhkoembolian (PE) ja laajentuneen oikean kammion (RV). Vatsan ja lantion tietokonetomografiassa havaittiin erittäin suuri kohdun massa, johon liittyi diffuusi lymfadenopatia.
Hepariini-infuusio aloitettiin välittömästi. Sydämen kaikukuvaus osoitti RV:n rasituksen. Alaraajojen duplex-ultraäänitutkimuksessa todettiin akuutti syvä laskimotromboosi, johon osallistuivat vasen reisilaskimo ja oikea polvilumpion laskimo. Supraklavikulaarisen imusolmukkeen biopsia osoitti korkea-asteista erilaistumatonta karsinoomaa, joka oli todennäköisesti peräisin kohdusta.
Kliiniset kysymykset
Mitä hoitovaihtoehtoja olisi harkittava tavanomaisen systeemisen antikoagulaation lisäksi, jos sellaisia on? Onko merkitystä:
1. Systeeminen trombolyysi?
2. Katetriohjattu trombolyysi (CDT)?
3. Inferior vena cava (IVC) -suodattimen asettaminen?
Mikä on asianmukainen hoito ”submassiivisessa” PE:ssä?
Massiivisessa PE:ssä, jossa trombi sijaitsee keskeisessä keuhkoverisuonistossa ja johon liittyy sydämen heikentyneestä tehosta johtuva hypotensio, systeeminen trombolyysi, embolektomia ja CDT ovat indikoituja mahdollisesti hengenpelastavia toimenpiteitä. Näyttö ei kuitenkaan ole yhtä selkeää silloin, kun keuhkoveritulppa on suuri ja on johtanut keuhkoverisuonten rasitukseen, mutta ilman avointa hemodynaamista epävakautta. Tätä kutsutaan yleisesti keskiriskiseksi tai ”submassiviseksi” keuhkoahtaumataudiksi. American Heart Associationin (AHA) ohjeisiin perustuva submassiivinen keuhkoahtaumatauti on:1
Akuutti keuhkoahtaumatauti ilman systeemistä hypotensiota (systolinen verenpaine alle 90 mmHg), mutta jossa on joko RV:n toimintahäiriö tai sydänlihaksen nekroosi. RV:n toimintahäiriö määritellään siten, että esiintyy vähintään yksi seuraavista:
– RV:n laajentuma (RV:n apikaalinen 4-kammion läpimitta jaettuna LV:n läpimitalla suurempi kuin 0.9) tai RV:n systolinen toimintahäiriö kaikukardiografiassa;
– RV:n laajentuma CT:ssä, BNP:n kohoaminen (yli 90 pg/ml), N-terminaalisen pro-BNP:n kohoaminen (yli 500 pg/ml);
– EKG-muutokset (uusi täydellinen tai epätäydellinen oikean haaraksen blokki, ST-arvon kohoaminen tai madaltuminen tai T- aallon inversio anteroseptal).
Myokardiaalinen nekroosi määritellään kohonneena troponiini I:nä (yli 0,4 ng/ml) tai kohonneena troponiini T:nä (yli 0,1 ng/ml).
Miksi submassiivinen PE on kliinisesti merkittävä?
Vuonna 1999 kansainvälisen yhteistyöhön perustuvan keuhkoemboliarekisterin (ICOPER) analyysi osoitti, että keuhkoahtaumatautipotilaiden RV:n toimintahäiriö liittyi 3 kuukauden kuolleisuusriskin lähes kaksinkertaistumiseen (riskisuhde 2,0, 1,3-2,9).2 Ottaen huomioon tämän suurentuneen riskin voisi tehdä loogisen johtopäätöksen, että submassivista keuhkoahtaumatautia on hoidettava aggressiivisemmin kuin PE:tä, jossa ei ole keuhkoahtaumatautia. Mutta johtaako tämä välttämättä potilaan kannalta parempaan lopputulokseen, kun otetaan huomioon trombolyyttiseen hoitoon liittyvä 3 prosentin kallonsisäisen verenvuodon riski?
Yllä olevassa kliinisessä skenaariossa potilas täytti submassive PE:n määritelmän. Vaikka potilaalla ei ollut systeemistä hypotensiota, hänellä oli RV:n laajentuma CT:ssä, RV:n systolinen toimintahäiriö kaikukuvauksessa sekä kohonnut troponiini T -taso. Mitä muuta pitäisi tehdä antikoagulanttihoidon aloittamisen lisäksi hänen hyvän lopputuloksen todennäköisyyden lisäämiseksi?
AHA suosittelee, että systeemistä trombolyysiä ja CDT:tä harkitaan potilaille, joilla on akuutti submassivinen PE, jos heillä on kliinistä näyttöä epäsuotuisasta ennusteesta, mukaan lukien paheneva hengitysvajaus, vakava RV:n toimintahäiriö tai merkittävä sydänlihaksen nekroosi, ja jos heillä on vähäinen vuoto- ja verenvuotokomplikaatioiden vaara (luokka IIB; näyttötapauksen taso C).1
American College of Chest Physiciansin (CHEST) vuonna 2016 päivitetyissä ohjeissa3 suositellaan systeemisesti annosteltua trombolyysihoitoa sen sijaan, että hoitoa ei annettaisi valikoiduille akuuttia keuhkoahtaumatautia sairastaville potilaille, joiden tila huononee antikoagulanttihoidon aloittamisen jälkeen, mutta joille ei ole vielä kehittynyt hypotensiota ja joiden verenvuotoriski on vähäinen (suositusluokka 2C).
Systeeminen trombolyysi
Systeeminen trombolyysi annetaan laskimonsisäisenä trombolyysi-infuusiona, joka annetaan tietyn ajan kuluessa. Food and Drug Administrationin hyväksymiä trombolyyttisiä lääkkeitä ovat tällä hetkellä kudosplasminogeeniaktivaattori (tPA)/alteplaasi, streptokinaasi ja urokinaasi.
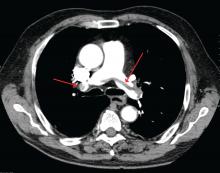 James Heilman, MD (käytetään Creative Commons -lisenssillä)
James Heilman, MD (käytetään Creative Commons -lisenssillä)
Kookas keuhkoembolia keuhkovaltimon haarautumiskohdassa (ns. satulaembolia).
Vuonna 2002 tehdyssä satunnaistetussa, kaksoissokkoutetussa Pulmonary Embolism-3 Trial -tutkimuksessa4 Konstantinides ja kollegat vertasivat hepariinia ja tPA:ta hepariiniin ja lumelääkkeeseen 256:lla potilaalla, joilla oli submassiivinen keuhkoembolia. Ensisijainen kliininen päätetapahtuma eli kuolema tai sairaalassa tapahtuva hoidon jatkaminen oli 11,0 prosenttia tPA-ryhmässä ja 24,6 prosenttia lumelääkeryhmässä (P = 0,006); ero johtui suurelta osin hoidon jatkamisesta, joka määriteltiin vasopressorien käytöksi, pelastavaksi trombolyysiksi, mekaaniseksi hengityskoneeksi, sydänpysähdykseksi ja kirurgisen embolektomian vaatimukseksi. Ehkä yllättäen kummassakaan ryhmässä ei ollut yhtään verenvuotohalvaustapausta. Tutkimus osoitti, että submassiivisen PE:n systeemiseen trombolyysiin liittyi pienempi kuoleman ja hoidon eskaloitumisen riski.
Matalan annoksen trombolyysin tehoa tutkittiin MOPETT 2013 -tutkimuksessa5 , joka oli yksikeskuksinen, prospektiivinen, satunnaistettu, avoin tutkimus, jossa 126 osallistujaa, joilla todettiin oireiden ja CT-angiografia- tai ventilaatio-/perfuusiokuvaustietojen perusteella olevan submassiivista PE:tä, saivat hoidettavakseen joko 50 mg:n tPA:ta ja hepariinia tai pelkkää hepariini-antikoagulaatiota. Keuhkoverenpainetaudin ja toistuvan keuhkoahtaumataudin yhdistetty päätetapahtuma 28 kuukauden kohdalla oli 16 %:lla tPA-ryhmässä ja 63 %:lla kontrolliryhmässä (P alle 0,001). Systeemiseen trombolyysiin liittyi pienempi keuhkoverenpainetaudin ja toistuvan keuhkoahtaumataudin riski, vaikka tässä pienessä tutkimuksessa ei havaittu hyötyä kuolleisuudesta.
Vuonna 2014 tehdyssä satunnaistetussa, kaksoissokkoutetussa PEITHO-tutkimuksessa (n = 1 006), jossa verrattiin tenekteplaasia ja hepariinia verrattuna hepariiniin submassiivisen PE:n potilailla, ensisijaiset päätetapahtumat kuolema ja hemodynaaminen dekompensaatio ilmenivät 2,6 %:lla tenekteplaasiryhmässä verrattuna 5,6 %:iin plaseboryhmässä (P = .02). Trombolyysihoitoon liittyi 2 % hemorraginen aivohalvaus, kun taas lumelääkeryhmässä hemorraginen aivohalvaus oli 0,2 % (P = .03). Tässä tapauksessa systeemiseen trombolyysiin liittyi 3 % pienempi kuoleman ja hemodynaamisen epävakauden riski, mutta myös 1,8 % suurempi hemorragisen aivohalvauksen riski.
Katetriohjattu trombolyysi (CDT)
CDT kehitettiin alun perin valtimo-, dialyysisiirrännäis- ja syvien laskimotromboosien hoitoon, mutta FDA on nyt hyväksynyt sen akuutin submassiivisen tai massiivisen keuhkoveritulpan hoitoon.
Lanka ohjataan emboluksen läpi ja siihen asetetaan monireikäinen infuusiokatetri, jonka kautta trombolyyttistä lääkeaine infusoidaan 12-24 tunnin ajan. Lääkkeen suoran annostelun trombiin uskotaan olevan yhtä tehokasta kuin systeeminen hoito, mutta verenvuotoriski on pienempi. Jos trombin nopeampi poisto on tarpeen suuren hyytymätaakan ja hemodynaamisen epävakauden vuoksi, CDT:n lisänä voidaan käyttää mekaanisia hoitomenetelmiä, kuten fragmentointia ja aspiraatiota. Näihin mekaanisiin tekniikoihin liittyy kuitenkin keuhkovaltimon vaurioitumisen riski, ja siksi niitä olisi käytettävä vasta viimeisenä keinona. Monireikäiseen infuusiokatetriin voidaan lisätä ultraääntä säteilevä lanka trombolyysin nopeuttamiseksi hajottamalla trombi ultraäänellä, mikä tunnetaan nimellä ultraäänellä tehostettu trombolyysi (EKOS).7,10
ULTIMA 2014 -tutkimuksessa8 , joka oli pieni, satunnaistettu, avoin tutkimus ultraääniavusteisesta katetriohjatusta trombolyysistä (USAT, termiä voidaan käyttää vaihdellen EKOS:n kanssa) verrattuna pelkkään hepariini-antikoagulaatioon 59 potilaalla, tutkittiin, parantaisiko edellinen strategia paremmin primaarista lopputulosmittausta eli RV/LV-suhdetta submassiivisessa PE:ssä. RV/LV-suhteen keskimääräinen pieneneminen oli 0,30 +/- 0,20 USAT-ryhmässä verrattuna 0,03 +/- 0,16 hepariiniryhmässä (P alle 0,001). Ryhmissä ei kuitenkaan havaittu merkittävää eroa kuolleisuudessa tai verenvuodossa 90 päivän seurannassa.
PERFECT 2015 Trial,9 monikeskuksinen rekisteripohjainen tutkimus, johon osallistui prospektiivisesti 101 potilasta, jotka saivat CDT:tä massiivisen ja submassiivisen PE:n ensilinjan hoitona. Submassiivista keuhkoahtaumatautia sairastavista potilaista 97,3 %:lla todettiin tämän hoidon ”kliininen onnistuminen”, joka määriteltiin hemodynamiikan vakautumisena, keuhkoverenpainetaudin ja oikean sydämen rasituksen paranemisena sekä selviytymisenä sairaalasta kotiutumiseen asti. Suuria verenvuotoja tai kallonsisäisiä verenvuotoja ei esiintynyt. Tässä tutkimuksessa tehdyissä alaryhmäanalyyseissä, joissa verrattiin USAT:ia ja tavanomaista CDT:tä, ei havaittu merkittävää eroa keskimääräisissä keuhkovaltimopaineen muutoksissa, keskimääräisissä trombolyyttiannoksissa tai keskimääräisissä infuusioajoissa.
Prospektiivisessa yksihaaraisessa monikeskustutkimuksessa SEATTLE II 201510 arvioitiin EKOS:n tehoa 159 potilaan otoksessa. Potilaat, joilla oli sekä massiivinen että submassiivinen PE, saivat noin 24 mg tPA:ta infuusiona katetrin kautta 12-24 tunnin aikana. Ensisijainen tehokkuustulos oli rintakehän TT:llä mitattu RV/LV-suhteen pieneneminen lähtötilanteesta verrattuna 48 tuntia toimenpiteen jälkeen. Suhde ennen ja jälkeen toimenpiteen oli 1,55 ja 1,13 (P alle 0,001), mikä osoittaa, että EKOS vähensi RV:n laajentumista. Kallonsisäistä verenvuotoa ei havaittu, eivätkä tutkijat kommentoineet pitkän aikavälin tuloksia, kuten kuolleisuutta tai elämänlaatua. Tutkimusta rajoitti vertailuryhmän puuttuminen, kuten antikoagulaatio hepariinilla monoterapiana tai systeeminen trombolyysi tai tavanomainen CDT.
Submassiivisen PE:n hoito vaihtelee eri laitoksissa. Pieniannoksisen systeemisen trombolyysihoidon, CDT:n, EKOS:n ja tavanomaisen hepariiniantikoagulaation vertailemisesta ei yksinkertaisesti ole riittävästi tietoa, jotta voitaisiin antaa vankkoja suosituksia. Joidenkin tutkijoiden mielestä matala-annoksinen systeeminen trombolyysi on todennäköisesti yhtä hyvä kuin kalliit katetripohjaiset trombolyysihoidot.11,12 Matala-annoksisen trombolyysihoidon jälkeen voidaan käyttää suun kautta otettavia suoria tekijä Xa:n estäjiä antitromboottisen aktiivisuuden ylläpitämiseksi.13
Pohjimmainen linjaus
Meidän laitoksessamme toimenpideradiologian tiimi seuloo potilasta, jotka täyttävät submassivoivan pneumabolian kriteerit, tapauskohtaisesti. Käytämme keuhkoangiografisia tietoja (trombin luonne ja laajuus), kliinistä vakautta ja muiden liitännäissairauksien analyysia päättäessämme yksittäisen potilaan parhaasta hoitomuodosta. Ryhmämme suosii EKOS-menetelmää submassiivisten keuhkoahtaumatautipotilaiden sekä massiivisten keuhkoahtaumatautipotilaiden kohdalla ja pelastusmenetelmänä potilaille, joiden systeeminen trombolyysi ei ole tuottanut tulosta.
Kunnes käytettävissä on enemmän tietoa vakaiden ohjeiden tueksi, katsomme, että toimenpideradiologeista, teho-osastolääkäreistä, sydänlääkäreistä ja verisuonikirurgeista koostuvien moniammatillisten työryhmien perustaminen on järkevää, jotta pystymme tekemään yksilöllisiä valintoja yksilöllisten päätösten tekemistä varten ja jotta voimme saada aikaan potilaidemme kannalta parhaan lopputuloksen.
IVC-suodatin
Koska tämän tapauksen potilaalla on jo submassive PE, voiko hän sietää ylimääräistä hyytymiskuormitusta, jos hänen jäljelle jäävä trombosyytti embolisoituu uudelleen? Onko IVC-suodattimella merkitystä?
IVC-suodattimien implantointi on lisääntynyt merkittävästi viimeisten 30 vuoden aikana ilman laadukasta näyttöä, joka oikeuttaisi niiden käytön.15
The 2016 Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report toteaa selvästi: Potilailla, joilla on akuutti jalan laskimotukos tai keuhkoahtaumatauti ja joita hoidetaan antikoagulanteilla, ei suositella IVC-suodattimen käyttöä (luokka 1B).3 Tämä suositus perustuu PREPIC-tutkimuksen (Prevention du Risque d’Embolie Pulmonaire par Interruption Cave) satunnaistetun tutkimuksen16 ja äskettäin julkaistun PREPIC 2 -satunnaistetun tutkimuksen17 tuloksiin, jotka molemmat osoittivat, että antikoagulaatiohoitoa saavilla potilailla, joilla oli keuhkoahtaumatauti (PE) ja laskimotukos (DVT), IVC-suodattimen samanaikainen asettaminen kolmeksi kuukaudeksi ei vähentänyt uusiutunutta PE:tä, mukaan luettuna kuolemaan johtava PE.
CHEST-ohjeiden mukaan IVC-suodatinta ei tulisi rutiininomaisesti asettaa lisänä potilaille, joilla on keuhkoahtaumatauti (PE) tai laskimotukos. Entä kuitenkin niiden potilaiden alaryhmässä, joilla on submassiivinen tai massiivinen keuhkoahtaumatauti ja joilla uusi keuhkoahtaumatauti olisi katastrofaalinen? Kliiniset tiedot tältä alueelta puuttuvat.
Deshpande ym. raportoivat kuuden potilaan sarjasta, joilla oli massiivinen keuhkoahtaumatauti ja kardiopulmonaalinen epävakaus; kaikille potilaille asennettiin IVC-suodatin antikoagulaation kanssa. Lyhyen aikavälin tulokset olivat erinomaiset, mutta pitkäaikaisseurantaa ei tehty.18 Kucher ja kollegat raportoivat, että vuoden 2006 ICOPER-tutkimuksesta 108 massiivisen keuhkoahtaumataudin potilaasta, joiden systolinen valtimopaine oli alle 90 mmHg, 11 potilasta sai liitännäisenä IVC-suodattimen asettamisen. Yhdellekään näistä 11 potilaasta ei kehittynyt uusiutunutta keuhkoahtaumatautia 90 päivän kuluessa, ja 10 heistä selvisi vähintään 90 päivää; IVC-suodattimen asettamiseen liittyi 90 päivän kuolleisuuden väheneminen. Tässä tutkimuksessa IVC-suodattimen asettamisesta päättivät täysin eri toimipisteiden lääkärit.19 Vuonna 2012 tehdyssä tutkimuksessa, jossa tarkasteltiin keuhkoembolektomian saaneiden 3 770 akuuttia keuhkoemboliaa sairastaneen potilaan kuolleisuuslukuja, kävi ilmi, että sekä epästabiileilla että vakaassa tilassa olevilla potilailla kuolleisuusluvut olivat alhaisemmat niillä potilailla, jotka saivat IVC-suodattimen20 .
Vaikka edellä mainitut tiedot ovat suotuisia IVC-suodattimen täydentävälle asettamiselle massiivista keuhkoembolia sairastaville PE-potilaille ainakin lyhyen aikavälin tulosten osalta, pieni koko ja satunnaistamisen puuttuminen estävät näyttöön perustuvien ohjeiden laatimisen. Vuoden 2016 CHEST-ohjeissa huomautetaan, että koska on epävarmaa, onko IVC-suodattimen täydentävästä asettamisesta hyötyä antikoaguloituneille potilaille, joilla on vaikea keuhkoahtaumatauti, tässä erityisessä potilaiden alaryhmässä suositusta IVC-suodattimen asettamisesta antikoaguloituneille akuuttia keuhkoahtaumatautia sairastaville potilaille ei ehkä sovelleta.3
Bottom line
Ei ole näyttöön perustuvaa ohjetta siitä, pitäisikö IVC-suodatin asettaa liitännäisesti potilailla, joilla on submassiivinen tai massiivinen keuhkoahtaumatauti; asiantuntijoiden yksimielisyyden perusteella voi kuitenkin olla tarkoituksenmukaista asettaa IVC-suodatin antikoagulaation lisänä potilailla, joilla on vaikea PE. Päätös olisi yksilöitävä kunkin potilaan ominaisuuksien, mieltymysten ja laitoksen asiantuntemuksen perusteella.
Tapauksessamme potilas sai IVC-suodattimen esittelyä seuraavana päivänä siinä toivossa, että estettäisiin lisäemboliakuormitus. Vaikka antikoagulaatio aloitettiin hepariinilla, hänellä pysyi takykardia ja takypnea, minkä vuoksi hänet ohjattiin CDT:hen. Toimenpideradiologian tiimi ei pitänyt häntä hyvänä ehdokkaana, koska hänellä oli jatkuvaa emätinverenvuotoa ja laajalti metastasoitunut kohdun karsinooma. Hän siirtyi terapeuttiseen enoksapariiniin sen jälkeen, kun invasiivista toimenpidettä ei enää pidetty aiheellisena. Hänen hengitystilansa ei parantunut, ja hänelle aloitettiin kaksiportainen positiivinen hengitystiepaineistus. Ottaen huomioon hänen syöpänsä terminaalisen luonteen hän valitsi lopulta mukavuushoidon ja kuoli pian sen jälkeen.
Kiitokset
Tekijät haluavat kiittää Benjamin A. Hohmuthia, MD, A. Joseph Layonia, MD, ja Luis L. Nadal, MD, artikkelin tarkistamisesta ja korvaamattomasta palautteesta.
Tohtori Wenqian Wang, tohtori Vedamurthy ja tohtori Wang työskentelevät The Medicine Instituten sairaalalääketieteen osastolla Geisinger Health Systemissä, Danvillessä, Pennissä. Ota yhteyttä tohtori Wenqian Wangiin osoitteessa .
Kärkikohdat
– Käytä keuhkoangiografiatietoja, kliinistä vakautta ja muiden liitännäissairauksien analyysia päättäessäsi parhaasta hoitomuodosta.
– Ryhmämme suosii ultraäänellä tehostettua trombolyysia (EKOS) submassivoiduissa keuhkoahtaumatautipotilailla, massiivisissa keuhkoahtaumatautipotilailla ja pelastusmenetelmänä potilailla, jotka eivät onnistu systeemisessä trombolyysissä.
– Toimenpideradiologeista, tehohoitolääkäreistä, kardiologeista ja verisuonikirurgeista koostuvien moniammatillisten tiimien perustaminen on järkevää yksilöllisten päätösten tekemiseksi.
– Voi olla tarkoituksenmukaista sijoittaa IVC-suodatin antikoagulaation lisänä potilailla, joilla on vakava keuhkoahtaumatauti.
1. Jaff MR, McMurtry MS, Archer SL, et al. Management of massive and submassive pulmonary embolism, iliofemoraalisen syvän laskimotromboosin ja kroonisen tromboembolisen keuhkoverenpainetaudin hoito: American Heart Associationin tieteellinen lausunto. Circulation. 2011;123:1788-1830.
2. Goldhaber SZ, Visani L, De Rosa M. Acute pulmonary embolism: clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER). Lancet. 1999;353:1386-9.
3. Kearon C, Akl EA, Ornelas J, et al. Antitromboottinen hoito VTE-taudissa: CHEST Guideline and Expert Panel Report. Chest. 2016;149:315-52.
4. Konstantinides S, Geibel A, Heusel G, Heinrich F, Kasper W. Management Strategies and Prognosis of Pulmonary Embolism-3 Trial Investigators. Hepariini plus alteplaasi verrattuna pelkkään hepariiniin potilailla, joilla on submassiivinen keuhkoembolia. N Engl J Med. 2002;347:1143-50.
5. Sharifi M, Bay C, Skrocki L, Rahimi F, Mehdipour M, ”MOPETT”-tutkijat. Keskivaikea keuhkoembolia trombolyysillä hoidettuna (MOPETT-tutkimuksesta). Am J Cardiol. 2013;111:273-7.
6. Meyer G, Vicaut E, Danays T, et al. Fibrinolysis for patients with intermediate-risk pulmonary embolism. N Engl J Med. 2014;370:1402-11.
7. Kuo WT. Akuutin keuhkoembolian endovaskulaarinen hoito. J Vasc Interv Radiol 2012;23:167-79. e164
8. Kucher N, Boekstegers P, Muller OJ, et al. Randomized, controlled trial of ultraääniavusteisen katetriohjatun trombolyysihoidon satunnaistettu, kontrolloitu kokeilu akuutissa keskiriskin keuhkoemboliassa. Circulation. 2014;129:479-86.
9. Kuo WT, Banerjee A, Kim PS, et al. Pulmonary Embolism Response to Fragmentation, Embolectomy, and Catheter Thrombolysis (PERFECT): Initial Results From a Prospective Multicenter Registry. Chest. 2015;148:667-73.
10. Piazza G, Hohlfelder B, Jaff MR, et al. A Prospective, Single-Arm, Multicenter Trial of Ultrasound-Facilitated, Catheter-Directed, Low-Dose Fibrinolysis for Acute Massive and Submassive Pulmonary Embolism: SEATTLE II -tutkimus. JACC Cardiovasc Interv. 2015;8:1382-92.
11. Sharifi M. Systemic Full Dose, Half Dose, and Catheter Directed Thrombolysis for Pulmonary Embolism. Milloin käyttää ja miten valita? Curr Treat Options Cardiovasc Med. 2016;18:31.
12. Wang C, Zhai Z, Yang Y, ym. matala-annoksisen rekombinantti kudostyypin plasminogeeniaktivaattorin teho ja turvallisuus akuutin keuhkotromboembolian hoidossa: satunnaistettu, monikeskuksinen, kontrolloitu tutkimus. Chest. 2010;137:254-62.
13. Sharifi M, Vajo Z, Freeman W, Bay C, Sharifi M, Schwartz F. Keuhkoembolian hoidon muuttaminen ja yksinkertaistaminen: ”turvallinen annos” trombolyysi ja uudet oraaliset antikoagulantit. Lung. 2015;193:369-74.
14. Kabrhel C, Rosovsky R, Channick R, et al. A Multidisciplinary Pulmonary Embolism Response Team: Initial 30-Month Experience With a Novel Approach to Delivery of Care to Patients With Submassive and Massive Pulmonary Embolism. Chest. 2016;150:384-93.
15. Lessne ML, Sing RF. Counterpoint: Do the Benefits Outweigh the Risks for Most Patients Under Consideration for inferior vena cava filters? No. Chest. 2016; 150(6):1182-4.
16. PREPIC-tutkimusryhmä. Kahdeksan vuoden seuranta potilaista, joille on asennettu pysyviä laskimonsuonisuodattimia keuhkoembolian ehkäisemiseksi: PREPIC (Prevention du Risque d’Embolie Pulmonaire par Interruption Cave) satunnaistettu tutkimus. Circulation. 2005;112(3):416-22.
17. Mismetti P, Laporte S, Pellerin O, et al. Effect of a retrievable inferior vena cava filter plus anticoagulation vs. anticoagulation alone on risk of recurrent pulmonary embolism: a randomized clinical trial. JAMA. 2015. 313(16):1627-35.
18. Deshpande KS, Hatem C, Karwa M, et al. Inferior vena cava -suodattimen käyttö massiivisen keuhkoembolian hoitomuotona. Tapaussarja ja katsaus patofysiologiaan. Respir Med. 2002.96(12):984-9.
19. Kucher N, Rossi E, De Rosa M, et al. Massiivinen keuhkoembolia. Circulation. 2006;113(4):577-82.
20. Stein P, Matta F. Case Fatality Rate with Pulmonary Embolectomy for Acute Pulmonary Embolism. Am J Med. 2012;125:471-7.