Fallet
En 49-årig morbidt överviktig kvinna kom till akutmottagningen med andnöd och bukspänning. Vid presentationen var hennes blodtryck 100/60 mm Hg med en hjärtfrekvens på 110, en andningsfrekvens på 24 och en pulsoximetrisk saturation (SpO2) på 86 % vid rumsluft. Troponin T var förhöjt till 0,3 ng/mL. Datortomografi (CT) av bröstkorgen med intravenös kontrast visade sadel lungemboli (PE) med dilaterad höger ventrikel (RV). CT abdomen/pelvis visade en mycket stor uterusmassa med diffus lymfadenopati.
Heparininfusion påbörjades omgående. Ekokardiogrammet visade på RV-distans. Fynd på duplex ultraljud av nedre extremiteterna överensstämde med akuta djupa ventromboser (DVT) som involverade den vänstra gemensamma femoralvenen och den högra poplitealavenen. Biopsi av en supraklavikulär lymfkörtel visade höggradigt odifferentierat karcinom troligen av uterint ursprung.
Kliniska frågor
Vilka, om några, terapeutiska alternativ bör övervägas utöver vanlig systemisk antikoagulation? Finns det en roll för:
1. Systemisk trombolys?
2. Kateterstyrd trombolys (CDT)?
3. Placering av IVC-filter?
Vad är lämplig behandling av ”submassiv” PE?
Vid massiv PE, där trombusen är belägen i de centrala lungkärlen och är förknippad med hypotoni på grund av nedsatt hjärtminutvolym, är systemisk trombolys, embolektomi och CDT indicerade som potentiellt livräddande åtgärder. Bevisen är dock mindre tydliga när PE är stor och har lett till RV-belastning, men utan uppenbar hemodynamisk instabilitet. Detta är allmänt känt som en intermediär risk eller ”submassiv” PE. Submassiv PE enligt American Heart Associations (AHA) riktlinjer är:1
En akut PE utan systemisk hypotension (systoliskt blodtryck mindre än 90 mm Hg) men med antingen RV-dysfunktion eller myokardisk nekros. RV-dysfunktion definieras genom förekomst av minst ett av följande:
– RV-dilatation (apikal 4-kammar-RV-diameter dividerad med LV-diameter större än 0.9) eller RV systolisk dysfunktion på ekokardiografi;
– RV-dilatation på CT, förhöjt BNP (mer än 90 pg/mL), förhöjt N-terminalt pro-BNP (mer än 500 pg/mL);
– Elektrokardiografiska förändringar (nytt komplett eller ofullständigt högra grenblock, anteroseptal ST-förhöjning eller -depression eller anteroseptal T-vågsinversion).
Myokardnekros definieras som förhöjt troponin I (mer än 0,4 ng/mL) eller förhöjt troponin T (mer än 0,1 ng/mL).
Varför är submassiv PE av klinisk betydelse?
In 1999 visade en analys av International Cooperative Pulmonary Embolism Registry (ICOPER) att RV-dysfunktion hos PE-patienter var förknippad med en nära nog fördubblad tremånadersmortalitetsrisk (hazardkvot 2,0, 1,3-2,9).2 Med tanke på denna ökade risk skulle man kunna dra den logiska slutsatsen att vi måste behandla submassiv PE mer aggressivt än PE utan RV-stämning. Men kommer detta nödvändigtvis att leda till ett bättre resultat för patienten med tanke på den 3-procentiga risken för intrakraniell blödning i samband med trombolysbehandling?
I det kliniska scenariot ovan uppfyllde patienten definitionen av submassiv PE. Även om patienten inte hade någon systemisk hypotension hade hon RV-dilatation på CT, RV-systolisk dysfunktion på eko samt en förhöjd Troponin T-nivå. Förutom att påbörja antikoagulantiabehandling, vad mer bör göras för att öka hennes sannolikhet för ett gott resultat?
AHA rekommenderar att systemisk trombolys och CDT övervägs för patienter med akut submassiv PE om de har kliniska tecken på ogynnsam prognos, inklusive förvärrad respiratorisk svikt, allvarlig RV-dysfunktion eller större myokardienekros och låg risk för blödningskomplikationer (Klass IIB; Evidensnivå C).1
I 2016 års uppdatering av riktlinjerna från American College of Chest Physicians (CHEST)3 rekommenderas systemiskt administrerad trombolysbehandling framför ingen behandling hos utvalda patienter med akut PE som försämras efter påbörjad antikoagulantiabehandling men som ännu inte har utvecklat hypotension och som har en låg blödningsrisk (Rekommendation av klass 2C).
Systemisk trombolys
Systemisk trombolys administreras som en intravenös trombolysinfusion som ges under en tidsperiod. De trombolysläkemedel som godkänts av Food and Drug Administration omfattar för närvarande vävnadsplasminogenaktivator (tPA)/alteplase, streptokinas och urokinas.
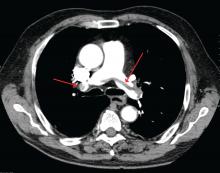 James Heilman, MD (används under Creative Commons-licens)
James Heilman, MD (används under Creative Commons-licens)
En stor lungembolism vid lungartärens bifurkation (sadelembolism).
I den randomiserade, dubbelblinda studien Pulmonary Embolism-3 Trial från 20024 jämförde Konstantinides och medarbetare heparin plus tPA med heparin plus placebo hos 256 patienter med submassiv PE. Den primära kliniska slutpunkten, dödsfall eller upptrappning av vård på sjukhus, var 11,0 % i tPA-gruppen jämfört med 24,6 % i placebogruppen (P = 0,006). Skillnaden berodde till stor del på upptrappning av vård, definierad som användning av vasopressorer, trombolys som räddningsinsats, mekanisk ventilation, hjärtstillestånd och krav på kirurgisk embolektomi. Kanske överraskande var att det inte förekom några fall av hemorragisk stroke i någon av dessa grupper. Studien visade att systemisk trombolys vid submassiv PE var förknippad med en lägre risk för dödsfall och upptrappning av behandlingen.
Effektiviteten av lågdostrombolys studerades i MOPETT 2013,5 en prospektiv, randomiserad, öppen studie med ett enda center, där 126 deltagare som befanns ha submassiv PE baserat på symtom och data från CT-angiografi eller ventilations- och perfusionsscanning fick antingen 50 mg tPA plus heparin eller enbart antikoagulation med heparin. Den sammansatta slutpunkten med pulmonell hypertension och återkommande PE efter 28 månader var 16 % i tPA-gruppen jämfört med 63 % i kontrollgruppen (P mindre än 0,001). Systemisk trombolys var förknippad med lägre risk för pulmonell hypertension och återkommande PE, även om ingen mortalitetsfördel sågs i denna lilla studie.
I den randomiserade, dubbelblinda PEITHO-studien (n = 1 006) från 20146 där tenecteplase plus heparin jämfördes med heparin i submassiva PE-patienter, inträffade de primära utfallen dödsfall och hemodynamisk dekompensation hos 2,6 % av tenecteplase-gruppen, jämfört med 5,6 % i placebogruppen (P = .02). Trombolytisk behandling var förknippad med 2 % frekvens av hemorragisk stroke, medan hemorragisk stroke i placebogruppen var 0,2 % (P = .03). I detta fall var systemisk trombolys förknippad med en 3 % lägre risk för dödsfall och hemodynamisk instabilitet, men också en 1,8 % ökad risk för hemorragisk stroke.
Kateterstyrd trombolys (CDT)
CDT utvecklades ursprungligen för att behandla tromboser i artärer, dialysgraft och djupa vener, men är nu godkänd av FDA för behandling av akut submassiv eller massiv PE.
En vajer förs genom embolen och en multihålsinfusionskateter placeras, genom vilken ett trombolyserande läkemedel infunderas under 12-24 timmar. Den direkta leveransen av läkemedlet i trombusen anses vara lika effektiv som systemisk behandling men med lägre blödningsrisk. Om en snabbare trombosborttagning är indicerad på grund av stor trombosbörda och hemodynamisk instabilitet kan mekaniska terapier, t.ex. fragmentering och aspiration, användas som ett komplement till CDT. Dessa mekaniska tekniker medför dock risk för skador på lungartären och bör därför endast användas som en sista utväg. En tråd som avger ultraljud kan läggas till i flerhålsinfusionskatetern för att påskynda trombolysen genom att trombusen splittras med ultraljud, en teknik som kallas ultraljudsförstärkt trombolys (EKOS).7,10
Studien ULTIMA 2014,8 en liten, randomiserad, öppen studie av ultraljudsassisterad kateterstyrd trombolys (USAT, termen kan användas omväxlande med EKOS) jämfört med enbart antikoagulation med heparin hos 59 patienter, utformades för att studera om den förstnämnda strategin var bättre på att förbättra det primära utfallsmåttet RV/LV-förhållandet hos patienter med submassiv PE. Den genomsnittliga minskningen av RV/LV-kvoten var 0,30 +/- 0,20 i USAT-gruppen jämfört med 0,03 +/- 0,16 i heparingruppen (P mindre än 0,001). Ingen signifikant skillnad i mortalitet eller blödning observerades dock i grupperna vid 90-dagars uppföljning.
The PERFECT 2015 Trial,9 en multicenter registerbaserad studie, rekryterade prospektivt 101 patienter som fick CDT som förstahandsbehandling för massiv och submassiv PE. Bland patienter med submassiv PE konstaterades 97,3 % ha ”klinisk framgång” med denna behandling, definierat som stabilisering av hemodynamik, förbättring av pulmonell hypertension och högerhjärtbelastning samt överlevnad till sjukhusutskrivning. Det förekom inga större blödningar eller intrakraniella blödningar. Subgruppsanalyser i denna studie som jämförde USAT med standard CDT visade ingen signifikant skillnad i genomsnittliga lungtrycksförändringar, genomsnittliga trombolysdoser eller genomsnittliga infusionstider.
En prospektiv enarmad multicenterstudie, SEATTLE II 2015,10 utvärderade effekten av EKOS i ett urval av 159 patienter. Patienter med både massiv och submassiv PE fick cirka 24 mg tPA infunderat via en kateter under 12-24 timmar. Det primära effektutfallet var den minskning av RV/LV-förhållandet som mättes med bröstcert CT från baslinjen jämfört med 48 timmar efter ingreppet. Förhållandet före och efter ingreppet var 1,55 jämfört med 1,13 (P mindre än 0,001), vilket tyder på att EKOS minskade RV-dilatationen. Ingen intrakraniell blödning observerades och utredarna kommenterade inte långtidsutfall som dödlighet eller livskvalitet. Studien begränsades av avsaknaden av en jämförelsegrupp, såsom antikoagulation med heparin som monoterapi eller systemisk trombolys eller standard CDT.
Behandlingen av submassiv PE varierar mellan olika institutioner. Det finns helt enkelt inte tillräckliga data som jämför lågdos systemisk trombolys, CDT, EKOS och standard antikoagulation med heparin för att kunna ge bestämda rekommendationer. Vissa utredare anser att lågdos systemisk trombolys förmodligen är lika bra som de dyra kateterbaserade trombolysbehandlingarna.11,12 Lågdos trombolysbehandling kan följas av användning av orala direkta faktor Xa-hämmare för upprätthållande av den antitrombotiska aktiviteten.13
Bottom line
I vår institution screenar det interventionella radiologiteamet patienter som uppfyller kriterierna för submassiv PE från fall till fall. Vi använder oss av lungangiografiska data (trombens art och utbredning), klinisk stabilitet och analys av andra komorbida tillstånd för att besluta om den bästa behandlingsmodaliteten för en enskild patient. Vårt team föredrar EKOS för submassiva PE-patienter såväl som för massiva PE-patienter och som en räddningsprocedur för patienter som har misslyckats med systemisk trombolys.
Intill dess att fler data finns tillgängliga för att stödja fasta riktlinjer anser vi att det är klokt att inrätta multidisciplinära team bestående av interventionsradiologer, intensivister, kardiologer och kärlkirurgiska kirurger för att kunna fatta individualiserade beslut och för att uppnå de bästa resultaten för våra patienter.14
IVC-filter
Med tanke på att patienten i det här fallet redan har en submassiv PE, kan hon tolerera ytterligare koagelbelastning om hennes kvarvarande DVT embolisera igen? Finns det en roll för IVC-filter?
Implantationen av IVC-filter har ökat markant under de senaste 30 åren, utan att det finns kvalitetsbevis som motiverar deras användning.15
The 2016 Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report” står det klart och tydligt: I patienter med akut DVT i benet eller PE som behandlas med antikoagulantia rekommenderas inte användning av ett IVC-filter (grad 1B).3 Denna rekommendation grundar sig på resultaten från den randomiserade studien Prevention du Risque d’Embolie Pulmonaire par Interruption Cave (PREPIC),16 och den nyligen publicerade randomiserade studien PREPIC 2,17 som båda visar att hos antikoagulerade patienter med PE och DVT minskade inte samtidig placering av ett IVC-filter i tre månader återkommande PE, inklusive dödlig PE.
CHEST-riktlinjerna anger att ett IVC-filter inte rutinmässigt bör placeras som ett komplement hos patienter med PE och DVT. Men hur är det i undergruppen av patienter med submassiv eller massiv PE där ytterligare en PE skulle vara katastrofal? Kliniska data saknas på detta område.
Deshpande et al. rapporterade om en serie på sex patienter med massiv PE och kardiopulmonell instabilitet; patienterna fick alla ett IVC-filter med antikoagulation. Resultatet på kort sikt var utmärkt, men långtidsuppföljning gjordes inte.18 Kucher och medarbetare rapporterade att från ICOPER 2006, av 108 massiva PE-patienter med systoliskt arteriellt tryck under 90 mm Hg, fick 11 patienter kompletterande IVC-filterplacering. Ingen av dessa 11 patienter utvecklade återkommande PE inom 90 dagar och 10 av dem överlevde minst 90 dagar; IVC-filterplacering var förknippad med en minskning av 90-dagarsdödligheten. I den här studien beslutades placeringen av ett IVC-filter helt och hållet av läkarna på olika platser.19 I en studie från 2012 där man undersökte dödligheten hos 3 770 patienter med akut PE som fick pulmonell embolektomi, visade uppgifterna att både hos instabila och stabila patienter var dödligheten lägre hos dem som fick ett IVC-filter.20
Och även om ovanstående data är gynnsamma för kompletterande IVC-filterplacering hos massiva PE-patienter, åtminstone när det gäller resultat på kort sikt, utesluter den lilla storleken och avsaknaden av randomisering upprättandet av evidensbaserade riktlinjer. I CHEST-riktlinjerna från 2016 påpekas att eftersom det är osäkert om det är fördelaktigt att placera ett IVC-filter adjunktivt hos antikoagulerade patienter med svår PE, kan rekommendationen mot insättning av ett IVC-filter hos patienter med akut PE som är antikoagulerade kanske inte gälla för denna specifika undergrupp av patienter3 .
Bottom line
Det finns ingen evidensbaserad riktlinje om huruvida IVC-filter bör sättas in som tillägg till antikoagulation hos patienter med submassiv eller massiv PE; baserat på expertkonsensus kan det dock vara lämpligt att sätta in ett IVC-filter som tillägg till antikoagulation hos patienter med svår PE. Beslutet bör vara individuellt baserat på varje patients egenskaper, preferenser och institutionell expertis.
I vårt fall fick patienten, i hopp om att förhindra ytterligare embolisk belastning, ett IVC-filter dagen efter presentationen. Trots att antikoagulation med heparin inleddes förblev hon takykardi och takypné, vilket föranledde remiss för CDT. Det interventionella radiologiteamet ansåg inte att hon var en bra kandidat, med tanke på hennes ihållande vaginala blödningar och det långt utbredda metastaserade uteruskarcinomet. Hon övergick till terapeutiskt enoxaparin efter att inget ytterligare invasivt ingrepp ansågs lämpligt. Hennes respiratoriska status förbättrades inte och positivt luftvägstryck på bilevel påbörjades. Med hänsyn till den terminala karaktären hos hennes cancer valde hon slutligen att fortsätta med komfortvård och avled kort därefter.
Acknowledgements
Författarna vill tacka Benjamin A. Hohmuth, MD, A. Joseph Layon, MD, och Luis L. Nadal, MD, för deras granskning av artikeln och ovärderlig feedback.
Dr Wenqian Wang, Dr Vedamurthy och Dr Wang arbetar på avdelningen för sjukhusmedicin vid The Medicine Institute, Geisinger Health System, Danville, Penn. Kontakta dr Wenqian Wang på .
Nyckelpunkter
– Använd lungangiografiska data, klinisk stabilitet och analys av andra komorbida tillstånd för att besluta om den bästa behandlingsmodaliteten.
– Vårt team föredrar ultraljudsförstärkt trombolys (EKOS) för submassiva PE-patienter, massiva PE-patienter och som ett räddningsprocedur för patienter som misslyckas med systemisk trombolys.
– Det är klokt att inrätta multidisciplinära team bestående av interventionsradiologer, intensivister, kardiologer och kärlkirurger för att fatta individualiserade beslut.
– Det kan vara lämpligt att placera ett IVC-filter som ett komplement till antikoagulation hos patienter med svår PE.
1. Jaff MR, McMurtry MS, Archer SL, et al. Behandling av massiv och submassiv lungemboli, iliofemoral djup ventrombos och kronisk tromboembolisk pulmonell hypertension: ett vetenskapligt uttalande från American Heart Association. Circulation. 2011;123:1788-1830.
2. Goldhaber SZ, Visani L, De Rosa M. Acute pulmonary embolism: clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER). Lancet. 1999;353:1386-9.
3. Kearon C, Akl EA, Ornelas J, et al. Antitrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report. Chest. 2016;149:315-52.
4. Konstantinides S, Geibel A, Heusel G, Heinrich F, Kasper W. Management Strategies and Prognosis of Pulmonary Embolism-3 Trial Investigators. Heparin plus alteplase jämfört med enbart heparin hos patienter med submassiv lungemboli. N Engl J Med. 2002;347:1143-50.
5. Sharifi M, Bay C, Skrocki L, Rahimi F, Mehdipour M, ”MOPETT” Investigators. Måttlig lungemboli behandlad med trombolys (från ”MOPETT”-studien). Am J Cardiol. 2013;111:273-7.
6. Meyer G, Vicaut E, Danays T, et al. Fibrinolysis for patients with intermediate-risk pulmonary embolism. N Engl J Med. 2014;370:1402-11.
7. Kuo WT. Endovaskulär behandling vid akut lungemboli. J Vasc Interv Radiol 2012;23:167-79. e164
8. Kucher N, Boekstegers P, Muller OJ, et al. Randomiserad, kontrollerad studie av ultraljudsassisterad kateterstyrd trombolys vid akut intermediärrisk lungemboli. Circulation. 2014;129:479-86.
9. Kuo WT, Banerjee A, Kim PS, et al. Pulmonary Embolism Response to Fragmentation, Embolectomy, and Catheter Thrombolysis (PERFECT): Initial Results From a Prospective Multicenter Registry. Chest. 2015;148:667-73.
10. Piazza G, Hohlfelder B, Jaff MR, et al. A Prospective, Single-Arm, Multicenter Trial of Ultrasound-Facilitated, Catheter-Directed, Low-Dose Fibrinolysis for Acute Massive and Submassive Pulmonary Embolism: SEATTLE II-studien. JACC Cardiovasc Interv. 2015;8:1382-92.
11. Sharifi M. Systemic Full Dose, Half Dose, and Catheter Directed Thrombolysis for Pulmonary Embolism. När ska man använda och hur ska man välja? Curr Treat Options Cardiovasc Med. 2016;18:31.
12. Wang C, Zhai Z, Yang Y, et al. Efficacy and safety of low dose recombinant tissue-type plasminogen activator for the treatment of acute pulmonary thromboembolism: a randomized, multicenter, controlled trial. Chest. 2010;137:254-62.
13. Sharifi M, Vajo Z, Freeman W, Bay C, Sharifi M, Schwartz F. Transforming and simplifying the treatment of pulmonary embolism: ”safe dose” thrombolysis plus new oral anticoagulants. Lung. 2015;193:369-74.
14. Kabrhel C, Rosovsky R, Channick R, et al. Ett multidisciplinärt team för respons på lungemboli: Initial 30-Month Experience With a Novel Approach to Delivery of Care to Patients With Submassive and Massive Pulmonary Embolism. Chest. 2016;150:384-93.
15. Lessne ML, Sing RF. Counterpoint: Överväger fördelarna riskerna för de flesta patienter som övervägs för inferior vena cava-filter? No. Chest. 2016; 150(6):1182-4.
16. The PREPIC Study Group. Åtta års uppföljning av patienter med permanenta vena cava-filter för att förebygga lungemboli: den randomiserade PREPIC-studien (Prevention du Risque d’Embolie Pulmonaire par Interruption Cave). Circulation. 2005;112(3):416-22.
17. Mismetti P, Laporte S, Pellerin O, et al. Effekten av ett återtagbart inferior vena cava-filter plus antikoagulation jämfört med enbart antikoagulation på risken för återkommande lungemboli: en randomiserad klinisk studie. JAMA. 2015. 313(16):1627-35.
18. Deshpande KS, Hatem C, Karwa M, et al. Användningen av inferior vena cava-filter som en behandlingsmodalitet för massiv lungemboli. En fallserie och genomgång av patofysiologin. Respir Med. 2002.96(12):984-9.
19. Kucher N, Rossi E, De Rosa M, et al. Massiv lungemboli. Circulation. 2006;113(4):577-82.
20. Stein P, Matta F. Case Fatality Rate with Pulmonary Embolectomy for Acute Pulmonary Embolism. Am J Med. 2012;125:471-7.