Il caso
Una donna morbosamente obesa di 49 anni si è presentata al pronto soccorso con mancanza di respiro e distensione addominale. Alla presentazione, la sua pressione sanguigna era 100/60 mm Hg con una frequenza cardiaca di 110, frequenza respiratoria di 24, e una saturazione pulsossimetrica (SpO2) di 86% su aria ambiente. La troponina T era elevata a 0,3 ng/mL. La tomografia computerizzata (TC) del torace con contrasto endovenoso ha mostrato un’embolia polmonare a sella (PE) con ventricolo destro dilatato (RV). La TC addome/pelvi ha rivelato una massa uterina molto grande con linfoadenopatia diffusa.
L’infusione di eparina è stata iniziata prontamente. L’ecocardiogramma ha dimostrato una deformazione della RV. I risultati dell’ecografia duplex delle estremità inferiori erano coerenti con una trombosi venosa profonda acuta (DVT) che coinvolgeva la vena femorale comune sinistra e la vena poplitea destra. La biopsia di un linfonodo sopraclavicolare ha mostrato un carcinoma indifferenziato di alto grado molto probabilmente di origine uterina.
Domande cliniche
Quali opzioni terapeutiche dovrebbero essere considerate oltre all’anticoagulazione sistemica standard? C’è un ruolo per:
1. Trombolisi sistemica?
2. Trombolisi catetere-diretta (CDT)?
3. Posizionamento del filtro della vena cava inferiore (IVC)?
Qual è la gestione appropriata dell’EP “submassiva”?
Nel caso di EP massiva, in cui il trombo si trova nella vasculatura polmonare centrale ed è associato a ipotensione dovuta a compromissione della gittata cardiaca, la trombolisi sistemica, l’embolectomia e la CDT sono indicate come misure potenzialmente salvavita. Tuttavia, l’evidenza è meno chiara quando l’EP è grande e ha portato allo sforzo del RV, ma senza instabilità emodinamica manifesta. Questo è comunemente noto come rischio intermedio o PE “submassiva”. L’EP submassiva basata sulle linee guida dell’American Heart Association (AHA) è:1
Un’EP acuta senza ipotensione sistemica (pressione sanguigna sistolica inferiore a 90 mm Hg) ma con disfunzione del RV o necrosi miocardica. La disfunzione RV è definita dalla presenza di almeno uno dei seguenti:
– dilatazione RV (diametro apicale 4 camere RV diviso per il diametro LV maggiore di 0.9) o disfunzione sistolica RV su ecocardiografia;
– Dilatazione RV su CT, elevazione di BNP (maggiore di 90 pg/mL), elevazione di N-terminale pro-BNP (maggiore di 500 pg/mL);
– Cambiamenti elettrocardiografici (nuovo blocco di branca destro completo o incompleto, elevazione o depressione ST anterosettale, o inversione anterosettale dell’onda T).
La necrosi miocardica è definita come troponina I elevata (maggiore di 0,4 ng/mL) o troponina T elevata (maggiore di 0,1 ng/mL).
Nel 1999, l’analisi dell’International Cooperative Pulmonary Embolism Registry (ICOPER) ha rivelato che la disfunzione della RV nei pazienti con PE era associata a un quasi raddoppio del rischio di mortalità a 3 mesi (hazard ratio 2.0, 1.3-2.9).2 Dato questo aumento del rischio, si potrebbe trarre la conclusione logica che dobbiamo trattare l’EP submassiva in modo più aggressivo rispetto all’EP senza deformazione della RV. Ma questo si tradurrà necessariamente in un risultato migliore per il paziente, dato il rischio del 3% di emorragia intracranica associato alla terapia trombolitica?
Nello scenario clinico di cui sopra, il paziente ha soddisfatto la definizione di EP submassiva. Mentre la paziente non ha sperimentato ipotensione sistemica, ha avuto una dilatazione del RV alla TAC, una disfunzione sistolica del RV all’eco e un elevato livello di Troponina T. Oltre a iniziare la terapia anticoagulante, cos’altro si dovrebbe fare per aumentare le probabilità di un buon esito?
L’AHA raccomanda di prendere in considerazione la trombolisi sistemica e la CDT per i pazienti con EP acuta sottomassiccia se hanno prove cliniche di prognosi avversa, compreso il peggioramento dell’insufficienza respiratoria, una grave disfunzione della RV o una necrosi miocardica maggiore e un basso rischio di complicazioni emorragiche (Classe IIB; Livello di evidenza C).1
L’aggiornamento 2016 delle linee guida dell’American College of Chest Physicians (CHEST)3 raccomanda una terapia trombolitica somministrata per via sistemica piuttosto che nessuna terapia in pazienti selezionati con EP acuta che si deteriorano dopo l’inizio della terapia anticoagulante ma che devono ancora sviluppare ipotensione e che hanno un basso rischio di sanguinamento (raccomandazione di grado 2C).
Trombolisi sistemica
La trombolisi sistemica viene somministrata come infusione trombolitica endovenosa per un periodo di tempo. I farmaci trombolitici approvati dalla Food and Drug Administration includono attualmente l’attivatore del plasminogeno tissutale (tPA)/alteplase, streptochinasi e urochinasi.
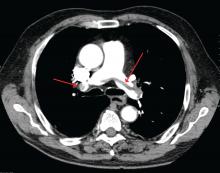 James Heilman, MD (usato sotto licenza Creative Commons)
James Heilman, MD (usato sotto licenza Creative Commons)
Una grande embolia polmonare alla biforcazione dell’arteria polmonare (embolia a sella).
Nel Pulmonary Embolism-3 Trial randomizzato e in doppio cieco del 2002,4 Konstantinides e colleghi hanno confrontato eparina più tPA rispetto a eparina più placebo in 256 pazienti con EP submassiva. L’endpoint clinico primario di morte o escalation di cura in ospedale era 11.0 % nel gruppo tPA contro 24.6% nel gruppo placebo (P = .006); la differenza è stata guidata in gran parte dall’escalation di cura, definito come uso di vasopressori, trombolisi di salvataggio, ventilazione meccanica, arresto cardiaco e richiesta di embolectomia chirurgica. Forse sorprendentemente, non ci sono stati casi di ictus emorragico in nessuno di questi gruppi. Lo studio ha dimostrato che la trombolisi sistemica nell’EP submassiva è stata associata a un minor rischio di morte e di escalation del trattamento.
L’efficacia della trombolisi a basso dosaggio è stata studiata nel MOPETT 2013,5 uno studio monocentrico, prospettico, randomizzato, in aperto, in cui 126 partecipanti che sono risultati avere un’EP submassiva in base ai sintomi e ai dati angiografici TC o di ventilazione/perfusione hanno ricevuto 50 mg di tPA più eparina o solo anticoagulazione eparinica. L’endpoint composito di ipertensione polmonare e PE ricorrente a 28 mesi era del 16% nel gruppo tPA rispetto al 63% nel gruppo di controllo (P inferiore a .001). La trombolisi sistemica è stata associata a un rischio inferiore di ipertensione polmonare e PE ricorrente, anche se nessun beneficio di mortalità è stato visto in questo piccolo studio.
Nello studio randomizzato, in doppio cieco PEITHO (n = 1.006) del 20146 che confrontava tenecteplase più eparina rispetto all’eparina nei pazienti con PE submassiva, gli esiti primari di morte e scompenso emodinamico si sono verificati nel 2,6% del gruppo tenecteplase, rispetto al 5,6% nel gruppo placebo (P = .02). La terapia trombolitica è stata associata a un tasso del 2% di ictus emorragico, mentre l’ictus emorragico nel gruppo placebo era dello 0,2% (P = .03). In questo caso, la trombolisi sistemica è stata associata a un rischio inferiore del 3% di morte e instabilità emodinamica, ma anche a un rischio aumentato del 1,8% di ictus emorragico.
Trombolisi catetere-diretta (CDT)
CDT è stata originariamente sviluppata per trattare le trombosi arteriose, degli innesti di dialisi e delle vene profonde, ma è ora approvata dalla FDA per il trattamento dell’EP acuta submassiva o massiva.
Un filo viene fatto passare attraverso l’embolo e viene posizionato un catetere di infusione multiforo, attraverso il quale viene infuso un farmaco trombolitico per 12-24 ore. Si ritiene che la somministrazione diretta del farmaco nel trombo sia efficace quanto la terapia sistemica, ma con un minor rischio di sanguinamento. Se è indicata una rimozione più rapida del trombo a causa di un grande carico di coaguli e di instabilità emodinamica, le terapie meccaniche, come la frammentazione e l’aspirazione, possono essere utilizzate in aggiunta alla CDT. Tuttavia, queste tecniche meccaniche comportano il rischio di lesione dell’arteria polmonare e quindi dovrebbero essere usate solo come ultima risorsa. Un filo che emette ultrasuoni può essere aggiunto al catetere di infusione multiforo per accelerare la trombolisi interrompendo ultrasonicamente il trombo, una tecnica nota come trombolisi potenziata dagli ultrasuoni (EKOS).7,10
Lo studio ULTIMA 2014,8 un piccolo studio randomizzato, in aperto di trombolisi diretta da catetere ad ultrasuoni (USAT, il termine può essere usato in modo intercambiabile con EKOS) rispetto alla sola anticoagulazione con eparina in 59 pazienti, è stato progettato per studiare se la prima strategia fosse migliore nel migliorare la misura di esito primario del rapporto RV/LV in pazienti con PE submassiva. La riduzione media del rapporto RV/LV è stata di 0,30 +/- 0,20 nel gruppo USAT rispetto a 0,03 +/- 0,16 nel gruppo eparina (P inferiore a .001). Tuttavia, nessuna differenza significativa nella mortalità o nel sanguinamento è stata osservata nei gruppi al follow-up di 90 giorni.
Il PERFECT 2015 Trial,9 uno studio multicentrico basato su registro, ha arruolato prospetticamente 101 pazienti che hanno ricevuto CDT come terapia di prima linea per l’EP massiva e submassiva. Tra i pazienti con EP submassiva, il 97,3% è risultato avere “successo clinico” con questo trattamento, definito come stabilizzazione dell’emodinamica, miglioramento dell’ipertensione polmonare e dello sforzo del cuore destro, e sopravvivenza alla dimissione dall’ospedale. Non ci sono stati sanguinamenti maggiori o emorragie intracraniche. Le analisi di sottogruppo in questo studio che confrontavano USAT contro CDT standard non hanno rivelato differenze significative nelle variazioni medie della pressione polmonare, nelle dosi medie di trombolitici o nei tempi medi di infusione.
Uno studio multicentrico prospettico a braccio singolo, SEATTLE II 2015,10 ha valutato l’efficacia di EKOS in un campione di 159 pazienti. I pazienti con PE sia massiva che submassiva hanno ricevuto circa 24 mg di tPA infusi attraverso un catetere per 12-24 ore. L’esito primario dell’efficacia era la diminuzione del rapporto RV/LV misurato dalla TAC del torace rispetto al basale rispetto a 48 ore dopo la procedura. Il rapporto pre e post-procedura era 1,55 contro 1,13 rispettivamente (P inferiore a .001), indicando che EKOS ha diminuito la dilatazione della RV. Non è stata osservata alcuna emorragia intracranica e gli investigatori non hanno commentato gli esiti a lungo termine come la mortalità o la qualità della vita. Lo studio era limitato dalla mancanza di un gruppo di confronto, come l’anticoagulazione con eparina come monoterapia, o la trombolisi sistemica o la CDT standard.
Il trattamento dell’EP submassiva varia tra diverse istituzioni. Semplicemente non ci sono dati adeguati che confrontano la trombolisi sistemica a bassa dose, la CDT, l’EKOS e l’anticoagulazione con eparina standard per formulare raccomandazioni definitive. Alcuni ricercatori ritengono che la trombolisi sistemica a basse dosi sia probabilmente valida quanto le costose terapie trombolitiche basate sul catetere.11,12 La terapia trombolitica a basse dosi può essere seguita dall’uso di inibitori orali diretti del fattore Xa per il mantenimento dell’attività antitrombotica.13
Bottom line
Nel nostro istituto, il team di radiologia interventistica seleziona caso per caso i pazienti che soddisfano i criteri per l’EP submassiva. Usiamo i dati angiografici polmonari (natura ed estensione del trombo), la stabilità clinica e l’analisi di altre condizioni comorbide per decidere la migliore modalità di trattamento per un singolo paziente. Il nostro team preferisce l’EKOS per i pazienti con EP submassiva così come per i pazienti con EP massiva e come procedura di salvataggio per i pazienti che hanno fallito la trombolisi sistemica.
Fino a quando non saranno disponibili più dati per sostenere linee guida definitive, riteniamo che la creazione di team multidisciplinari composti da radiologi interventisti, intensivisti, cardiologi e chirurghi vascolari sia prudente per prendere decisioni individualizzate e per ottenere i migliori risultati per i nostri pazienti.14
Filtro IVC
Siccome la paziente in questo caso ha già un’EP submassiva, può tollerare un ulteriore carico di coaguli se la DVT rimanente dovesse embolizzare di nuovo? C’è un ruolo per il filtro IVC?
L’impianto di filtri IVC è aumentato significativamente negli ultimi 30 anni, senza prove di qualità che ne giustifichino l’uso.15
La terapia antitrombotica 2016 per la malattia da TEV: CHEST Guideline and Expert Panel Report afferma chiaramente: Nei pazienti con TVP acuta della gamba o PE che sono trattati con anticoagulanti, l’uso di un filtro IVC non è raccomandato (Grado 1B).3 Questa raccomandazione si basa sui risultati dello studio randomizzato Prevention du Risque d’Embolie Pulmonaire par Interruption Cave (PREPIC),16 e dello studio randomizzato PREPIC 2 pubblicato di recente,17 che dimostrano entrambi che in pazienti anticoagulati con EP e TVP, il posizionamento contemporaneo di un filtro IVC per 3 mesi non ha ridotto l’EP ricorrente, compresa l’EP fatale.
Le linee guida del CHEST affermano che un filtro IVC non dovrebbe essere inserito di routine come aggiunta in pazienti con EP e TVP. Tuttavia, che dire del sottogruppo di pazienti con EP submassiva o massiva in cui un’altra EP sarebbe catastrofica? Mancano dati clinici in quest’area.
Deshpande et al. hanno riportato una serie di sei pazienti con PE massiva e instabilità cardiopolmonare; tutti i pazienti hanno ricevuto un filtro IVC con anticoagulazione. L’esito a breve termine è stato eccellente, ma il follow-up a lungo termine non è stato effettuato.18 Kucher e colleghi hanno riferito che dall’ICOPER del 2006, su 108 pazienti con EP massiva con pressione arteriosa sistolica inferiore a 90 mm Hg, 11 pazienti hanno ricevuto il posizionamento aggiuntivo del filtro IVC. Nessuno di questi 11 pazienti ha sviluppato un’EP ricorrente in 90 giorni e 10 di loro sono sopravvissuti per almeno 90 giorni; il posizionamento del filtro IVC è stato associato a una riduzione della mortalità a 90 giorni. In questo studio, il posizionamento di un filtro IVC è stato deciso interamente dai medici dei diversi siti.19 In uno studio del 2012 che ha esaminato i tassi di mortalità in 3.770 pazienti con EP acuta sottoposti a embolectomia polmonare, i dati hanno mostrato che sia nei pazienti instabili che in quelli stabili, i tassi di mortalità erano inferiori in quelli che avevano ricevuto un filtro IVC.20
Anche se i dati di cui sopra sono favorevoli al posizionamento aggiuntivo del filtro IVC nei pazienti con EP massiva, almeno per quanto riguarda gli esiti a breve termine, le piccole dimensioni e la mancanza di randomizzazione precludono la definizione di linee guida basate sull’evidenza. Le linee guida CHEST del 2016 sottolineano che, poiché non è certo che vi sia un beneficio nel posizionare un filtro IVC in maniera aggiuntiva nei pazienti anticoagulati con grave PE, in questo specifico sottogruppo di pazienti, la raccomandazione contro l’inserimento di un filtro IVC nei pazienti con PE acuta che sono anticoagulati potrebbe non essere applicabile.3
Bottom line
Non esiste una linea guida basata sull’evidenza che stabilisca se i filtri IVC debbano essere inseriti in aggiunta a pazienti con EP submassiva o massiva; tuttavia, sulla base del consenso degli esperti, può essere opportuno inserire un filtro IVC come aggiunta all’anticoagulazione in pazienti con grave EP. La decisione dovrebbe essere individualizzata in base alle caratteristiche di ciascun paziente, alle preferenze e alla competenza istituzionale.
Nel nostro caso, nella speranza di prevenire un ulteriore carico embolico, il paziente ha ricevuto un filtro IVC il giorno dopo la presentazione. Nonostante l’inizio dell’anticoagulazione con eparina, è rimasta tachicardica e tachipnoica, spingendo a fare riferimento alla CDT. Il team di radiologia interventistica non ha ritenuto che fosse una buona candidata, dato il suo persistente sanguinamento vaginale e il carcinoma uterino ampiamente metastatico. È stata passata all’enoxaparina terapeutica dopo che nessun altro intervento invasivo è stato ritenuto appropriato. Il suo stato respiratorio non è migliorato ed è stata avviata la pressione positiva delle vie aeree a livello bilaterale. Prendendo in considerazione la natura terminale del suo cancro, alla fine ha scelto di perseguire la cura di conforto ed è morto poco dopo.
Riconoscimenti
Gli autori vorrebbero ringraziare Benjamin A. Hohmuth, MD, A. Joseph Layon, MD, e Luis L. Nadal, MD, per la loro revisione dell’articolo e il loro prezioso feedback.
Il dottor Wenqian Wang, il dottor Vedamurthy e il dottor Wang lavorano presso il dipartimento di medicina ospedaliera del The Medicine Institute, Geisinger Health System, Danville, Penn. Contattare il Dr. Wenqian Wang a .
Punti chiave
– Utilizzare i dati angiografici polmonari, la stabilità clinica e l’analisi di altre condizioni comorbide per decidere la migliore modalità di trattamento.
– Il nostro team preferisce la trombolisi potenziata dagli ultrasuoni (EKOS) per i pazienti con EP submassiva, pazienti con EP massiva e come procedura di salvataggio per i pazienti che falliscono la trombolisi sistemica.
– Stabilire team multidisciplinari composti da radiologi interventisti, intensivisti, cardiologi e chirurghi vascolari è prudente per prendere decisioni individualizzate.
– Può essere opportuno posizionare un filtro IVC come aggiunta all’anticoagulazione nei pazienti con grave PE.
1. Jaff MR, McMurtry MS, Archer SL, et al. Gestione di embolia polmonare massiva e submassiva, trombosi venosa profonda iliofemorale e ipertensione polmonare tromboembolica cronica: una dichiarazione scientifica dell’American Heart Association. Circolazione. 2011;123:1788-1830.
2. Goldhaber SZ, Visani L, De Rosa M. Embolia polmonare acuta: risultati clinici nel registro internazionale cooperativo embolia polmonare (ICOPER). Lancet. 1999;353:1386-9.
3. Kearon C, Akl EA, Ornelas J, et al. Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report. Chest. 2016;149:315-52.
4. Konstantinides S, Geibel A, Heusel G, Heinrich F, Kasper W. Management Strategies and Prognosis of Pulmonary Embolism-3 Trial Investigators. Eparina più alteplase rispetto alla sola eparina nei pazienti con embolia polmonare submassiccia. N Engl J Med. 2002;347:1143-50.
5. Sharifi M, Bay C, Skrocki L, Rahimi F, Mehdipour M, “MOPETT” Investigators. Embolia polmonare moderata trattata con trombolisi (dal “MOPETT” Trial). Am J Cardiol. 2013;111:273-7.
6. Meyer G, Vicaut E, Danays T, et al. Fibrinolisi per i pazienti con embolia polmonare a rischio intermedio. N Engl J Med. 2014;370:1402-11.
7. Kuo WT. Terapia endovascolare per l’embolia polmonare acuta. J Vasc Interv Radiol 2012;23:167-79. e164
8. Kucher N, Boekstegers P, Muller OJ, et al. Randomized, controlled trial of ultrasound-assisted catheter-directed thrombolysis for acute intermediate-risk pulmonary embolism. Circolazione. 2014;129:479-86.
9. Kuo WT, Banerjee A, Kim PS, et al. Embolia polmonare risposta alla frammentazione, embolectomia e trombolisi catetere (PERFECT): Risultati iniziali da un registro multicentrico prospettico. Chest. 2015;148:667-73.
10. Piazza G, Hohlfelder B, Jaff MR, et al. A Prospective, Single-Arm, Multicenter Trial of Ultrasound-Facilitated, Catheter-Directed, Low-Dose Fibrinolysis for Acute Massive and Submassive Pulmonary Embolism: Lo studio SEATTLE II. JACC Cardiovasc Interv. 2015;8:1382-92.
11. Sharifi M. Trombolisi sistemica a dose piena, mezza dose e con catetere per embolia polmonare. Quando usare e come scegliere? Curr Treat Options Cardiovasc Med. 2016;18:31.
12. Wang C, Zhai Z, Yang Y, et al. Efficacia e sicurezza dell’attivatore ricombinante del plasminogeno di tipo tissutale a bassa dose per il trattamento del tromboembolismo polmonare acuto: uno studio randomizzato, multicentrico, controllato. Chest. 2010;137:254-62.
13. Sharifi M, Vajo Z, Freeman W, Bay C, Sharifi M, Schwartz F. Trasformare e semplificare il trattamento dell’embolia polmonare: trombolisi “dose sicura” più nuovi anticoagulanti orali. Polmone. 2015;193:369-74.
14. Kabrhel C, Rosovsky R, Channick R, et al. A Multidisciplinary Pulmonary Embolism Response Team: Esperienza iniziale di 30 mesi con un nuovo approccio alla fornitura di cure ai pazienti con embolia polmonare submassiccia e massiccia. Chest. 2016;150:384-93.
15. Lessne ML, Sing RF. Contrappunto: Do the Benefits Outweigh the Risks for Most Patients Under Consideration for inferior vena cava filters? No. Chest. 2016; 150(6):1182-4.
16. Il gruppo di studio PREPIC. Otto anni di follow-up dei pazienti con filtri vena cava permanente nella prevenzione dell’embolia polmonare: il PREPIC (Prevention du Risque d’Embolie Pulmonaire par Interruption Cave) studio randomizzato. Circolazione. 2005;112(3):416-22.
17. Mismetti P, Laporte S, Pellerin O, et al. Effetto di un filtro recuperabile vena cava inferiore più anticoagulazione vs anticoagulazione solo sul rischio di embolia polmonare ricorrente: uno studio clinico randomizzato. JAMA. 2015. 313(16):1627-35.
18. Deshpande KS, Hatem C, Karwa M, et al. L’uso del filtro della vena cava inferiore come modalità di trattamento per l’embolia polmonare massiva. Una serie di casi e revisione della fisiopatologia. Respir Med. 2002.96(12):984-9.
19. Kucher N, Rossi E, De Rosa M, et al. Embolia polmonare massiva. Circolazione. 2006;113(4):577-82.
20. Stein P, Matta F. Case Fatality Rate with Pulmonary Embolectomy for Acute Pulmonary Embolism. Am J Med. 2012;125:471-7.