Der Fall
Eine 49-jährige krankhaft fettleibige Frau stellte sich in der Notaufnahme mit Kurzatmigkeit und abdominaler Dehnung vor. Bei der Vorstellung lag ihr Blutdruck bei 100/60 mm Hg, die Herzfrequenz bei 110, die Atemfrequenz bei 24 und die pulsoximetrische Sättigung (SpO2) bei 86 % bei Raumluft. Der Troponin-T-Wert war mit 0,3 ng/ml erhöht. Die Computertomographie (CT) des Brustkorbs mit intravenösem Kontrastmittel zeigte eine sattelförmige Lungenembolie (PE) mit erweitertem rechten Ventrikel (RV). Das CT des Abdomens/Beckens zeigte eine sehr große uterine Masse mit diffuser Lymphadenopathie.
Eine Heparin-Infusion wurde sofort begonnen. Das Echokardiogramm zeigte eine RV-Dehnung. Die Duplex-Ultraschalluntersuchung der unteren Extremitäten ergab eine akute tiefe Venenthrombose mit Beteiligung der linken Vena femoralis communis und der rechten Vena poplitea. Die Biopsie eines supraklavikulären Lymphknotens ergab ein hochgradiges undifferenziertes Karzinom, das höchstwahrscheinlich uterinen Ursprungs war.
Klinische Fragen
Welche, wenn überhaupt, therapeutischen Optionen sollten neben der systemischen Standardantikoagulation in Betracht gezogen werden? Gibt es eine Rolle für:
1. Systemische Thrombolyse?
2. Kathetergesteuerte Thrombolyse (CDT)?
3. Einsetzen eines Filters für die untere Hohlvene (IVC)?
Was ist die angemessene Behandlung einer „submassiven“ PE?
Bei einer massiven Lungenembolie, bei der sich der Thrombus im zentralen Lungengefäßsystem befindet und die mit einer Hypotonie aufgrund eines verminderten Herzzeitvolumens einhergeht, sind systemische Thrombolyse, Embolektomie und CDT als potenziell lebensrettende Maßnahmen angezeigt. Allerdings ist die Beweislage weniger eindeutig, wenn die PE groß ist und zu einer RV-Belastung geführt hat, aber keine offenkundige hämodynamische Instabilität vorliegt. Dies wird gemeinhin als PE mit mittlerem Risiko oder „submassive“ PE bezeichnet. Eine submassive Lungenembolie ist nach den Leitlinien der American Heart Association (AHA):1
eine akute Lungenembolie ohne systemische Hypotonie (systolischer Blutdruck unter 90 mm Hg), aber entweder mit RV-Dysfunktion oder Myokardnekrose. Eine RV-Dysfunktion ist definiert durch das Vorhandensein von mindestens einem der folgenden Merkmale:
– RV-Dilatation (apikaler 4-Kammer-RV-Durchmesser dividiert durch LV-Durchmesser größer als 0.9) oder systolische RV-Dysfunktion in der Echokardiographie;
– RV-Dilatation in der CT, Erhöhung von BNP (mehr als 90 pg/ml), Erhöhung von N-terminalem pro-BNP (mehr als 500 pg/ml);
– Elektrokardiographische Veränderungen (neuer kompletter oder inkompletter Rechtsschenkelblock, anteroseptale ST-Hebung oder -Senkung oder anteroseptale T-Wellen-Inversion).
Myokardiale Nekrose ist definiert als erhöhtes Troponin I (größer als 0,4 ng/ml) oder erhöhtes Troponin T (größer als 0,1 ng/ml).
Warum ist eine submassive PE von klinischer Bedeutung?
Im Jahr 1999 ergab eine Analyse des International Cooperative Pulmonary Embolism Registry (ICOPER), dass eine RV-Dysfunktion bei PE-Patienten mit einer annähernden Verdoppelung des 3-Monats-Mortalitätsrisikos verbunden war (Hazard Ratio 2,0, 1,3-2,9).2 Angesichts dieses erhöhten Risikos könnte man die logische Schlussfolgerung ziehen, dass wir submassive PE aggressiver behandeln müssen als PE ohne RV-Belastung. Aber wird dies angesichts des 3 %igen Risikos einer intrakraniellen Blutung, das mit einer thrombolytischen Therapie verbunden ist, zwangsläufig zu einem besseren Ergebnis für den Patienten führen?
In dem oben beschriebenen klinischen Szenario erfüllte der Patient die Definition einer submassiven PE. Die Patientin hatte zwar keine systemische Hypotonie, wies aber eine RV-Dilatation im CT, eine systolische RV-Dysfunktion im Echo sowie einen erhöhten Troponin-T-Wert auf. Was sollte zusätzlich zur Einleitung einer gerinnungshemmenden Therapie getan werden, um die Wahrscheinlichkeit eines guten Ausgangs zu erhöhen?
Die AHA empfiehlt, dass eine systemische Thrombolyse und eine CDT bei Patienten mit akuter submassiver PE in Betracht gezogen werden sollten, wenn es klinische Hinweise auf eine ungünstige Prognose gibt, einschließlich einer Verschlechterung der Ateminsuffizienz, einer schweren RV-Dysfunktion oder einer schweren Myokardnekrose, und das Risiko von Blutungskomplikationen gering ist (Klasse IIB; Evidenzgrad C).1
Die aktualisierten Leitlinien des American College of Chest Physicians (CHEST) aus dem Jahr 20163 empfehlen bei ausgewählten Patienten mit akuter Lungenembolie, bei denen sich die Situation nach Beginn der gerinnungshemmenden Therapie verschlechtert, die aber noch keine Hypotonie entwickelt haben und die ein geringes Blutungsrisiko aufweisen, eine systemische Thrombolysetherapie gegenüber einer Nichtbehandlung (Klasse 2C-Empfehlung).
Systemische Thrombolyse
Die systemische Thrombolyse wird als intravenöse thrombolytische Infusion über einen bestimmten Zeitraum verabreicht. Zu den von der Food and Drug Administration zugelassenen Thrombolytika gehören derzeit Gewebeplasminogenaktivator (tPA)/Alteplase, Streptokinase und Urokinase.
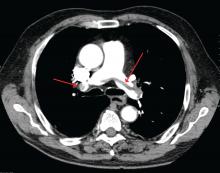 James Heilman, MD (verwendet unter Creative Commons Lizenz)
James Heilman, MD (verwendet unter Creative Commons Lizenz)
Eine große Lungenembolie an der Verzweigung der Lungenarterie (Sattelembolie).
In der 2002 durchgeführten randomisierten, doppelblinden Lungenembolie-3-Studie4 verglichen Konstantinides und Kollegen Heparin plus tPA mit Heparin plus Placebo bei 256 Patienten mit submassiver Lungenembolie. Der primäre klinische Endpunkt, d. h. der Tod oder die Eskalation der Behandlung im Krankenhaus, lag bei 11,0 % in der tPA-Gruppe gegenüber 24,6 % in der Placebo-Gruppe (P = .006); der Unterschied war weitgehend auf die Eskalation der Behandlung zurückzuführen, die als Einsatz von Vasopressoren, Rettungsthrombolyse, mechanische Beatmung, Herzstillstand und Notwendigkeit einer chirurgischen Embolektomie definiert wurde. Es mag überraschen, dass es in keiner der beiden Gruppen zu einem hämorrhagischen Schlaganfall kam. Die Studie zeigte, dass die systemische Thrombolyse bei submassiver Lungenembolie mit einem geringeren Risiko für Tod und Behandlungseskalation verbunden war.
Die Wirksamkeit der niedrig dosierten Thrombolyse wurde in der MOPETT 20135 untersucht, einer prospektiven, randomisierten, offenen Studie, bei der 126 Teilnehmer, bei denen aufgrund von Symptomen und CT-Angiographie- oder Beatmungs-/Perfusionsscandaten eine submassive Lungenembolie festgestellt wurde, entweder 50 mg tPA plus Heparin oder eine alleinige Antikoagulation mit Heparin erhielten. Der zusammengesetzte Endpunkt von pulmonaler Hypertonie und rezidivierender Lungenembolie nach 28 Monaten lag in der tPA-Gruppe bei 16 % gegenüber 63 % in der Kontrollgruppe (p kleiner als .001). Die systemische Thrombolyse war mit einem geringeren Risiko für pulmonale Hypertonie und rezidivierende Lungenembolie verbunden, wenngleich in dieser kleinen Studie kein Nutzen für die Mortalität festgestellt wurde.
In der randomisierten, doppelblinden PEITHO-Studie (n = 1.006) aus dem Jahr 20146, in der Tenecteplase plus Heparin mit Heparin bei submassiver PE verglichen wurde, traten die primären Endpunkte Tod und hämodynamische Dekompensation bei 2,6 % der Tenecteplase-Gruppe auf, verglichen mit 5,6 % in der Placebo-Gruppe (P = .02). Die Thrombolysetherapie war mit einer Rate von 2 % hämorrhagischer Schlaganfälle verbunden, während die Rate der hämorrhagischen Schlaganfälle in der Placebogruppe 0,2 % betrug (P = .03). In diesem Fall war die systemische Thrombolyse mit einem um 3 % geringeren Risiko für Tod und hämodynamische Instabilität, aber auch mit einem um 1,8 % erhöhten Risiko für einen hämorrhagischen Schlaganfall verbunden.
Kathetergesteuerte Thrombolyse (CDT)
Die CDT wurde ursprünglich zur Behandlung von arteriellen Thrombosen, Dialysetransplantatthrombosen und tiefen Venenthrombosen entwickelt, ist aber jetzt von der FDA für die Behandlung akuter submassiver oder massiver PE zugelassen.
Ein Draht wird durch den Embolus geführt und ein Mehrloch-Infusionskatheter platziert, durch den ein thrombolytisches Medikament über 12-24 Stunden infundiert wird. Die direkte Verabreichung des Medikaments in den Thrombus gilt als ebenso wirksam wie eine systemische Therapie, birgt jedoch ein geringeres Blutungsrisiko. Wenn eine schnellere Entfernung des Thrombus aufgrund einer großen Gerinnsellast und hämodynamischer Instabilität angezeigt ist, können mechanische Therapien wie Fragmentierung und Aspiration als Ergänzung zur CDT eingesetzt werden. Diese mechanischen Verfahren bergen jedoch das Risiko einer Verletzung der Lungenarterie und sollten daher nur als letztes Mittel eingesetzt werden. Der Mehrloch-Infusionskatheter kann mit einem ultraschallemittierenden Draht versehen werden, um die Thrombolyse durch Ultraschallzerstörung des Thrombus zu beschleunigen, eine Technik, die als ultraschallunterstützte Thrombolyse (EKOS) bekannt ist.7,10
Die ULTIMA-Studie 2014,8 eine kleine, randomisierte, offene Studie zur ultraschallunterstützten kathetergesteuerten Thrombolyse (USAT, der Begriff kann austauschbar mit EKOS verwendet werden) im Vergleich zur alleinigen Heparin-Antikoagulation bei 59 Patienten, wurde konzipiert, um zu untersuchen, ob die erstgenannte Strategie das primäre Ergebnis, das RV/LV-Verhältnis, bei submassiven PE-Patienten besser verbessern kann. Die mittlere Verringerung des RV/LV-Verhältnisses betrug 0,30 +/- 0,20 in der USAT-Gruppe im Vergleich zu 0,03 +/- 0,16 in der Heparin-Gruppe (p kleiner als .001). Bei der 90-tägigen Nachbeobachtung wurde jedoch kein signifikanter Unterschied in Bezug auf Sterblichkeit oder Blutungen zwischen den Gruppen festgestellt.
Die PERFECT-Studie 2015,9 eine multizentrische, registerbasierte Studie, nahm prospektiv 101 Patienten auf, die eine CDT als Erstlinientherapie für massive und submassive PE erhielten. Bei 97,3 % der Patienten mit submassiver Lungenembolie wurde ein „klinischer Erfolg“ mit dieser Behandlung festgestellt, definiert als Stabilisierung der Hämodynamik, Verbesserung der pulmonalen Hypertonie und der Rechtsherzbelastung sowie Überleben bis zur Entlassung aus dem Krankenhaus. Es traten keine größeren Blutungen oder intrakraniellen Blutungen auf. Subgruppenanalysen in dieser Studie, in denen USAT mit der Standard-CDT verglichen wurde, ergaben keine signifikanten Unterschiede bei den durchschnittlichen Lungendruckveränderungen, den durchschnittlichen Thrombolytikadosen oder den durchschnittlichen Infusionszeiten.
Eine prospektive einarmige multizentrische Studie, SEATTLE II 2015,10 untersuchte die Wirksamkeit von EKOS bei einer Stichprobe von 159 Patienten. Patienten mit massiver und submassiver PE erhielten etwa 24 mg tPA über einen Katheter über 12-24 Stunden infundiert. Der primäre Wirksamkeitsnachweis war die im Thorax-CT gemessene Abnahme des RV/LV-Verhältnisses zwischen dem Ausgangswert und 48 Stunden nach dem Eingriff. Das Verhältnis vor und nach dem Eingriff betrug 1,55 bzw. 1,13 (P kleiner als .001), was darauf hindeutet, dass EKOS die RV-Dilatation verringerte. Es wurden keine intrakraniellen Blutungen beobachtet, und die Prüfärzte machten keine Angaben zu den langfristigen Ergebnissen wie Mortalität oder Lebensqualität. Die Studie wurde durch das Fehlen einer Vergleichsgruppe eingeschränkt, z. B. Antikoagulation mit Heparin als Monotherapie oder systemische Thrombolyse oder Standard-CT.
Die Behandlung der submassiven Lungenembolie variiert von Einrichtung zu Einrichtung. Es gibt einfach keine ausreichenden Daten zum Vergleich von niedrig dosierter systemischer Thrombolyse, CDT, EKOS und Standard-Heparin-Antikoagulation, um eindeutige Empfehlungen auszusprechen. Einige Forscher sind der Meinung, dass die niedrig dosierte systemische Thrombolyse wahrscheinlich genauso gut ist wie die teuren kathetergestützten Thrombolysetherapien.11,12 Auf die niedrig dosierte Thrombolyse kann die Einnahme von oralen direkten Faktor-Xa-Inhibitoren folgen, um die antithrombotische Wirkung aufrechtzuerhalten.13
Bottom line
In unserer Einrichtung untersucht das Team der interventionellen Radiologie Patienten, die die Kriterien für eine submassive PE erfüllen, von Fall zu Fall. Anhand der pulmonalangiographischen Daten (Art und Ausmaß des Thrombus), der klinischen Stabilität und der Analyse anderer Begleiterkrankungen entscheiden wir über die beste Behandlungsmethode für den einzelnen Patienten. Unser Team bevorzugt die EKOS bei submassiven PE-Patienten sowie bei massiven PE-Patienten und als Rettungsverfahren für Patienten, bei denen die systemische Thrombolyse versagt hat.
Solange nicht mehr Daten zur Verfügung stehen, die feste Leitlinien unterstützen, halten wir die Einrichtung multidisziplinärer Teams aus Interventionsradiologen, Intensivmedizinern, Kardiologen und Gefäßchirurgen für sinnvoll, um individuelle Entscheidungen zu treffen und die besten Ergebnisse für unsere Patienten zu erzielen.14
IVC-Filter
Da die Patientin in diesem Fall bereits eine submassive Lungenembolie hat, kann sie eine zusätzliche Gerinnselbelastung verkraften, falls sich ihre verbleibende TVT erneut embolisiert? Spielt der IVC-Filter eine Rolle?
Die Implantation von IVC-Filtern hat in den letzten 30 Jahren erheblich zugenommen, ohne dass die Qualität ihrer Anwendung belegt ist.15
Die 2016 Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report stellt klar fest: Bei Patienten mit akuter TVT des Beins oder PE, die mit Antikoagulantien behandelt werden, wird der Einsatz eines IVC-Filters nicht empfohlen (Grad 1B).3 Diese Empfehlung stützt sich auf die Ergebnisse der randomisierten PREPIC-Studie (Prevention du Risque d’Embolie Pulmonaire par Interruption Cave)16 und der kürzlich veröffentlichten randomisierten PREPIC-2-Studie17 , die beide zeigen, dass bei antikoagulierten Patienten mit PE und TVT die gleichzeitige Platzierung eines IVC-Filters über einen Zeitraum von drei Monaten nicht zu einer Verringerung der rezidivierenden PE, einschließlich der tödlichen PE, führt.
In den CHEST-Leitlinien heißt es, dass ein IVC-Filter bei Patienten mit PE und TVT nicht routinemäßig als Zusatztherapie eingesetzt werden sollte. Wie verhält es sich jedoch mit der Untergruppe von Patienten mit submassiver oder massiver PE, bei denen eine weitere PE katastrophale Folgen haben würde? In diesem Bereich fehlen klinische Daten.
Deshpande et al. berichteten über eine Serie von sechs Patienten mit massiver PE und kardiopulmonaler Instabilität; alle Patienten erhielten einen IVC-Filter mit Antikoagulation. Die Kurzzeitergebnisse waren ausgezeichnet, eine langfristige Nachbeobachtung wurde jedoch nicht durchgeführt.18 Kucher und Kollegen berichteten, dass im Rahmen der ICOPER-Studie 2006 bei 11 der 108 Patienten mit massiver Lungenembolie und einem systolischen arteriellen Druck unter 90 mm Hg ein IVC-Filter eingesetzt wurde. Keiner dieser 11 Patienten entwickelte innerhalb von 90 Tagen eine erneute Lungenembolie, und 10 von ihnen überlebten mindestens 90 Tage; die Platzierung eines IVC-Filters war mit einer Verringerung der 90-Tage-Mortalität verbunden. In dieser Studie wurde die Platzierung eines IVC-Filters vollständig von den Ärzten an verschiedenen Standorten entschieden.19 In einer Studie aus dem Jahr 2012, in der die Sterblichkeitsrate bei 3.770 Patienten mit akuter Lungenembolie untersucht wurde, die eine pulmonale Embolektomie erhielten, zeigten die Daten, dass sowohl bei instabilen als auch bei stabilen Patienten die Sterblichkeitsrate bei denjenigen niedriger war, die einen IVC-Filter erhielten.20
Obwohl die oben genannten Daten für die zusätzliche Platzierung eines IVC-Filters bei Patienten mit massiver Lungenembolie sprechen, zumindest was die kurzfristigen Ergebnisse betrifft, lassen sich aufgrund der geringen Größe und der fehlenden Randomisierung keine evidenzbasierten Leitlinien erstellen. Die CHEST-Leitlinien von 2016 weisen darauf hin, dass die Empfehlung, bei Patienten mit akuter PE, die antikoaguliert sind, keinen IVC-Filter einzusetzen, für diese spezielle Untergruppe von Patienten möglicherweise nicht gilt, da nicht sicher ist, ob die zusätzliche Platzierung eines IVC-Filters bei antikoagulierten Patienten von Vorteil ist.3
Bottom line
Es gibt keine evidenzbasierte Leitlinie darüber, ob IVC-Filter bei Patienten mit submassiver oder massiver PE zusätzlich eingesetzt werden sollten; auf der Grundlage eines Expertenkonsenses kann es jedoch angemessen sein, bei Patienten mit schwerer PE einen IVC-Filter als Ergänzung zur Antikoagulation einzusetzen. Die Entscheidung sollte individuell auf der Grundlage der Merkmale jedes einzelnen Patienten, seiner Präferenzen und der institutionellen Erfahrung getroffen werden.
In unserem Fall erhielt der Patient in der Hoffnung, eine weitere Embolie zu verhindern, am Tag nach der Vorstellung einen IVC-Filter. Trotz der eingeleiteten Antikoagulation mit Heparin blieb sie tachykard und tachypnoeisch, so dass sie zur CDT überwiesen wurde. Das Team der interventionellen Radiologie hielt sie angesichts ihrer anhaltenden vaginalen Blutungen und des weit verbreiteten metastasierten Uteruskarzinoms nicht für eine gute Kandidatin. Sie wurde auf therapeutisches Enoxaparin umgestellt, nachdem eine weitere invasive Intervention nicht für sinnvoll erachtet wurde. Ihr respiratorischer Status verbesserte sich nicht, und es wurde eine bilevel positive airway pressure eingeleitet. In Anbetracht des unheilbaren Charakters ihrer Krebserkrankung entschied sie sich schließlich für eine Komfortversorgung und starb kurz darauf.
Dankbarkeit
Die Autoren danken Benjamin A. Hohmuth, MD, A. Joseph Layon, MD, und Luis L. Nadal, MD, für ihre Durchsicht des Artikels und ihr wertvolles Feedback.
Dr. Wenqian Wang, Dr. Vedamurthy und Dr. Wang arbeiten in der Abteilung für Krankenhausmedizin am The Medicine Institute, Geisinger Health System, Danville, Penn. Kontaktieren Sie Dr. Wenqian Wang unter
Schlüsselpunkte
– Entscheiden Sie anhand der pulmonalen angiographischen Daten, der klinischen Stabilität und der Analyse anderer Begleiterkrankungen über die beste Behandlungsmethode.
– Unser Team bevorzugt die ultraschallgestützte Thrombolyse (EKOS) bei submassiver PE, massiver PE und als Rettungsverfahren für Patienten, bei denen die systemische Thrombolyse versagt.
– Die Einrichtung multidisziplinärer Teams, die sich aus interventionellen Radiologen, Intensivmedizinern, Kardiologen und Gefäßchirurgen zusammensetzen, ist sinnvoll, um individuelle Entscheidungen zu treffen.
– Es kann sinnvoll sein, bei Patienten mit schwerer PE einen IVC-Filter als Ergänzung zur Antikoagulation einzusetzen.
1. Jaff MR, McMurtry MS, Archer SL, et al. Management der massiven und submassiven Lungenembolie, iliofemoralen tiefen Venenthrombose und chronischen thromboembolischen pulmonalen Hypertonie: eine wissenschaftliche Stellungnahme der American Heart Association. Circulation. 2011;123:1788-1830.
2. Goldhaber SZ, Visani L, De Rosa M. Acute pulmonary embolism: clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER). Lancet. 1999;353:1386-9.
3. Kearon C, Akl EA, Ornelas J, et al. Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report. Chest. 2016;149:315-52.
4. Konstantinides S, Geibel A, Heusel G, Heinrich F, Kasper W. Management Strategies and Prognosis of Pulmonary Embolism-3 Trial Investigators. Heparin plus Alteplase im Vergleich zu Heparin allein bei Patienten mit submassiver Lungenembolie. N Engl J Med. 2002;347:1143-50.
5. Sharifi M, Bay C, Skrocki L, Rahimi F, Mehdipour M, „MOPETT“ Investigators. Moderate Lungenembolie mit Thrombolyse behandelt (aus der „MOPETT“-Studie). Am J Cardiol. 2013;111:273-7.
6. Meyer G, Vicaut E, Danays T, et al. Fibrinolysis for patients with intermediate-risk pulmonary embolism. N Engl J Med. 2014;370:1402-11.
7. Kuo WT. Endovaskuläre Therapie bei akuter Lungenembolie. J Vasc Interv Radiol 2012;23:167-79. e164
8. Kucher N, Boekstegers P, Muller OJ, et al. Randomized, controlled trial of ultrasound-assisted catheter-directed thrombolysis for acute intermediate-risk pulmonary embolism. Circulation. 2014;129:479-86.
9. Kuo WT, Banerjee A, Kim PS, et al. Pulmonary Embolism Response to Fragmentation, Embolectomy, and Catheter Thrombolysis (PERFECT): Erste Ergebnisse eines prospektiven multizentrischen Registers. Chest. 2015;148:667-73.
10. Piazza G, Hohlfelder B, Jaff MR, et al. A Prospective, Single-Arm, Multicenter Trial of Ultrasound-Facilitated, Catheter-Directed, Low-Dose Fibrinolysis for Acute Massive and Submassive Pulmonary Embolism: Die SEATTLE-II-Studie. JACC Cardiovasc Interv. 2015;8:1382-92.
11. Sharifi M. Systemic Full Dose, Half Dose, and Catheter Directed Thrombolysis for Pulmonary Embolism. When to Use and How to Choose? Curr Treat Options Cardiovasc Med. 2016;18:31.
12. Wang C, Zhai Z, Yang Y, et al. Efficacy and safety of low dose recombinant tissue-type plasminogen activator for the treatment of acute pulmonary thromboembolism: a randomized, multicenter, controlled trial. Chest. 2010;137:254-62.
13. Sharifi M, Vajo Z, Freeman W, Bay C, Sharifi M, Schwartz F. Transforming and simplifying the treatment of pulmonary embolism: „safe dose“ thrombolysis plus new oral anticoagulants. Lung. 2015;193:369-74.
14. Kabrhel C, Rosovsky R, Channick R, et al. A Multidisciplinary Pulmonary Embolism Response Team: Erste 30-monatige Erfahrungen mit einem neuartigen Ansatz für die Versorgung von Patienten mit submassiver und massiver Lungenembolie. Chest. 2016;150:384-93.
15. Lessne ML, Sing RF. Counterpoint: Überwiegen die Vorteile die Risiken für die meisten Patienten, bei denen ein inferiorer Vena-Cava-Filter in Betracht gezogen wird? No. Chest. 2016; 150(6):1182-4.
16. The PREPIC Study Group. Achtjährige Nachbeobachtung von Patienten mit permanenten Vena-Cava-Filtern zur Prävention von Lungenembolien: die randomisierte PREPIC-Studie (Prevention du Risque d’Embolie Pulmonaire par Interruption Cave). Circulation. 2005;112(3):416-22.
17. Mismetti P, Laporte S, Pellerin O, et al. Effect of a retrievable inferior vena cava filter plus anticoagulation vs. anticoagulation alone on risk of recurrent pulmonary embolism: a randomized clinical trial. JAMA. 2015. 313(16):1627-35.
18. Deshpande KS, Hatem C, Karwa M, et al. The use of inferior vena cava filter as a treatment modality for massive pulmonary embolism. Eine Fallserie und Übersicht über die Pathophysiologie. Respir Med. 2002.96(12):984-9.
19. Kucher N, Rossi E, De Rosa M, et al. Massive Pulmonalembolie. Circulation. 2006;113(4):577-82.
20. Stein P, Matta F. Case Fatality Rate with Pulmonary Embolectomy for Acute Pulmonary Embolism. Am J Med. 2012;125:471-7.