Cazul
O femeie de 49 de ani, obeză morbidă, s-a prezentat la urgență cu dificultăți de respirație și distensie abdominală. La prezentare, tensiunea arterială era de 100/60 mm Hg, cu o frecvență cardiacă de 110, o frecvență respiratorie de 24 și o saturație oximetrică a pulsului (SpO2) de 86% în aer ambiental. Troponina T era crescută la 0,3 ng/mL. Tomografia computerizată (CT) a toracelui cu contrast intravenos a arătat o embolie pulmonară (EP) în șa, cu dilatarea ventriculului drept (VD). CT abdomen/pelvis a evidențiat o masă uterină foarte mare cu limfadenopatie difuză.
A fost începută prompt perfuzia de heparină. Ecocardiograma a demonstrat o deformare a VD. Constatările la ecografia duplex a extremităților inferioare au fost în concordanță cu tromboza venoasă profundă (TVP) acută implicând vena femurală comună stângă și vena poplitee dreaptă. Biopsia unui ganglion limfatic supraclavicular a arătat un carcinom nediferențiat de grad înalt, cel mai probabil de origine uterină.
Întrebări clinice
Ce opțiuni terapeutice, dacă există, ar trebui luate în considerare în afara anticoagulării sistemice standard? Există un rol pentru:
1. Tromboliza sistemică?
2. Tromboliza dirijată prin cateter (CDT)?
3. Plasarea unui filtru de filtrare a venei cave inferioare (IVC)?
Care este managementul adecvat al EP „submasivă”?
În cazul EP masivă, în care trombul este localizat în vasculatura pulmonară centrală și este asociat cu hipotensiune datorată debitului cardiac diminuat, tromboliza sistemică, embolectomia și CDT sunt indicate ca măsuri care pot salva viața. Cu toate acestea, dovezile sunt mai puțin clare atunci când EP este de dimensiuni mari și a dus la o tensiune a VD, dar fără instabilitate hemodinamică evidentă. Aceasta este cunoscută în mod obișnuit ca o EP cu risc intermediar sau „submassivă”. EP submasivă pe baza ghidurilor Asociației Americane a Inimii (AHA) este:1
O EP acută fără hipotensiune sistemică (tensiune arterială sistolică mai mică de 90 mm Hg), dar cu disfuncție a VD sau necroză miocardică. Disfuncția VD este definită prin prezența a cel puțin unuia dintre următoarele:
– Dilatarea VD (diametrul apical cu 4 camere al VD împărțit la diametrul LV mai mare de 0.9) sau disfuncție sistolică a VD la ecocardiografie;
– Dilatarea VD la CT, creșterea BNP (mai mare de 90 pg/mL), creșterea N-terminal pro-BNP (mai mare de 500 pg/mL);
– Modificări electrocardiografice (nou bloc de ramură dreaptă complet sau incomplet, supradenivelare sau depresie ST anteroseptală sau inversiune anteroseptală a undei T).
Necroza miocardică este definită ca fiind o troponină I crescută (mai mare de 0,4 ng/mL) sau troponină T crescută (mai mare de 0,1 ng/mL).
De ce are semnificație clinică EP submasivă?
În 1999, analiza International Cooperative Pulmonary Embolism Registry (ICOPER) a arătat că disfuncția VD la pacienții cu EP a fost asociată cu o aproape dublare a riscului de mortalitate la 3 luni (hazard ratio 2,0, 1,3-2,9).2 Având în vedere acest risc crescut, s-ar putea trage concluzia logică că trebuie să tratăm EP submasivă mai agresiv decât EP fără tensiune a VD. Dar acest lucru va duce neapărat la un rezultat mai bun pentru pacient, având în vedere riscul de 3% de hemoragie intracraniană asociat cu terapia trombolitică?
În scenariul clinic de mai sus, pacientul a îndeplinit definiția de EP submasivă. Deși pacienta nu a prezentat hipotensiune arterială sistemică, ea a prezentat dilatare a VD la CT, disfuncție sistolică a VD la ecocardiografie, precum și un nivel ridicat al Troponinei T. În plus față de începerea tratamentului anticoagulant, ce ar mai trebui făcut pentru a crește probabilitatea ca ea să aibă un rezultat bun?
AHA recomandă ca tromboliza sistemică și CDT să fie luate în considerare pentru pacienții cu EP submasivă acută dacă au dovezi clinice de prognostic advers, inclusiv înrăutățirea insuficienței respiratorii, disfuncție severă a VD sau necroză miocardică majoră și risc scăzut de complicații hemoragice (clasa IIB; nivel de evidență C).1
Actualizarea din 2016 a ghidurilor Colegiului American al Medicilor de Piept (CHEST)3 recomandă terapia trombolitică administrată pe cale sistemică în locul lipsei de terapie la pacienții selectați cu EP acută care se deteriorează după începerea tratamentului anticoagulant, dar care nu au dezvoltat încă hipotensiune arterială și care prezintă un risc scăzut de sângerare (recomandare de gradul 2C).
Tromboliza sistemică
Tromboliza sistemică se administrează sub forma unei perfuzii trombolitice intravenoase administrate pe o perioadă de timp. Medicamentele trombolitice aprobate de Food and Drug Administration includ în prezent activatorul tisular de plasminogen (tPA)/alteplază, streptokinaza și urokinaza.
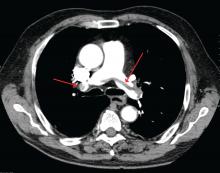 James Heilman, MD (folosit sub licență Creative Commons)
James Heilman, MD (folosit sub licență Creative Commons)
O embolie pulmonară mare la bifurcația arterei pulmonare (embolie în șa).
În cadrul studiului randomizat, dublu-orb Pulmonary Embolism-3 Trial-3 din 2002,4 Konstantinides și colegii săi au comparat heparina plus tPA față de heparina plus placebo la 256 de pacienți cu EP submasivă. Criteriul clinic primar de evaluare a decesului sau a escaladării îngrijirii în spital a fost de 11,0 % în grupul tPA față de 24,6 % în grupul placebo (P = 0,006); diferența a fost determinată în mare parte de escaladarea îngrijirii, definită ca fiind utilizarea de vasopresoare, tromboliză de salvare, ventilație mecanică, stop cardiac și necesitatea unei embolectomii chirurgicale. Poate surprinzător, nu au existat cazuri de accident vascular cerebral hemoragic în niciunul dintre aceste grupuri. Studiul a demonstrat că tromboliza sistemică în EP submasivă a fost asociată cu un risc mai mic de deces și de escaladare a tratamentului.
Eficacitatea trombolizei în doze mici a fost studiată în cadrul MOPETT 2013,5 un studiu monocentric, prospectiv, randomizat, cu etichetă deschisă, în care 126 de participanți la care s-a constatat că prezentau EP submasivă pe baza simptomelor și a datelor angiografice CT sau a datelor scanării de ventilație/perfuzie au primit fie 50 mg tPA plus heparină, fie anticoagulare cu heparină singură. Criteriul final compus de hipertensiune pulmonară și EP recurentă la 28 de luni a fost de 16% în grupul tPA comparativ cu 63% în grupul de control (P mai mic de 0,001). Tromboliza sistemică a fost asociată cu un risc mai mic de hipertensiune pulmonară și EP recurentă, deși nu s-a observat niciun beneficiu în ceea ce privește mortalitatea în acest studiu de mici dimensiuni.
În studiul randomizat, dublu-orb PEITHO (n = 1.006) din 20146 care a comparat tenecteplază plus heparină față de heparină la pacienții cu EP submasivă, rezultatele primare de deces și decompensare hemodinamică au apărut la 2,6% din grupul cu tenecteplază, comparativ cu 5,6% în grupul placebo (P = 0,02). Terapia trombolitică a fost asociată cu o rată de 2% de accidente vasculare cerebrale hemoragice, în timp ce accidentul vascular cerebral hemoragic în grupul placebo a fost de 0,2% (P = 0,03). În acest caz, tromboliza sistemică a fost asociată cu un risc cu 3% mai mic de deces și instabilitate hemodinamică, dar și cu un risc crescut de 1,8% de accident vascular cerebral hemoragic.
Tromboliza dirijată prin cateter (CDT)
CDT a fost inițial dezvoltată pentru tratarea trombozelor arteriale, a grefelor de dializă și a trombozelor venoase profunde, dar în prezent este aprobată de FDA pentru tratamentul EP acută submasivă sau masivă.
Se trece un fir prin embolie și se plasează un cateter de perfuzie cu mai multe orificii, prin care se perfuzează un medicament trombolitic timp de 12-24 de ore. Se consideră că administrarea directă a medicamentului în trombus este la fel de eficientă ca și terapia sistemică, dar cu un risc mai mic de sângerare. În cazul în care este indicată îndepărtarea mai rapidă a trombului din cauza încărcăturii mari a cheagului și a instabilității hemodinamice, terapiile mecanice, cum ar fi fragmentarea și aspirarea, pot fi utilizate ca adjuvant la CDT. Cu toate acestea, aceste tehnici mecanice comportă riscul de lezare a arterei pulmonare și, prin urmare, ar trebui utilizate doar în ultimă instanță. Un fir emițător de ultrasunete poate fi adăugat la cateterul de perfuzie cu mai multe orificii pentru a accelera tromboliza prin întreruperea cu ultrasunete a trombului, o tehnică cunoscută sub numele de tromboliză îmbunătățită cu ultrasunete (EKOS).7,10
Studiul ULTIMA 20148 , un studiu de mici dimensiuni, randomizat, deschis, cu etichetă deschisă, al trombolizei dirijate prin cateter asistată cu ultrasunete (USAT, termenul poate fi utilizat în mod interschimbabil cu EKOS) față de anticoagularea cu heparină singură la 59 de pacienți, a fost conceput pentru a studia dacă prima strategie a fost mai bună în ceea ce privește îmbunătățirea măsurii primare de rezultat a raportului RV/LV la pacienții cu EP submasivă. Reducerea medie a raportului VD/VL a fost de 0,30 +/- 0,20 în grupul USAT comparativ cu 0,03 +/- 0,16 în grupul cu heparină (P mai mic de 0,001). Cu toate acestea, nu a fost observată nicio diferență semnificativă în ceea ce privește mortalitatea sau sângerarea în cadrul grupurilor la urmărirea la 90 de zile.
Etalonul PERFECT 2015,9 un studiu multicentric bazat pe un registru, a înrolat prospectiv 101 pacienți care au primit CDT ca terapie de primă linie pentru EP masivă și submasivă. În rândul pacienților cu EP submasivă, s-a constatat că 97,3 % au avut „succes clinic” cu acest tratament, definit ca stabilizare a hemodinamicii, ameliorare a hipertensiunii pulmonare și a tensiunii cardiace drepte și supraviețuire până la externarea din spital. Nu a existat nicio sângerare majoră sau hemoragie intracraniană. Analizele subgrupurilor din acest studiu care compară USAT cu CDT standard nu au evidențiat diferențe semnificative în ceea ce privește modificările medii ale presiunii pulmonare, dozele medii de trombolitic sau timpii medii de perfuzie.
Un studiu prospectiv multicentric cu un singur braț, SEATTLE II 2015,10 a evaluat eficacitatea EKOS pe un eșantion de 159 de pacienți. Pacienții cu EP masivă și submassivă au primit aproximativ 24 mg de tPA perfuzat prin intermediul unui cateter pe parcursul a 12-24 de ore. Rezultatul primar al eficacității a fost scăderea raportului RV/LV măsurat prin CT toracic față de valoarea inițială comparativ cu 48 de ore după procedură. Raportul înainte și după procedură a fost de 1,55 față de 1,13, respectiv (P mai mic de 0,001), ceea ce indică faptul că EKOS a redus dilatarea VD. Nu a fost observată nicio hemoragie intracraniană, iar anchetatorii nu au comentat rezultatele pe termen lung, cum ar fi mortalitatea sau calitatea vieții. Studiul a fost limitat de lipsa unui grup de comparație, cum ar fi anticoagularea cu heparină ca monoterapie, sau tromboliza sistemică sau CDT standard.
Tratamentul EP submasivă variază între diferite instituții. Pur și simplu nu există date adecvate care să compare tromboliza sistemică în doze mici, CDT, EKOS și anticoagularea cu heparină standard pentru a face recomandări ferme. Unii cercetători consideră că tromboliza sistemică cu doză mică este probabil la fel de bună ca și terapiile trombolitice costisitoare bazate pe cateter.11,12 Terapia trombolitice cu doză mică poate fi urmată de utilizarea inhibitorilor direcți ai factorului Xa pe cale orală pentru menținerea activității antitrombotice.13
Bottom line
În instituția noastră, echipa de radiologie intervențională depistează de la caz la caz pacienții care îndeplinesc criteriile pentru EP submasivă. Utilizăm datele angiografice pulmonare (natura și extinderea trombului), stabilitatea clinică și analiza altor afecțiuni comorbide pentru a decide cea mai bună modalitate de tratament pentru un pacient individual. Echipa noastră preferă EKOS pentru pacienții cu EP submasivă, precum și pentru pacienții cu EP masivă și ca procedură de salvare pentru pacienții la care a eșuat tromboliza sistemică.
Până când vor fi disponibile mai multe date care să susțină orientări ferme, considerăm că stabilirea unor echipe multidisciplinare compuse din radiologi intervenționiști, intensiviști, cardiologi și chirurgi vasculari este prudentă pentru a lua decizii individualizate și pentru a obține cele mai bune rezultate pentru pacienții noștri.14
Filtrul CIV
Din moment ce pacienta din acest caz are deja o EP submasivă, poate tolera o încărcătură suplimentară de cheaguri în cazul în care TVP rămasă embolizează din nou? Există un rol pentru filtrul IVC?
Implantarea filtrelor IVC a crescut semnificativ în ultimii 30 de ani, fără dovezi de calitate care să justifice utilizarea lor.15
The 2016 Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report afirmă în mod clar: La pacienții cu TVP acută a gambei sau EP care sunt tratați cu anticoagulante, nu se recomandă utilizarea unui filtru IVC (gradul 1B).3 Această recomandare se bazează pe concluziile studiului randomizat Prevention du Risque du Risque d’Embolie Pulmonaire par Interruption Cave (PREPIC),16 și ale studiului randomizat PREPIC 2 publicat recent,17 ambele demonstrând că, la pacienții anticoagulați cu EP și TVP, plasarea concomitentă a unui filtru IVC timp de 3 luni nu a redus EP recurentă, inclusiv EP fatală.
Legile directoare CHEST afirmă că un filtru IVC nu trebuie plasat în mod obișnuit ca adjuvant la pacienții cu EP și TVP. Cu toate acestea, ce se întâmplă în subgrupul de pacienți cu EP submasivă sau masivă, la care o altă EP ar fi catastrofală? Datele clinice lipsesc în acest domeniu.
Deshpande et al. au raportat o serie de șase pacienți cu EP masivă și instabilitate cardiopulmonară; toți pacienții au primit un filtru IVC cu anticoagulare. Rezultatul pe termen scurt a fost excelent, dar nu s-a făcut o urmărire pe termen lung.18 Kucher și colaboratorii au raportat că, din ICOPER în 2006, din cei 108 pacienți cu EP masivă cu presiune arterială sistolică sub 90 mm Hg, 11 pacienți au primit plasarea adjuvantă a unui filtru IVC. Niciunul dintre acești 11 pacienți nu a dezvoltat EP recurentă în 90 de zile și 10 dintre ei au supraviețuit cel puțin 90 de zile; plasarea filtrului IVC a fost asociată cu o reducere a mortalității la 90 de zile. În acest studiu, plasarea unui filtru IVC a fost decisă în întregime de medicii din diferite locații.19 Într-un studiu din 2012 care a examinat ratele de fatalitate la 3 770 de pacienți cu EP acută care au primit embolectomie pulmonară, datele au arătat că, atât la pacienții instabili, cât și la cei stabili, ratele de fatalitate au fost mai mici la cei care au primit un filtru IVC.20
Deși datele de mai sus sunt favorabile pentru plasarea adjuvantă a filtrului IVC la pacienții cu EP masivă, cel puțin în ceea ce privește rezultatele pe termen scurt, dimensiunea mică și lipsa de randomizare împiedică stabilirea unor orientări bazate pe dovezi. Liniile directoare CHEST din 2016 subliniază faptul că, întrucât nu se știe cu certitudine dacă este benefică plasarea unui filtru IVC în mod adjuvant la pacienții anticoagulați cu EP severă, în acest subgrup specific de pacienți, este posibil ca recomandarea împotriva inserției unui filtru IVC la pacienții cu EP acută care sunt anticoagulați să nu se aplice3.
Bottom line
Nu există un ghid bazat pe dovezi care să stabilească dacă filtrele IVC ar trebui să fie plasate în mod adjuvant la pacienții cu EP submasivă sau masivă; cu toate acestea, pe baza consensului experților, poate fi adecvată plasarea unui filtru IVC ca adjuvant la anticoagulare la pacienții cu EP severă. Decizia ar trebui să fie individualizată pe baza caracteristicilor fiecărui pacient, a preferințelor și a expertizei instituționale.
În cazul nostru, în speranța de a preveni o sarcină embolică suplimentară, pacientul a primit un filtru IVC în ziua următoare prezentării. În ciuda inițierii anticoagulării cu heparină, ea a rămas tahicardică și tahipneică, ceea ce a determinat trimiterea pentru CDT. Echipa de radiologie intervențională nu a considerat că era un candidat bun, având în vedere sângerarea vaginală persistentă și carcinomul uterin metastatic extins. Ea a fost trecută la enoxaparină terapeutică după ce nu s-a considerat oportună nicio altă intervenție invazivă. Starea ei respiratorie nu s-a îmbunătățit și a fost inițiată presiunea pozitivă bilaterală a căilor respiratorii. Luând în considerare natura terminală a cancerului ei, ea a ales în cele din urmă să urmeze îngrijirea de confort și a murit la scurt timp după aceea.
Recunoștințe
Autorii ar dori să mulțumească lui Benjamin A. Hohmuth, MD, A. Joseph Layon, MD, și Luis L. Nadal, MD, pentru revizuirea articolului și feedback-ul neprețuit.
Dr. Wenqian Wang, Dr. Vedamurthy și Dr. Wang lucrează în departamentul de medicină spitalicească de la The Medicine Institute, Geisinger Health System, Danville, Penn. Contactați-l pe Dr. Wenqian Wang la .
Puncte cheie
– Utilizați datele angiografice pulmonare, stabilitatea clinică și analiza altor afecțiuni comorbide pentru a decide cea mai bună modalitate de tratament.
– Echipa noastră preferă tromboliza îmbunătățită cu ultrasunete (EKOS) pentru pacienții cu EP submasivă, pacienții cu EP masivă și ca procedură de salvare pentru pacienții care nu reușesc tromboliza sistemică.
– Înființarea unor echipe multidisciplinare compuse din radiologi intervenționiști, intensiviști, cardiologi și chirurgi vasculari este prudentă pentru a lua decizii individualizate.
– Poate fi adecvată plasarea unui filtru IVC ca adjuvant la anticoagulare la pacienții cu EP severă.
1. Jaff MR, McMurtry MS, Archer SL, et al. Managementul emboliei pulmonare masive și submassive, al trombozei venoase profunde iliofemurale și al hipertensiunii pulmonare tromboembolice cronice: o declarație științifică a Asociației Americane a Inimii. Circulation. 2011;123:1788-1830.
2. Goldhaber SZ, Visani L, De Rosa M. Embolia pulmonară acută: rezultate clinice în Registrul Internațional Cooperativ de Embolie Pulmonară (ICOPER). Lancet. 1999;353:1386-9.
3. Kearon C, Akl EA, Ornelas J, et al. Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report. Chest. 2016;149:315-52.
4. Konstantinides S, Geibel A, Heusel G, Heinrich F, Kasper W. Management Strategies and Prognosis of Pulmonary Embolism-3 Trial Investigators. Heparină plus alteplază comparativ cu heparina singură la pacienții cu embolie pulmonară submassivă. N Engl J Med. 2002;347:1143-50.
5. Sharifi M, Bay C, Skrocki L, Rahimi F, Mehdipour M, „MOPETT” Investigators. Embolia pulmonară moderată tratată cu tromboliză (din studiul „MOPETT”). Am J Cardiol. 2013;111:273-7.
6. Meyer G, Vicaut E, Danays T, et al. Fibrinoliza pentru pacienții cu embolie pulmonară cu risc intermediar. N Engl J Med. 2014;370:1402-11.
7. Kuo WT. Terapia endovasculară pentru embolia pulmonară acută. J Vasc Interv Radiol 2012;23:167-79. e164
8. Kucher N, Boekstegers P, Muller OJ, et al. Randomized, controlled trial of ultrasound-assisted catheter-directed thrombolysis for acute intermediate-risk pulmonary embolism. Circulation. 2014;129:479-86.
9. Kuo WT, Banerjee A, Kim PS, et al. Pulmonary Embolism Response to Fragmentation, Embolectomy, and Catheter Thrombolysis (PERFECT): Rezultatele inițiale ale unui registru prospectiv multicentric. Chest. 2015;148:667-73.
10. Piazza G, Hohlfelder B, Jaff MR, et al. A Prospective, Single-Arm, Multicenter Trial of Ultrasound-Facilitated, Catheter-Directed, Low-Dose Fibrinolysis for Acute Massive and Submassive Pulmonary Embolism: Studiul SEATTLE II. JACC Cardiovasc Interv. 2015;8:1382-92.
11. Sharifi M. Systemic Full Dose, Half Dose, and Catheter Directed Thrombolysis for Pulmonary Embolism. Când se utilizează și cum se alege? Curr Treat Options Cardiovasc Med. 2016;18:31.
12. Wang C, Zhai Z, Yang Y, et al. Eficacitatea și siguranța dozei mici de activator de plasminogen tisular recombinant de tip tisular pentru tratamentul tromboembolismului pulmonar acut: un studiu randomizat, multicentric, controlat. Chest. 2010;137:254-62.
13. Sharifi M, Vajo Z, Freeman W, Bay C, Sharifi M, Schwartz F. Transformarea și simplificarea tratamentului emboliei pulmonare: tromboliza în „doză sigură” plus noi anticoagulante orale. Lung. 2015;193:369-74.
14. Kabrhel C, Rosovsky R, Channick R, et al. A Multidisciplinary Pulmonary Embolism Response Team: Initial 30-Month Experience With a Novel Approach to Delivery of Care to Patients With Submassive and Massive Pulmonary Embolism. Chest. 2016;150:384-93.
15. Lessne ML, Sing RF. Counterpoint: Do the Benefits Outweigh the Risks for Most Patients Under Consideration for inferior vena cava filters? No. Chest. 2016; 150(6):1182-4.
16. Grupul de studiu PREPIC. Urmărirea timp de opt ani a pacienților cu filtre permanente pentru vena cavă în prevenirea emboliei pulmonare: studiul randomizat PREPIC (Prevention du Risque d’Embolie Pulmonaire par Interruption Cave). Circulation. 2005;112(3):416-22.
17. Mismetti P, Laporte S, Pellerin O, et al. Efectul unui filtru recuperabil pentru vena cavă inferioară plus anticoagulare vs. anticoagulare singură asupra riscului de embolie pulmonară recurentă: un studiu clinic randomizat. JAMA. 2015. 313(16):1627-35.
18. Deshpande KS, Hatem C, Karwa M, et al. The use of inferior vena cava filter as a treatment modality for massive pulmonary embolism. O serie de cazuri și o revizuire a fiziopatologiei. Respir Med. 2002.96(12):984-9.
19. Kucher N, Rossi E, De Rosa M, et al. Embolia pulmonară masivă. Circulation. 2006;113(4):577-82.
20. Stein P, Matta F. Rata de fatalitate a cazurilor cu embolectomie pulmonară pentru embolia pulmonară acută. Am J Med. 2012;125:471-7.