O caso
Uma mulher morbidamente obesa de 49 anos de idade apresentada ao serviço de emergência com falta de ar e distensão abdominal. Na apresentação, sua pressão arterial era de 100/60 mm Hg com freqüência cardíaca de 110, freqüência respiratória de 24 e saturação oximétrica de pulso (SpO2) de 86% no ar ambiente. A troponina T foi elevada a 0,3 ng/mL. A tomografia computadorizada (TC) de tórax com contraste intravenoso mostrou embolia pulmonar (EP) de sela com dilatação do ventrículo direito (VD). A TC abdome/pelvis revelou uma massa uterina muito grande com linfadenopatia difusa.
A infusão de heparina foi iniciada prontamente. O ecocardiograma demonstrou tensão do VD. Os achados no ultra-som duplex das extremidades inferiores foram consistentes com tromboses venosas profundas agudas (TVP) envolvendo a veia femoral comum esquerda e a veia poplítea direita. A biópsia de um linfonodo supraclavicular mostrou carcinoma indiferenciado de alto grau muito provavelmente de origem uterina.
Perguntas clínicas
O que, se houver, opções terapêuticas devem ser consideradas além da anticoagulação sistêmica padrão? Existe um papel para:
1. Trombólise sistêmica?
2. trombólise catéter-direcionada (CDT)?
3. colocação de filtro de veia cava inferior (IVC)?
Qual é o manejo apropriado da PE “submassiva”?
No caso da EP maciça, onde o trombo está localizado na vasculatura pulmonar central e associado à hipotensão devido a comprometimento do débito cardíaco, trombólise sistêmica, embolectomia e TCD são indicados como medidas potencialmente salvadoras de vida. Entretanto, a evidência é menos clara quando a EP é grande e tem levado a uma tensão do VD, mas sem instabilidade hemodinâmica aparente. Isso é comumente conhecido como um risco intermediário ou PE “submassivo”. A EP submassiva baseada nas diretrizes da American Heart Association (AHA) é:1
Uma EP aguda sem hipotensão sistêmica (pressão arterial sistólica inferior a 90 mm Hg), mas com disfunção do VD ou necrose miocárdica. A disfunção do VD é definida pela presença de pelo menos um destes:
– Dilatação do VD (diâmetro apical do VD de 4 câmaras dividido pelo diâmetro do VE maior que 0.9) ou disfunção sistólica do VD na ecocardiografia;
– Dilatação do VD na TC, elevação do BNP (maior que 90 pg/mL), elevação do N-terminal pro-BNP (maior que 500 pg/mL);
– Alterações eletrocardiográficas (novo bloco de ramo direito completo ou incompleto, elevação ou depressão do ST ântero-septal ou inversão da onda T ântero-septal).
Necrose miocárdica é definida como troponina I elevada (maior que 0,4 ng/mL) ou troponina T elevada (maior que 0,1 ng/mL).
Por que o PE submassivo tem significado clínico?
Em 1999, a análise do International Cooperative Pulmonary Embolism Registry (ICOPER) revelou que a disfunção do VD em pacientes com EP estava associada a uma quase duplicação do risco de mortalidade de 3 meses (razão de risco 2,0, 1,3-2,9).2 Dado esse aumento do risco, pode-se tirar a conclusão lógica de que precisamos tratar a EP submassiva de forma mais agressiva do que a EP sem a tensão do VD. Mas isso necessariamente resultará em um melhor resultado para o paciente dado o risco de 3% de hemorragia intracraniana associada à terapia trombolítica?
No cenário clínico acima, o paciente cumpriu a definição de EP submassiva. Enquanto a paciente não apresentou hipotensão sistêmica, ela apresentou dilatação do VD na TC, disfunção sistólica do VD na ecografia, bem como um nível elevado de Troponina T. Além de iniciar terapia anticoagulante, o que mais deve ser feito para aumentar sua probabilidade de um bom resultado?
A AHA recomenda que a trombólise sistêmica e o TCD sejam considerados para pacientes com EP submassiva aguda se eles tiverem evidências clínicas de prognóstico adverso, incluindo piora da insuficiência respiratória, disfunção grave do VD, ou necrose miocárdica grave e baixo risco de complicações hemorrágicas (Classe IIB; Nível de Evidência C).1
A atualização das diretrizes do American College of Chest Physicians (CHEST) de 20163 recomenda a terapia trombolítica administrada sistemicamente sobre nenhuma terapia em pacientes selecionados com EP aguda que se deterioram após iniciar a terapia anticoagulante, mas que ainda não desenvolveram hipotensão e que têm baixo risco de sangramento (recomendação Grau 2C).
Trombólise sistêmica
Trombólise sistêmica é administrada como uma infusão trombolítica intravenosa administrada durante um período de tempo. As drogas trombolíticas aprovadas pela Food and Drug Administration incluem atualmente o ativador do plasminogênio tecidual (tPA)/alteplase, estreptoquinase e uroquinase.
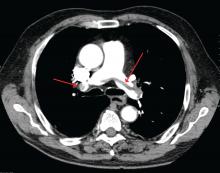 James Heilman, MD (usado sob licença Creative Commons)
James Heilman, MD (usado sob licença Creative Commons)
Uma grande embolia pulmonar na bifurcação da artéria pulmonar (embolia de sela).
No ensaio randomizado de 2002, embolia pulmonar duplo-cego-3,4 Konstantinides e colegas compararam heparina mais tPA versus heparina mais placebo em 256 pacientes com EP submassiva. O desfecho clínico primário do óbito ou da escalada dos cuidados intra-hospitalares foi 11,0% no grupo com ATP versus 24,6% no grupo com placebo (P = 0,006); a diferença foi impulsionada em grande parte pela escalada dos cuidados, definida como o uso de vasopressores, trombólise de resgate, ventilação mecânica, parada cardíaca e necessidade de embolectomia cirúrgica. Talvez surpreendentemente, não houve casos de acidente vascular cerebral hemorrágico em nenhum desses grupos. O estudo demonstrou que a trombólise sistêmica na EP submassiva estava associada a um menor risco de morte e escalada do tratamento.
Eficácia da trombólise de baixa dose foi estudada no MOPETT 2013,5 um estudo monocêntrico, prospectivo, randomizado e aberto, no qual 126 participantes encontraram ter EP submassiva baseada em sintomas e dados de tomografia computadorizada angiográfica ou de ventilação/perfusão receberam 50 mg de TPA mais heparina ou anticoagulação de heparina sozinhos. O desfecho composto de hipertensão pulmonar e EP recorrente aos 28 meses foi de 16% no grupo com ATP, comparado com 63% no grupo controle (P menor que 0,001). A trombólise sistêmica foi associada a menor risco de hipertensão pulmonar e EP recorrente, embora não tenha sido observado benefício de mortalidade neste pequeno estudo.
No ensaio PEITHO randomizado e duplo-cego (n = 1.006) de 20146 comparando tenecteplase mais heparina versus heparina em pacientes com EP submassiva, os desfechos primários de morte e descompensação hemodinâmica ocorreram em 2,6% do grupo tenecteplase, comparado a 5,6% no grupo placebo (P = 0,02). A terapia trombolítica foi associada a 2% de AVC hemorrágico, enquanto que o AVC hemorrágico no grupo placebo foi de 0,2% (P = 0,03). Neste caso, a trombólise sistêmica foi associada a um risco 3% menor de morte e instabilidade hemodinâmica, mas também a um risco 1,8% maior de acidente vascular cerebral hemorrágico.
Tranbólise dirigida por cateter (TCD)
TCD foi originalmente desenvolvido para tratar tromboses arteriais, de diálise e veias profundas, mas agora é aprovado pelo FDA para o tratamento de EP submassiva ou maciça aguda.
Um fio é passado através da embolia e um cateter de infusão multiperfurado é colocado, através do qual um fármaco trombolítico é infundido durante 12-24 horas. Pensa-se que a entrega directa do medicamento no trombo é tão eficaz como a terapia sistémica, mas com um menor risco de hemorragia. Se a remoção mais rápida do trombo for indicada devido à grande carga de coágulo e instabilidade hemodinâmica, podem ser usadas terapias mecânicas, como fragmentação e aspiração, como coadjuvante do CDT. Entretanto, estas técnicas mecânicas acarretam o risco de lesão da artéria pulmonar e, portanto, só devem ser utilizadas como último recurso. Um fio emissor de ultra-som pode ser adicionado ao cateter de infusão multiperfurado para agilizar a trombólise por ultra-som, uma técnica conhecida como trombólise com ultra-som (EKOS).7,10
O ensaio ULTIMA 2014,8 um pequeno estudo randomizado e aberto de trombólise com cateter ultra-som (USAT, o termo pode ser usado intercambialmente com EKOS) versus anticoagulação de heparina sozinha em 59 pacientes, foi projetado para estudar se a estratégia anterior era melhor para melhorar a medida do desfecho primário da relação VD/VE em pacientes com EP submassiva. A redução média da razão VD/VE foi de 0,30 +/- 0,20 no grupo USAT em comparação com 0,03 +/- 0,16 no grupo heparina (P menor que 0,001). Entretanto, não foi observada diferença significativa na mortalidade ou sangramento nos grupos com seguimento de 90 dias.
O ensaio PERFECT 2015,9 um estudo multicêntrico baseado em registro, inscreveu prospectivamente 101 pacientes que receberam TCD como terapia de primeira linha para EP massiva e submassiva. Entre os pacientes com EP submassiva, 97,3% tiveram “sucesso clínico” com este tratamento, definido como estabilização da hemodinâmica, melhora da hipertensão pulmonar e tensão arterial direita, e sobrevida à alta hospitalar. Não houve sangramento importante ou hemorragia intracraniana. As análises dos subgrupos deste estudo comparando o USAT com o CDT padrão não revelaram diferença significativa nas alterações médias de pressão pulmonar, doses trombolíticas médias ou tempos médios de infusão.
Um ensaio prospectivo multicêntrico de um único braço, o SEATTLE II 2015,10 avaliou a eficácia do EKOS em uma amostra de 159 pacientes. Pacientes com PE maciço e submassivo receberam aproximadamente 24 mg de tPA infundidos através de um cateter durante 12-24 horas. O resultado primário da eficácia foi a diminuição da relação VD/VE medida pela tomografia computadorizada do tórax em relação à linha de base, em comparação às 48 horas após o procedimento. A relação pré e pós-procedimento foi de 1,55 versus 1,13 respectivamente (P menor que 0,001), indicando que o EKOS diminuiu a dilatação do VD. Não foi observada hemorragia intracraniana e os investigadores não comentaram os resultados a longo prazo, como mortalidade ou qualidade de vida. O estudo foi limitado pela falta de um grupo de comparação, como anticoagulação com heparina como monoterapia, ou trombólise sistêmica ou CDT padrão.
O tratamento da EP submassiva varia entre as diferentes instituições. Simplesmente não existem dados adequados comparando trombólise sistêmica em baixa dose, TCD, EKOS e anticoagulação da heparina padrão para fazer recomendações firmes. Alguns investigadores sentem que a trombólise sistêmica de baixa dose é provavelmente tão boa quanto as caras terapias trombolíticas baseadas em cateteres.11,12 A terapia trombolítica de baixa dose pode ser seguida pelo uso de inibidores de fator Xa diretos orais para manutenção da atividade antitrombótica.13
Bottom line
Em nossa instituição, a equipe de radiologia intervencionista seleciona, caso a caso, os pacientes que atendem aos critérios para EP submassiva. Utilizamos dados angiográficos pulmonares (natureza e extensão do trombo), estabilidade clínica e análise de outras condições comorbitárias para decidir a melhor modalidade de tratamento para um paciente individual. Nossa equipe prefere o EKOS para pacientes com EP submassiva, assim como para pacientes com EP massiva e como procedimento de resgate para pacientes que falharam na trombólise sistêmica.
Até que mais dados estejam disponíveis para apoiar diretrizes firmes, sentimos que o estabelecimento de equipes multidisciplinares compostas por radiologistas intervencionistas, intensivistas, cardiologistas e cirurgiões vasculares é prudente para tomar decisões individualizadas e para alcançar os melhores resultados para nossos pacientes.14
Filtro IVC
Posto que a paciente neste caso já tem uma EP submassiva, ela pode tolerar carga adicional de coágulo se a TVP remanescente embolizar novamente? Há algum papel para o filtro IVC?
A implantação de filtros IVC tem aumentado significativamente nos últimos 30 anos, sem evidências de qualidade que justifiquem seu uso.15
A Terapia Antitrombótica 2016 para a Doença dos TEV: A Diretriz do TESTE e o Relatório do Painel de Especialistas afirmam claramente: Em pacientes com TVP aguda da perna ou EP que são tratados com anticoagulantes, não é recomendado o uso de um filtro IVC (Grau 1B).Esta recomendação é baseada nos achados do estudo randomizado Prevention du Risque d’Embolie Pulmonaire par Interruption Cave (PREPIC),16 e do recentemente publicado estudo randomizado PREPIC 2,17 ambos mostrando que em pacientes anticoagulados com EP e TVP, a colocação simultânea de um filtro de VCI por 3 meses não reduziu a EP recorrente, incluindo a EP fatal.
As diretrizes do CHEST afirmam que um filtro de VCI não deve ser colocado rotineiramente como coadjuvante em pacientes com EP e TVP. Entretanto, e no subgrupo de pacientes com EP submassiva ou maciça, em que outra EP seria catastrófica? Faltam dados clínicos nesta área.
Deshpande et al. relataram uma série de seis pacientes com EP massiva e instabilidade cardiopulmonar; todos os pacientes receberam um filtro de VCI com anticoagulação. O resultado a curto prazo foi excelente, mas o acompanhamento a longo prazo não foi feito.18 Kucher e colegas relataram que do ICOPER em 2006, dos 108 pacientes com EP maciça com pressão arterial sistólica abaixo de 90 mm Hg, 11 pacientes receberam colocação de filtro adjunto de CIV. Nenhum desses 11 pacientes desenvolveu EP recorrente em 90 dias e 10 deles sobreviveram pelo menos 90 dias; a colocação do filtro de VCI foi associada a uma redução na mortalidade em 90 dias. Neste estudo, a colocação de um filtro de VCI foi inteiramente decidida pelos médicos em diferentes locais.19 Em um estudo de 2012, examinando as taxas de mortalidade em 3.770 pacientes com EP aguda que receberam embolectomia pulmonar, os dados mostraram que, tanto em pacientes instáveis quanto estáveis, as taxas de mortalidade foram menores naqueles que receberam um filtro de VCI.20
Embora os dados acima sejam favoráveis para a colocação do filtro adjunto de CIV em pacientes com EP maciça, pelo menos em resultados de curto prazo, o pequeno tamanho e a falta de randomização impedem o estabelecimento de diretrizes baseadas em evidências. As diretrizes do CHEST de 2016 apontam que, como não é certo se há benefício em colocar um filtro de VCI adjunto em pacientes anticoagulados com EP grave, neste subgrupo específico de pacientes, a recomendação contra a inserção de um filtro de VCI em pacientes com EP aguda que são anticoagulados pode não se aplicar.3
Bottom line
Não há nenhuma diretriz baseada em evidências sobre se os filtros de VCI devem ser colocados adjuvantes em pacientes com EP submassiva ou maciça; entretanto, com base no consenso de especialistas, pode ser apropriado colocar um filtro de VCI como adjunto da anticoagulação em pacientes com EP grave. A decisão deve ser individualizada com base nas características, preferências e experiência institucional de cada paciente.
No nosso caso, na esperança de evitar maior carga embólica, o paciente recebeu um filtro de VCI no dia seguinte à apresentação. Apesar do início da anticoagulação com heparina, ela permaneceu taquicárdica e taquipneica, o que motivou o encaminhamento para o CDT. A equipa de radiologia intervencionista não a considerou uma boa candidata, dada a sua hemorragia vaginal persistente e o carcinoma uterino largamente metastásico. Ela foi trocada para enoxaparina terapêutica após nenhuma outra intervenção invasiva ter sido considerada apropriada. O seu estado respiratório não melhorou e foi iniciada uma pressão positiva nas vias aéreas. Levando em consideração a natureza terminal de seu câncer, ela finalmente optou por buscar cuidados de conforto e morreu logo em seguida.
Agradecimentos
Os autores gostariam de agradecer a Benjamin A. Hohmuth, MD, A. Joseph Layon, MD, e Luis L. Nadal, MD, pela revisão do artigo e pelo inestimável feedback.
O Dr. Wenqian Wang, Dr. Vedamurthy, e o Dr. Wang estão baseados no departamento de medicina hospitalar do The Medicine Institute, Geisinger Health System, Danville, Penn. Entre em contato com o Dr. Wenqian Wang em .
Key Points
– Use dados angiográficos pulmonares, estabilidade clínica e análise de outras condições comorbitárias para decidir a melhor modalidade de tratamento.
– Nossa equipe prefere a trombólise com ultra-som (EKOS) para pacientes com EP submassiva, pacientes com EP maciça e como procedimento de resgate para pacientes que falham na trombólise sistêmica.
– O estabelecimento de equipes multidisciplinares compostas por radiologistas intervencionistas, intensivistas, cardiologistas e cirurgiões vasculares é prudente para tomar decisões individualizadas.
– Pode ser apropriado colocar um filtro de VCI como coadjuvante da anticoagulação em pacientes com EP grave.
1. Jaff MR, McMurtry MS, Archer SL, et al. Manuseio de embolia pulmonar maciça e submassiva, trombose venosa profunda iliofemoral e hipertensão pulmonar tromboembólica crônica: uma declaração científica da American Heart Association. Circulação. 2011;123:1788-1830.
2. Goldhaber SZ, Visani L, De Rosa M. Embolia pulmonar aguda: resultados clínicos no Registro Internacional Cooperativo de Embolia Pulmonar (ICOPER). Lanceta. 1999;353:1386-9.
3. Kearon C, Akl EA, Ornelas J, et al. Antitrombotic Therapy for VTE Disease: Diretrizes para o TESTE e Relatório do Painel de Especialistas. Tórax. 2016;149:315-52.
4. Konstantinides S, Geibel A, Heusel G, Heinrich F, Kasper W. Estratégias de Gestão e Prognóstico de Embolia Pulmonar-3 Investigadores de Ensaios. Heparina mais alteplase em comparação com a heparina sozinha em pacientes com embolia pulmonar submassiva. N Engl J Med. 2002;347:1143-50.
5. Sharifi M, Bay C, Skrocki L, Rahimi F, Mehdipour M, “MOPETT” Investigadores. Embolia pulmonar moderada tratada com trombólise (do Ensaio “MOPETT”). Am J Cardiol. 2013;111:273-7.
6. Meyer G, Vicaut E, Danays T, et al. Fibrinólise para pacientes com embolia pulmonar de risco intermediário. N Engl J Med. 2014;370:1402-11.
7. Kuo WT. Endovascular therapy for acute pulmonary embolism. J Vasc Interv Radiol 2012;23:167-79. e164
8. Kucher N, Boekstegers P, Muller OJ, et al. Randomized, controlled trial of ultrasound-assisted catheter-oriented thrombolysis for acute intermediate-risk pulmonary embolism. Circulação. 2014;129:479-86.
9. Kuo WT, Banerjee A, Kim PS, et al. Pulmonary Embolism Response to Fragmentation, Embolectomy, and Catheter Thrombolysis (PERFECT): Resultados Iniciais de um Prospectivo Registo Multicêntrico. Tórax. 2015;148:667-73.
10. Piazza G, Hohlfelder B, Jaff MR, et al. A Prospective, Single-Arm, Multicenter Trial of Ultrasound-Facilitated, Catheter-Directed, Low-Dose Fibrinolysis for Acute Massive and Submassive Pulmonary Embolism: O Estudo SEATTLE II. JACC Cardiovasc Interv. 2015;8:1382-92.
11. Sharifi M. Dose Completa Sistêmica, Meia Dose e Trombólise Direcionada por Cateter para Embolia Pulmonar. Quando usar e como escolher? Opções de Tratamento de Moeda Cardiovasc Med. 2016;18:31.
12. Wang C, Zhai Z, Yang Y, et al. Eficácia e segurança do ativador plasminogênico tipo dose baixa de tecido recombinante para o tratamento do tromboembolismo pulmonar agudo: um estudo randomizado, multicêntrico e controlado. Tórax. 2010;137:254-62.
13. Sharifi M, Vajo Z, Freeman W, Bay C, Sharifi M, Schwartz F. Transformar e simplificar o tratamento da embolia pulmonar: trombólise em “dose segura” mais novos anticoagulantes orais. Pulmão. 2015;193:369-74.
14. Kabrhel C, Rosovsky R, Channick R, et al. A Multidisciplinary Pulmonary Embolism Response Team: Experiência inicial de 30 meses com uma nova abordagem ao tratamento de pacientes com embolia pulmonar submassiva e maciça. Tórax. 2016;150:384-93.
15. Lessne ML, Sing RF. Contraponto: Os benefícios compensam os riscos para a maioria dos pacientes sob consideração para filtros de veia cava inferior? Não. Peito. 2016; 150(6):1182-4.
16. O Grupo de Estudo PREPIC. Oito anos de acompanhamento de pacientes com filtros de veia cava permanente na prevenção de embolia pulmonar: o estudo aleatório PREPIC (Prevention du Risque d’Embolie Pulmonaire par Interruption Cave). Circulação. 2005;112(3):416-22.
17. Mismetti P, Laporte S, Pellerin O, et al. Effect of a retrievable inferior vena cava filter plus anticoagulation vs. anticoagulation alone on risk of recurrent pulmonary embolism: a randomized clinical trial. JAMA. 2015. 313(16):1627-35.
18. Deshpande KS, Hatem C, Karwa M, et al. The use of inferior vena cava filter as a treatment modality for massive pulmonary embolism. Uma série de casos e revisão da fisiopatologia. Respir Med. 2002.96(12):984-9.
19. Kucher N, Rossi E, De Rosa M, et al. Massive Pulmonary embolism. Circulação. 2006;113(4):577-82.
20. Stein P, Matta F. Case Fatality Rate with Pulmonary Embolectomy for Acute Pulmonary Embolism. Am J Med. 2012;125:471-7.