症例
49歳の病的肥満の女性が息切れと腹部膨満感で救急外来を受診しました。 来院時、血圧は100/60mmHg、心拍数は110、呼吸数は24、パルスオキシメトリー飽和度(SpO2)は室温で86%であった。 トロポニンTは0.3ng/mLと高値であった. 胸部コンピュータ断層撮影(CT)で鞍部肺塞栓症(PE),右心室(RV)拡張を認めた. 腹部・骨盤CTでは、びまん性リンパ節腫脹を伴う非常に大きな子宮体部腫瘤が確認された。 心エコー図ではRVの歪みが確認された。 下肢の二重超音波検査では、左総大腿静脈と右膝窩静脈を含む急性深部静脈血栓症(DVT)と一致する所見が得られた。 鎖骨上リンパ節の生検で、子宮由来と思われる高グレードの未分化癌を認めた。
臨床での疑問
標準的な全身抗凝固療法以外に治療オプションがあるとすれば、それは何ですか? 以下のような役割がありますか? 全身性血栓溶解療法?
2. カテーテル由来血栓溶解療法(CDT)?
3. 下大静脈フィルター設置?
血栓が肺血管の中心にあり,心拍出量低下による低血圧を伴う巨大なPEの場合,全身血栓溶解療法,塞栓除去術,CDTは救命措置として適応となる可能性があります。 しかし、PEが大きく、RVの緊張を引き起こしているが、明らかな血行動態の不安定性がない場合には、エビデンスはあまり明確ではない。 これは一般に、中間リスクまたは “サブマス “PEとして知られています。 米国心臓協会(AHA)のガイドラインに基づくサブマッシブPEとは:1
全身性低血圧(収縮期血圧が90mmHg未満)がなく、RV機能障害または心筋壊死がある急性PEです。 RV機能障害は、以下のうち少なくとも1つの存在によって定義される:
– RV拡張(頂部4室RV径をLV径で割った値が0.1より大きい)。9以上)または心エコーによるRV収縮機能障害;
– CTによるRV拡張、BNPの上昇(90pg/mL以上)、N末端プロBNPの上昇(500pg/mL以上);
– 心電図変化(新しい完全または不完全な右脚ブロック、前中部ST上昇または低下、前中部T波逆位)。
2016年米国胸部医師会(CHEST)ガイドライン更新版3は、抗凝固療法開始後に悪化したが低血圧を発症しておらず、出血リスクが低い急性PE患者を選択した場合、全身投与による血栓溶解療法を無療法よりも推奨しています(グレード2Cの推奨)。
全身性血栓溶解療法
全身性血栓溶解療法は、一定期間、血栓溶解剤の点滴静脈内投与として行われる。 食品医薬品局で承認されている血栓溶解薬には、現在、組織プラスミノーゲンアクチベーター(tPA)/アルテプラーゼ、ストレプトキナーゼ、ウロキナーゼがあります。
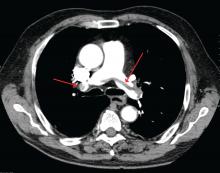 James Heilman, MD (used under Creative Commons license)
James Heilman, MD (used under Creative Commons license)
肺動脈の分岐部で大きな肺塞栓症(saddle embolism)です。
2002年の無作為化二重盲検Pulmonary Embolism-3 Trial4では、Konstantinidesらがsubmassive PE患者256人を対象にヘパリン+tPAとヘパリン+プラセボの比較試験を実施しました。 死亡または院内治療の増悪という臨床上の主要評価項目は、tPA群で11.0%、プラセボ群で24.6%でした(P = .006)。この違いは、血管拡張薬の使用、救援血栓溶解、人工呼吸、心停止、外科的塞栓除去術の必要性として定義される治療の増悪によって大きく影響されました。 驚くべきことに、両群とも出血性脳卒中の症例はなかった。 この試験では、submassive PEに対する全身的な血栓溶解療法は、死亡や治療の増悪のリスクが低いことが示されました。
低用量血栓溶解療法の有効性については、MOPETT 2013(単施設、前向き、無作為、オープンラベル試験)5で、症状とCT血管造影または換気・血流スキャンデータに基づいてsubmassive PEと判断した126人が50mg tPA+ヘパリンまたはヘパリン抗凝固単独投与を受け、検討しました。 28 ヵ月後の肺高血圧と PE の再発の複合エンドポイントは,tPA 群が 16%であったのに対し,対照群は 63%であった(P は 0.001 未満). 全身性血栓溶解療法は,この小規模試験では死亡率の改善は認められなかったが,肺高血圧と PE の再発のリスクの低下と関連していた.
20146年の無作為化二重盲検PEITHO試験(n=1,006)において,サブマッシブPE患者に対するテネクテプラーゼ+ヘパリンとヘパリンの比較では,主要転帰の死亡と血行動態悪化はプラセボ群の5.6%に対してテネクテプラーゼ群の2.6%で生じた(p=0.02). 血栓溶解療法は出血性脳卒中の発生率が2%であったのに対し、プラセボ群では0.2%であった(P = 0.03)。 この場合,全身性血栓溶解療法は死亡と血行動態の不安定化のリスクを3%低下させたが,出血性脳卒中のリスクも1.8%上昇させた.
Catheter-directed thrombolysis (CDT)
CDTはもともと動脈、透析グラフト、深部静脈血栓の治療のために開発されましたが、現在は急性下血栓または巨大PEの治療としてFDAに承認されています。
塞栓にワイヤーが通り、多穴注入カテーテルを設置、そこから12-24時間かけて血栓溶解剤を点滴しています。 血栓に直接薬剤を投与するため、全身療法と同等の効果が期待できるが、出血のリスクは低いと考えられている。 血栓負荷が大きく、血行動態が不安定なため、より迅速な血栓除去が必要な場合は、CDTの補助として、破砕や吸引などの機械的療法を行うことができる。 しかし、これらの機械的手法は肺動脈損傷の危険性があるため、最後の手段としてのみ使用すべきである。 多穴式注入カテーテルに超音波を発するワイヤーを追加して、超音波で血栓を破壊することにより血栓溶解を促進することができる。この技術は超音波増強血栓溶解法(EKOS)として知られている。7,10
ULTIMA2014試験8は、59人の患者を対象に、超音波支援カテーテル直接血栓溶解療法(USAT、この用語はEKOSと置き換えて使用できる)とヘパリン抗凝固療法の小規模無作為オープンラベル試験で、サブマスPE患者の主要評価指標であるRV/RV比を改善するのに、前者が優れているかを調べるためにデザインされました。 RV/LV比の平均減少率は,USAT群で0.30±0.20であったのに対し,ヘパリン群では0.03±0.16だった(P<0.001). 3628><2822>多施設登録ベースの試験であるPERFECT 2015 Trial9では,巨大および亜巨大PEに対する第一選択療法としてCDTを受けた患者101人を前向きに登録した. submassive PE患者において,血行動態の安定,肺高血圧と右心緊張の改善,退院までの生存と定義されるこの治療による「臨床的成功」が97.3%に認められた. また、大出血や頭蓋内出血は認められませんでした。 USATと標準的なCDTを比較した本試験のサブグループ解析では、平均肺圧変化、平均血栓溶解量、平均注入時間に有意差は認められなかった<3628><2822>前向き単群多施設試験SEATTLE II 201510では、159例のサンプルでEKOSの有効性が評価された。 massive PEとsubmassive PEを有する患者に、約24mgのtPAを12~24時間かけてカテーテルから注入しました。 主要評価項目は、胸部CTによるRV/LV比のベースラインからの低下と処置後48時間の比較であった。 術前と術後の比率はそれぞれ1.55と1.13であり(P<0.001)、EKOSがRVの拡張を抑制したことが示された。 頭蓋内出血は観察されず、研究者は死亡率やQOLなどの長期的な結果についてはコメントしなかった。 ヘパリン単剤での抗凝固療法、全身性血栓溶解療法、標準的なCDTなどの比較群がないため、本試験は制限されている
サブマッシブPEに対する治療は、施設によって異なる。 低用量全身性血栓溶解療法、CDT、EKOS、標準的なヘパリン抗凝固療法を比較したデータが十分でないため、確実な推奨はできない。 低用量全身性血栓溶解療法は、高価なカテーテルベースの血栓溶解療法と同等の効果があると考える研究者もいる。13
Bottom line
我々の施設では、放射線治療チームが症例ごとにubmassive PE基準を満たした患者の選別を行っている。 肺血管造影のデータ(血栓の性質と範囲)、臨床的安定性、他の併存疾患の分析から、個々の患者にとって最適な治療法を決定する。 確固たるガイドラインを支持するデータが得られるまでは、インターベンショナルラジオロジスト、集中治療専門医、心臓専門医、血管外科医からなる集学的チームを立ち上げることが、個々の患者に合った決定を行い、最高の結果を得るために賢明であると考えています14。
IVC filter
この症例はすでにsubmassive PEを発症しているので、残ったDVTが再び塞栓した場合、さらなる血栓負荷に耐えられるか? IVCフィルターの役割はありますか?
IVCフィルターの留置は、その使用を正当化する質の高いエビデンスがないまま、過去30年間で著しく増加しています15
2016年の「VTE疾患に対する抗血栓療法」です。 CHEST Guideline and Expert Panel Reportには、はっきりとこう書かれています。 抗凝固薬による治療を受けている下肢の急性DVTまたはPE患者において、IVCフィルターの使用は推奨されない(グレード1B)。この推奨は、Prevention du Risque d’Embolie Pulmonaire par Interruption Cave (PREPIC) ランダム化試験16 と最近発表された PREPIC 2 ランダム化試験17 の結果に基づいており、どちらも抗凝固療法を受けた PE と DVT 患者において、3ヶ月間の IVC フィルターの同時装着は、致命的な PE も含めて PE 再発を抑制しないことが示されている
CHEST ガイドラインでは PE と DVT 患者の補助として IVC フィルターは定期的に装着すべきでないことが述べられている。 しかし、サブマッシブ PE やマッシブ PE で、再度の PE が致命的となるような患者にはどうでしょうか? この領域での臨床データは不足している
Deshpande らは、巨大な PE で心肺が不安定な患者 6 例について報告している。 Kucherらは、2006年のICOPERで、収縮期動脈圧90mmHg未満のmassive PE患者108人のうち、11人にIVCフィルターが併用されたことを報告している。 この11人の患者のうち、90日後にPEを再発した患者はなく、10人が90日以上生存していた。IVCフィルター留置は90日死亡率の低下と関連していた。 この研究では、IVCフィルターの設置はすべて異なる施設の医師が決定しました。19 2012年に行われた、肺塞栓術を受けた急性PE患者3,770人の症例致死率を調査した研究では、不安定な患者でも安定した患者でも、IVCフィルターを設置した患者の症例致死率が低いことが示されました20。
上記のデータは、少なくとも短期的なアウトカムにおいては、巨大なPE患者におけるIVCフィルターの補助的設置に有利であるが、規模が小さく、ランダム化が行われていないため、エビデンスに基づくガイドラインを確立することができない。 2016年のCHESTガイドラインでは、抗凝固療法を受けている重症PE患者にIVCフィルターを補助的に設置するメリットがあるかどうかは不明であるため、この特定のサブグループにおいては、抗凝固療法を受けている急性PE患者へのIVCフィルター挿入を行わない推奨は適用できないかもしれないと指摘しています3)。
Bottom line
サブマッシブまたはマッシブPE患者に補助的にIVCフィルターを設置すべきかどうか、エビデンスに基づくガイドラインはない。しかし、専門家の合意に基づけば、重度のPE患者では抗凝固療法の補助としてIVCフィルターの設置が適切である可能性はある。 しかし、専門家のコンセンサスに基づけば、重症のPE患者には抗凝固療法の補助としてIVCフィルターを設置することが適切である。その決定は、各患者の特性、好み、施設の専門知識に基づいて個別に行われるべきである。
我々のケースでは、さらなる塞栓負荷の予防を期待して、患者は来院翌日にIVCフィルターを設置した。 ヘパリンによる抗凝固療法を開始したが、頻脈・頻呼吸が続いたため、CDTを紹介した。 インターベンショナルラジオロジーチームは、膣からの出血が続いていることと、子宮癌の転移が広いことを考慮し、彼女が良い候補者であるとは感じませんでした。 これ以上の侵襲的介入は適切でないと判断し、治療用エノキサパリンに切り替えた。 呼吸状態は改善されず、二重陽圧呼吸が開始された。 癌の末期であることを考慮し、最終的にコンフォートケアを選択し、その後まもなく死亡した。 Wenqian Wang博士、Vedamurthy博士、Wang博士は、The Medicine Institute, Geisinger Health System, Danville, Penn.の病院医学部門に所属しています。 Wenqian Wang博士への連絡先:
Key Points
– 最良の治療法を決定するために、肺血管造影データ、臨床安定性、他の併存疾患の分析を用いる。
– 我々のチームはサブマスのPE患者、大量のPE患者に超音波強化血栓溶解(EKOS)を推奨し、全身血栓溶解が失敗した患者の救助処置として使用する。
– インターベンショナルラジオロジスト、集中治療医、心臓専門医、血管外科医からなる集学的チームを設立することは、個々の患者に合わせた決断をするために賢明である
– 重症PE患者に抗凝固療法の補助としてIVCフィルターを設置することが適切かもしれない。 このような場合には、抗凝固療法を行う前に、IVCフィルターを挿入する必要があります。 Circulation. 2011;123:1788-1830.
2. Goldhaber SZ, Visani L, De Rosa M. Acute pulmonary embolism: clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER).「肺塞栓症の急性期における臨床成績」。 Lancet. 1999;353:1386-9.
3. Kearon C, Akl EA, Ornelas J, and al. Antithrombotic Therapy for VTE Disease: CHESTガイドラインと専門家委員会報告書。 Chest. 2016;149:315-52.
4. Konstantinides S, Geibel A, Heusel G, Heinrich F, Kasper W. Management Strategies and Prognosis of Pulmonary Embolism-3 Trial Investigators.肺塞栓症の治療と予後に関するガイドライン。 サブマス性肺塞栓症患者におけるヘパリン+アルテプラーゼとヘパリン単独との比較。 N Engl J Med. 2002;347:1143-50.
5. Sharifi M, Bay C, Skrocki L, Rahimi F, Mehdipour M, “MOPETT” Investigators. 血栓溶解療法で治療された中等度肺塞栓症(「MOPETT」トライアルより)。 Am J Cardiol。 2013;111:273-7.
6. Meyer G, Vicaut E, Danays T, et al. Fibrinolysis for patients with intermediate-risk pulmonary embolism(中等度リスクの肺塞栓症患者に対する線維素溶解療法). N Engl J Med. 2014;370:1402-11.
7.Kuo WT. 急性肺塞栓症に対する血管内治療。 J Vasc Interv Radiol 2012;23:167-79. e164
8. Kucher N, Boekstegers P, Muller OJ, et al. Randomized, controlled trial of ultrasound-assisted catheter-directed thrombolysis for acute intermediate risk pulmonary embolism.「急性肺塞栓症に対する超音波による血栓溶解療法」.N Engl J Med 2012;370:1402-11. Circulation. 2014;129:479-86.
9. Kuo WT, Banerjee A, Kim PS, et al. Pulmonary Embolism Response to Fragmentation, Embolectomy, and Catheter Thrombolysis (PERFECT)。 プロスペクティブな多施設共同レジストリによる初期結果。 Chest. 2015;148:667-73.
10. Piazza G, Hohlfelder B, Jaff MR, et al. 急性大量・亜大量肺塞栓症に対する超音波促進・カテーテル指示・低用量線維素溶解療法の前向き単群・多施設試験: SEATTLE II 試験。 JACC Cardiovasc Interv. 2015;8:1382-92.
11. Sharifi M. Systemic Full Dose, Half Dose, and Catheter Directed Thrombolysis for Pulmonary Embolism(肺塞栓症に対する全身投与、半量投与、カテーテル誘導血栓溶解療法)。 いつ使うか、どう選ぶか? Curr Treat Options Cardiovasc Med. 2016;18:31.
12. Wang C, Zhai Z, Yang Y, et al. 急性肺血栓塞栓症の治療に対する低用量組換え組織型プラスミノーゲン活性化剤の有効性と安全性:無作為化多施設比較試験. Chest. 2010;137:254-62.
13. Sharifi M, Vajo Z, Freeman W, Bay C, Sharifi M, Schwartz F. Transforming and simplifying the treatment of pulmonary embolism: “safe dose” thrombolysis plus new oral anticoagulants.肺塞栓症治療の変革と簡略化:「安全量」血栓溶解療法と新しい経口抗凝固薬の併用。 Lung. 2015;193:369-74.
14. Kabrhel C, Rosovsky R, Channick R, et al.集学的肺塞栓症対策チーム: このような場合、「臓器移植を行う前に、臓器移植を行う前に、臓器移植を行う前に、臓器移植を行う前に、臓器移植を行う前に、臓器移植を行う前に、臓器移植を行う前に、臓器移植を行う前に、. Chest. 2016;150:384-93.
15. レッシンML、シングRF. カウンターポイント。 下大静脈フィルターが検討されているほとんどの患者にとって、ベネフィットはリスクを上回るか? No. Chest. 2016; 150(6):1182-4.
16. PREPIC研究グループ。 肺塞栓症予防のための永久大静脈フィルター装着患者の8年追跡調査:PREPIC(Prevention du Risque d’Embolie Pulmonaire par Interruption Cave)無作為化試験。 Circulation. 2005;112(3):416-22.
17. Mismetti P, Laporte S, Pellerin O, et al. Retrievable inferior vena cava filter plus anticoagulation vs. anticoagulation only on risk of recurrent pulmonary embolism: a randomized clinical trial. JAMA. 2015. 313(16):1627-35.
18. Deshpande KS, Hatem C, Karwa M, et al.大量肺塞栓症の治療法としての下大静脈フィルターの使用について. ケースシリーズと病態生理学のレビュー。 Respir Med. 2002.96(12):984-9.
19. Kucher N, Rossi E, De Rosa M, et al. Massive Pulmonary embolism(大規模肺塞栓症). Circulation. 2006;113(4):577-82.
20. Stein P, Matta F. 急性肺塞栓症に対する肺塞栓術の症例致死率。 Am J Med. 2012;125:471-7.