Případ
Na oddělení urgentního příjmu se dostavila 49letá morbidně obézní žena s dušností a nadýmáním. Při prezentaci byl její krevní tlak 100/60 mm Hg se srdeční frekvencí 110, dechovou frekvencí 24 a pulzní oxymetrickou saturací (SpO2) 86 % na pokojovém vzduchu. Troponin T byl zvýšen na 0,3 ng/ml. Počítačová tomografie (CT) hrudníku s intravenózním kontrastem prokázala sedlovou plicní embolii (PE) s dilatovanou pravou komorou (PK). CT břicha/břicha odhalilo velmi rozsáhlou děložní masu s difuzní lymfadenopatií.
Prodleně byla zahájena infuze heparinu. Echokardiogram prokázal deformaci RV. Nález na duplexním ultrazvuku dolních končetin odpovídal akutní hluboké žilní trombóze (DVT) zahrnující levou společnou stehenní žílu a pravou podkolenní žílu. Biopsie supraklavikulární lymfatické uzliny prokázala nediferencovaný karcinom vysokého stupně pravděpodobně děložního původu.
Klinické otázky
Jaké případné terapeutické možnosti by měly být zváženy kromě standardní systémové antikoagulace? Existuje role pro:
1. Systémová trombolýza?
2. Katetrem řízená trombolýza (CDT)?
3. Zavedení filtru do dolní duté žíly (IVC)?
Jaká je vhodná léčba „submasivní“ PE?
V případě masivní PE, kdy se trombus nachází v centrálním plicním řečišti a je spojen s hypotenzí v důsledku poruchy srdečního výdeje, jsou jako potenciálně život zachraňující opatření indikovány systémová trombolýza, embolektomie a CDT. Důkazy jsou však méně jasné, pokud je PE rozsáhlá a vedla k zátěži RV, ale bez zjevné hemodynamické nestability. Taková situace se běžně označuje jako PE se středním rizikem nebo „submasivní“ PE. Submasivní PE podle doporučení Americké kardiologické asociace (AHA) je:1
Akutní PE bez systémové hypotenze (systolický krevní tlak nižší než 90 mm Hg), ale s dysfunkcí RV nebo nekrózou myokardu. Dysfunkce RV je definována přítomností alespoň jednoho z těchto znaků:
– dilatace RV (apikální 4-komorový průměr RV dělený průměrem LK větší než 0.9) nebo systolická dysfunkce RV na echokardiografii;
– dilatace RV na CT, elevace BNP (více než 90 pg/ml), elevace N-terminálního pro-BNP (více než 500 pg/ml);
– elektrokardiografické změny (nová úplná nebo neúplná blokáda pravého raménka, anteroseptální elevace nebo deprese ST nebo anteroseptální inverze vlny T).
Myokardiální nekróza je definována jako zvýšený troponin I (více než 0,4 ng/ml) nebo zvýšený troponin T (více než 0,1 ng/ml).
Proč má submasivní PE klinický význam?
V roce 1999 analýza Mezinárodního kooperativního registru plicní embolie (ICOPER) odhalila, že dysfunkce RV u pacientů s PE byla spojena s téměř dvojnásobným zvýšením rizika 3měsíční mortality (poměr rizik 2,0, 1,3-2,9).2 Vzhledem k tomuto zvýšenému riziku by bylo možné vyvodit logický závěr, že submasivní PE musíme léčit agresivněji než PE bez zátěže RV. Ale povede to nutně k lepšímu výsledku pro pacienta vzhledem k 3% riziku intrakraniálního krvácení spojeného s trombolytickou léčbou?“
Ve výše uvedeném klinickém scénáři pacient skutečně splňoval definici submasivní PE. Pacientka sice neměla systémovou hypotenzi, ale měla dilataci RV na CT, systolickou dysfunkci RV na echu a také zvýšenou hladinu troponinu T. Pacientka měla také zvýšené hodnoty troponinu T na CT. Co by se kromě zahájení antikoagulační léčby mělo ještě udělat, aby se zvýšila pravděpodobnost jejího dobrého výsledku?
AHA doporučuje zvážit systémovou trombolýzu a CDT u pacientů s akutní submasivní PE, pokud mají klinické známky nepříznivé prognózy, včetně zhoršujícího se respiračního selhání, závažné dysfunkce RV nebo velké nekrózy myokardu a nízkého rizika krvácivých komplikací (třída IIB; úroveň důkazu C).1
Aktualizovaná doporučení American College of Chest Physicians (CHEST) z roku 20163 doporučují systémově podávanou trombolytickou léčbu namísto žádné léčby u vybraných pacientů s akutní PE, u nichž došlo ke zhoršení stavu po zahájení antikoagulační léčby, ale u nichž se ještě nerozvinula hypotenze a kteří mají nízké riziko krvácení (stupeň doporučení 2C).
Systémová trombolýza
Systémová trombolýza se podává jako intravenózní trombolytická infuze podávaná po určitou dobu. Mezi trombolytické léky schválené Úřadem pro kontrolu potravin a léčiv patří v současné době tkáňový aktivátor plazminogenu (tPA)/altepláza, streptokináza a urokináza.
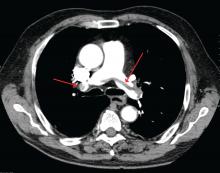 James Heilman, MD (použito pod licencí Creative Commons)
James Heilman, MD (použito pod licencí Creative Commons)
Velká plicní embolie v bifurkaci plicní tepny (sedlovitá embolie).
V randomizované, dvojitě zaslepené studii Pulmonary Embolism-3 Trial z roku 20024 Konstantinides a jeho kolegové porovnávali heparin plus tPA oproti heparinu plus placebu u 256 pacientů se submasivní PE. Primární klinický koncový ukazatel úmrtí nebo eskalace péče v nemocnici byl 11,0 % ve skupině s tPA oproti 24,6 % ve skupině s placebem (P = .006); rozdíl byl způsoben především eskalací péče, definované jako použití vazopresorů, záchranná trombolýza, mechanická ventilace, srdeční zástava a požadavek chirurgické embolektomie. Možná překvapivě se v žádné z těchto skupin nevyskytl žádný případ hemoragické cévní mozkové příhody. Studie prokázala, že systémová trombolýza u submasivní PE byla spojena s nižším rizikem úmrtí a eskalace léčby.
Účinnost nízkodávkované trombolýzy byla zkoumána ve studii MOPETT 2013,5 což byla jednocentrová, prospektivní, randomizovaná, otevřená studie, ve které 126 účastníků, u nichž byla na základě symptomů a CT angiografických nebo ventilačně-perfuzních snímků zjištěna submasivní PE, dostalo buď 50 mg tPA plus heparin, nebo pouze heparinovou antikoagulaci. Složený koncový ukazatel plicní hypertenze a recidivující PE po 28 měsících byl 16 % ve skupině s tPA ve srovnání s 63 % v kontrolní skupině (P méně než .001). Systémová trombolýza byla spojena s nižším rizikem plicní hypertenze a rekurentní PE, ačkoli v této malé studii nebyl pozorován žádný přínos pro mortalitu.
V randomizované, dvojitě zaslepené studii PEITHO (n = 1 006) z roku 20146 porovnávající tenekteplázu plus heparin oproti heparinu u pacientů se submasivní PE se primární výsledky úmrtí a hemodynamické dekompenzace vyskytly u 2,6 % ve skupině s tenekteplázou ve srovnání s 5,6 % ve skupině s placebem (P = .02). Trombolytická léčba byla spojena s 2% výskytem hemoragické cévní mozkové příhody, zatímco hemoragická cévní mozková příhoda v placebové skupině byla 0,2 % (P = .03). V tomto případě byla systémová trombolýza spojena s 3% nižším rizikem úmrtí a hemodynamické nestability, ale také s 1,8% zvýšením rizika hemoragické cévní mozkové příhody.
Katetrem řízená trombolýza (CDT)
CDT byla původně vyvinuta k léčbě arteriálních trombóz, trombóz dialyzačních štěpů a hlubokých žil, ale nyní je schválena úřadem FDA pro léčbu akutní submasivní nebo masivní PE.
Embolus se protáhne drátem a zavede se víceotvorový infuzní katétr, kterým se po dobu 12-24 hodin podává trombolytické léčivo. Předpokládá se, že přímé podání léku do trombu je stejně účinné jako systémová léčba, ale s nižším rizikem krvácení. Pokud je z důvodu velké zátěže trombem a hemodynamické nestability indikováno rychlejší odstranění trombu, lze jako doplněk CDT použít mechanické terapie, jako je fragmentace a aspirace. Tyto mechanické techniky však s sebou nesou riziko poranění plicní tepny, a proto by měly být použity až jako poslední možnost. K víceotvorovému infuznímu katétru lze přidat drátek vyzařující ultrazvuk, který urychlí trombolýzu tím, že ultrazvukem naruší trombus, což je technika známá jako ultrazvukem zesílená trombolýza (EKOS).7,10
Studie ULTIMA 2014,8 malá, randomizovaná, otevřená studie Ultrasound-Assisted Catheter Directed Thrombolysis (USAT, termín lze používat zaměnitelně s EKOS) oproti samotné antikoagulaci heparinem u 59 pacientů, měla za cíl zjistit, zda je první strategie lepší ve zlepšení primárního výsledného ukazatele poměru RV/LV u pacientů se submasivní PE. Průměrné snížení poměru RV/LV bylo 0,30 +/- 0,20 ve skupině s USAT ve srovnání s 0,03 +/- 0,16 ve skupině s heparinem (P méně než .001). Při 90denním sledování však nebyl ve skupinách pozorován žádný významný rozdíl v mortalitě nebo krvácení.
Studie PERFECT 2015,9 multicentrická studie založená na registru, prospektivně zařadila 101 pacientů, kteří dostávali CDT jako léčbu první volby masivní a submasivní PE. Mezi pacienty se submasivní PE byl u 97,3 % zjištěn „klinický úspěch“ této léčby, definovaný jako stabilizace hemodynamiky, zlepšení plicní hypertenze a zátěže pravého srdce a přežití do propuštění z nemocnice. Nebylo zaznamenáno žádné závažné krvácení ani intrakraniální krvácení. Analýzy podskupin v této studii srovnávající USAT se standardní CDT neodhalily významný rozdíl v průměrných změnách plicního tlaku, průměrných trombolytických dávkách ani průměrné době infuze.
Prospektivní jednoramenná multicentrická studie SEATTLE II 201510 hodnotila účinnost EKOS na vzorku 159 pacientů. Pacienti s masivní i submasivní PE dostávali přibližně 24 mg tPA infundovaného přes katétr po dobu 12-24 hodin. Primárním výsledkem účinnosti bylo snížení poměru RV/LV měřeného pomocí CT hrudníku od výchozího stavu ve srovnání se stavem 48 hodin po zákroku. Poměr před a po zákroku byl 1,55 oproti 1,13 (P méně než .001), což naznačuje, že EKOS snížil dilataci RV. Nebylo pozorováno žádné intrakraniální krvácení a zkoušející se nevyjádřili k dlouhodobým výsledkům, jako je mortalita nebo kvalita života. Studie byla omezena absencí srovnávací skupiny, jako je antikoagulace heparinem jako monoterapie nebo systémová trombolýza či standardní CDT.
Léčba submasivní PE se na různých pracovištích liší. K dispozici jednoduše nejsou dostatečné údaje srovnávající nízkou dávku systémové trombolýzy, CDT, EKOS a standardní antikoagulaci heparinem, aby bylo možné vydat závazná doporučení. Někteří vyšetřovatelé se domnívají, že nízkodávková systémová trombolýza je pravděpodobně stejně dobrá jako nákladná katetrizační trombolytická léčba.11,12 Po nízkodávkové trombolytické léčbě může následovat užívání perorálních přímých inhibitorů faktoru Xa pro udržení antitrombotické aktivity.13
Bottom line
V našem zařízení tým intervenční radiologie vyšetřuje pacienty, kteří splňují kritéria submasivní PE, případ od případu. Při rozhodování o nejlepší léčebné modalitě pro konkrétního pacienta využíváme plicní angiografické údaje (charakter a rozsah trombu), klinickou stabilitu a analýzu dalších komorbidních stavů. Náš tým upřednostňuje EKOS u pacientů se submasivní PE i u pacientů s masivní PE a jako záchranný postup u pacientů, u nichž selhala systémová trombolýza.
Dokud nebude k dispozici více údajů, které by podpořily pevná doporučení, domníváme se, že vytvoření multidisciplinárních týmů složených z intervenčních radiologů, intenzivistů, kardiologů a cévních chirurgů je rozumné pro individuální rozhodování a dosažení nejlepších výsledků pro naše pacienty.14
IVC filtr
Jelikož pacientka v tomto případě již má submasivní PE, může tolerovat další zátěž trombem, pokud by u ní došlo k další embolizaci zbývající DVT? Má IVC filtr nějakou roli?
Implantace IVC filtrů se v posledních 30 letech výrazně zvýšila, aniž by existovaly kvalitní důkazy odůvodňující jejich použití.15
The 2016 Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report jasně uvádí: U pacientů s akutní DVT dolní končetiny nebo PE, kteří jsou léčeni antikoagulancii, se použití IVC filtru nedoporučuje (stupeň 1B).3 Toto doporučení vychází ze závěrů randomizované studie PREPIC (Prevention du Risque d’Embolie Pulmonaire par Interruption Cave)16 a nedávno publikované randomizované studie PREPIC 2,17 které ukazují, že u antikoagulovaných pacientů s PE a DVT současné umístění IVC filtru po dobu 3 měsíců nesnížilo výskyt recidivující PE, včetně fatální PE.
Směrnice CHEST uvádějí, že IVC filtr by neměl být rutinně nasazován jako doplněk u pacientů s PE a DVT. Co však u podskupiny pacientů se submasivní nebo masivní PE, u nichž by další PE měla katastrofální následky? V této oblasti chybí klinické údaje.
Deshpande et al. referovali o souboru šesti pacientů s masivní PE a kardiopulmonální nestabilitou; všichni pacienti dostali IVC filtr s antikoagulací. Krátkodobý výsledek byl vynikající, ale dlouhodobé sledování nebylo provedeno.18 Kucher a kolegové uvedli, že ze studie ICOPER z roku 2006 bylo ze 108 pacientů s masivní PE se systolickým arteriálním tlakem pod 90 mm Hg 11 pacientům nasazen přídatný IVC filtr. U žádného z těchto 11 pacientů nedošlo během 90 dnů k recidivě PE a 10 z nich přežilo alespoň 90 dnů; umístění IVC filtru bylo spojeno se snížením 90denní mortality. V této studii o umístění IVC filtru rozhodovali výhradně lékaři na různých pracovištích.19 Ve studii z roku 2012, která zkoumala míru fatality u 3 770 pacientů s akutní PE, kteří podstoupili plicní embolektomii, údaje ukázaly, že jak u nestabilních, tak u stabilních pacientů byla míra fatality nižší u těch, kteří dostali IVC filtr.20
Ačkoli jsou výše uvedené údaje příznivé pro přídatné zavedení IVC filtru u pacientů s masivní PE, alespoň pokud jde o krátkodobé výsledky, malý rozsah a absence randomizace brání stanovení pokynů založených na důkazech. Doporučení CHEST z roku 2016 upozorňují, že vzhledem k tomu, že není jisté, zda je přínosem přídatné zavedení IVC filtru u antikoagulovaných pacientů s těžkou PE, nemusí v této specifické podskupině pacientů platit doporučení nezavádět IVC filtr u pacientů s akutní PE, kteří jsou antikoagulováni.3
Dolní linie
Neexistuje žádné doporučení založené na důkazech, zda by měl být IVC filtr u pacientů se submasivní nebo masivní PE nasazen adjuvantně; na základě konsenzu odborníků však může být vhodné nasadit IVC filtr jako doplněk antikoagulace u pacientů s těžkou PE. Rozhodnutí by mělo být individuální na základě charakteristik každého pacienta, jeho preferencí a institucionálních zkušeností.
V našem případě byl pacientovi v naději na prevenci další embolické zátěže zaveden IVC filtr den po prezentaci. I přes zahájení antikoagulace heparinem zůstala tachykardická a tachypnoická, což si vyžádalo odeslání na CDT. Intervenční radiologický tým se domníval, že vzhledem k přetrvávajícímu vaginálnímu krvácení a rozsáhlému metastatickému karcinomu dělohy není vhodnou kandidátkou. Poté, co nebyl považován za vhodný další invazivní zákrok, byla převedena na terapeutický enoxaparin. Její stav dýchání se nezlepšil a byl zahájen žlučový pozitivní tlak v dýchacích cestách. S ohledem na terminální charakter jejího karcinomu se nakonec rozhodla pro komfortní péči a krátce poté zemřela.
Poděkování
Autoři by rádi poděkovali Benjaminu A. Hohmuthovi, MD, A. Josephu Layonovi, MD, a Luisi L. Nadalovi, MD, za jejich recenze článku a neocenitelné připomínky.
Doktor Wenqian Wang, doktor Vedamurthy a doktor Wang působí na oddělení nemocniční medicíny v The Medicine Institute, Geisinger Health System, Danville, Penn. Kontaktujte Dr. Wenqiana Wanga na telefonním čísle .
Klíčové body
– K rozhodnutí o nejlepší léčebné modalitě použijte plicní angiografické údaje, klinickou stabilitu a analýzu dalších komorbidních stavů.
– Náš tým upřednostňuje ultrazvukovou trombolýzu (EKOS) u pacientů se submasivní PE, u pacientů s masivní PE a jako záchranný postup u pacientů, u kterých selže systémová trombolýza.
– Zřízení multidisciplinárních týmů složených z intervenčních radiologů, intenzivistů, kardiologů a cévních chirurgů je rozumné pro individuální rozhodování.
– U pacientů s těžkou PE může být vhodné umístit IVC filtr jako doplněk antikoagulace.
1. Jaff MR, McMurtry MS, Archer SL, et al. Management masivní a submasivní plicní embolie, iliofemorální hluboké žilní trombózy a chronické tromboembolické plicní hypertenze: vědecké prohlášení Americké kardiologické asociace. Circulation. 2011;123:1788-1830.
2. Goldhaber SZ, Visani L, De Rosa M. Acute pulmonary embolism: clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER). Lancet. 1999;353:1386-9.
3. Kearon C, Akl EA, Ornelas J, et al. Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report. Chest. 2016;149:315-52.
4. Konstantinides S, Geibel A, Heusel G, Heinrich F, Kasper W. Management Strategies and Prognosis of Pulmonary Embolism-3 Trial Investigators. Heparin plus altepláza ve srovnání se samotným heparinem u pacientů se submasivní plicní embolií. N Engl J Med. 2002;347:1143-50.
5. Sharifi M, Bay C, Skrocki L, Rahimi F, Mehdipour M, „MOPETT“ Investigators. Středně těžká plicní embolie léčená trombolýzou (ze studie „MOPETT“). Am J Cardiol. 2013;111:273-7.
6. Meyer G, Vicaut E, Danays T, et al. Fibrinolysis for patients with intermediate-risk pulmonary embolism. N Engl J Med. 2014;370:1402-11.
7. Kuo WT. Endovaskulární léčba akutní plicní embolie. J Vasc Interv Radiol 2012;23:167-79. e164
8. Kucher N, Boekstegers P, Muller OJ, et al. Randomized, controlled trial of ultrasound-assisted catheter-directed thrombolysis for acute intermediate-risk pulmonary embolism. Circulation. 2014;129:479-86.
9. Kuo WT, Banerjee A, Kim PS, et al. Pulmonary Embolism Response to Fragmentation, Embolectomy, and Catheter Thrombolysis (PERFECT): Iniciální výsledky z prospektivního multicentrického registru. Chest. 2015;148:667-73.
10. Piazza G, Hohlfelder B, Jaff MR, et al. A Prospective, Single-Arm, Multicenter Trial of Ultrasound-Facilitated, Catheter-Directed, Low-Dose Fibrinolysis for Acute Massive and Submassive Pulmonary Embolism: Studie SEATTLE II. JACC Cardiovasc Interv. 2015;8:1382-92.
11. Sharifi M. Systémová plná dávka, poloviční dávka a katetrem řízená trombolýza u plicní embolie. Kdy použít a jak se rozhodnout? Curr Treat Options Cardiovasc Med. 2016;18:31.
12. Wang C, Zhai Z, Yang Y, et al. Účinnost a bezpečnost nízké dávky rekombinantního aktivátoru tkáňového plazminogenu pro léčbu akutní plicní tromboembolie: randomizovaná, multicentrická, kontrolovaná studie. Chest. 2010;137:254-62.
13. Sharifi M, Vajo Z, Freeman W, Bay C, Sharifi M, Schwartz F. Proměna a zjednodušení léčby plicní embolie: „bezpečná dávka“ trombolýzy plus nová perorální antikoagulancia. Lung. 2015;193:369-74.
14. Kabrhel C, Rosovsky R, Channick R, et al. Multidisciplinární tým pro léčbu plicní embolie: První 30měsíční zkušenosti s novým přístupem k poskytování péče pacientům se submasivní a masivní plicní embolií. Chest. 2016;150:384-93.
15. Lessne ML, Sing RF. Protinázor: Do the Benefits Outweigh the Risks for Most Patients Under Consideration for inferior vena cava filters? No. Chest. 2016; 150(6):1182-4.
16. Studijní skupina PREPIC. Osm let sledování pacientů s permanentními vena cava filtry v prevenci plicní embolie: randomizovaná studie PREPIC (Prevention du Risque d’Embolie Pulmonaire par Interruption Cave). Circulation. 2005;112(3):416-22.
17. Mismetti P, Laporte S, Pellerin O, et al. Effect of a retrievable inferior vena cava filter plus anticoagulation vs. anticoagulation alone on risk of recurrent pulmonary embolism: a randomized clinical trial. JAMA. 2015. 313(16):1627-35.
18. Deshpande KS, Hatem C, Karwa M, et al. Použití filtru dolní duté žíly jako léčebné modality masivní plicní embolie. Série případů a přehled patofyziologie. Respir Med. 2002.96(12):984-9.
19. Kucher N, Rossi E, De Rosa M a kol. Masivní plicní embolie. Circulation. 2006;113(4):577-82.
20. Stein P, Matta F. Míra úmrtnosti při plicní embolektomii u akutní plicní embolie. Am J Med. 2012;125:471-7.