De casus
Een 49-jarige vrouw met morbide obesitas meldde zich op de spoedeisende hulp met kortademigheid en abdominale distensie. Bij de presentatie was haar bloeddruk 100/60 mm Hg met een hartslag van 110, een ademhalingsfrequentie van 24 en een pulsoximetrische saturatie (SpO2) van 86% op kamerlucht. Troponine T was verhoogd met 0,3 ng/mL. Computertomografie (CT) van de borstkas met intraveneus contrast toonde een uitgezaaide longembolie (PE) met een uitgezet rechter ventrikel (RV). CT abdomen/pelvis toonde een zeer grote baarmoeder massa met diffuse lymfadenopathie.
Heparine infusie werd onmiddellijk gestart. Echocardiogram toonde RV rek. De bevindingen op de duplex echografie van de onderste ledematen kwamen overeen met acute diepe veneuze tromboses (DVT) waarbij de linker gemeenschappelijke femorale vene en de rechter popliteale vene betrokken waren. Biopsie van een supraclaviculaire lymfeklier toonde een hooggradig ongedifferentieerd carcinoom, hoogstwaarschijnlijk van uteriene oorsprong.
Klinische vragen
Welke, als er al therapeutische opties zijn, moeten worden overwogen naast standaard systemische anticoagulatie? Is er een rol weggelegd voor:
1. Systemische trombolyse?
2. Katheter-gerichte trombolyse (CDT)?
3. Inferior vena cava (IVC) filterplaatsing?
Wat is de juiste behandeling van “submassieve” PE?
In het geval van massieve PE, waarbij de trombus zich in de centrale pulmonale vasculatuur bevindt en gepaard gaat met hypotensie als gevolg van een verminderde cardiale output, zijn systemische trombolyse, embolectomie en CDT geïndiceerd als potentieel levensreddende maatregelen. Het bewijs is echter minder duidelijk wanneer het PE groot is en tot druk op het RV heeft geleid, maar zonder openlijke hemodynamische instabiliteit. Dit staat algemeen bekend als een intermediair risico of “submassieve” PE. Submassief PE volgens de richtlijnen van de American Heart Association (AHA) is:1
Een acuut PE zonder systemische hypotensie (systolische bloeddruk lager dan 90 mm Hg) maar met ofwel RV-dysfunctie ofwel myocardiale necrose. Disfunctie van de RV wordt gedefinieerd als de aanwezigheid van ten minste een van de volgende verschijnselen:
– RV-dilatatie (apicale vierkamer RV-diameter gedeeld door LV-diameter groter dan 0.9) of systolische disfunctie van het RV op echocardiografie;
– RV-dilatatie op CT, verhoging van BNP (meer dan 90 pg/mL), verhoging van N-terminaal pro-BNP (meer dan 500 pg/mL);
– Elektrocardiografische veranderingen (nieuw volledig of onvolledig rechterbundeltakblok, anteroseptale ST-elevatie of -depressie, of anteroseptale T-golfinversie).
Myocardiale necrose wordt gedefinieerd als verhoogd troponine I (meer dan 0,4 ng/mL) of verhoogd troponine T (meer dan 0,1 ng/mL).
Waarom is submassieve PE van klinisch belang?
In 1999 bleek uit een analyse van de International Cooperative Pulmonary Embolism Registry (ICOPER) dat het disfunctioneren van de RV bij PE-patiënten geassocieerd was met een bijna verdubbeling van het 3-maands sterfterisico (hazard ratio 2,0, 1,3-2,9).2 Gezien dit verhoogde risico zou men de logische conclusie kunnen trekken dat we subassieve PE agressiever moeten behandelen dan PE zonder RV-verrekking. Maar zal dit noodzakelijkerwijs resulteren in een beter resultaat voor de patiënt gezien het risico van 3% intracraniële bloeding dat gepaard gaat met trombolytische therapie?
In het bovenstaande klinische scenario voldeed de patiënt aan de definitie van subklinische PE. Hoewel de patiënte geen systemische hypotensie had, had ze wel RV-dilatatie op de CT, RV-systolische disfunctie op de echo en een verhoogde Troponine T-spiegel. Wat moet er, naast het starten van antistollingstherapie, nog meer worden gedaan om haar kans op een goede afloop te vergroten?
De AHA beveelt aan dat systemische trombolyse en CDT worden overwogen bij patiënten met acute submassieve PE als zij klinische aanwijzingen hebben voor een ongunstige prognose, waaronder verslechterende ademhalingsinsufficiëntie, ernstige RV-disfunctie of ernstige myocardiale necrose en een laag risico op bloedingscomplicaties (klasse IIB; Bewijsniveau C).1
De update van de richtlijnen van het American College of Chest Physicians (CHEST) van 20163 beveelt systemisch toegediende trombolytische therapie aan boven geen therapie bij geselecteerde patiënten met acute PE die verslechteren na het starten van antistollingstherapie maar nog geen hypotensie hebben ontwikkeld en die een laag bloedingsrisico hebben (aanbeveling van graad 2C).
Systemische trombolyse
Systemische trombolyse wordt toegediend als een intraveneuze trombolytische infusie die gedurende een bepaalde tijd wordt toegediend. De door de Food and Drug Administration goedgekeurde trombolytica omvatten momenteel weefselplasminogeenactivator (tPA)/alteplase, streptokinase en urokinase.
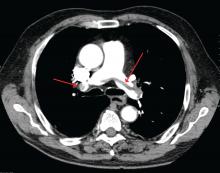 James Heilman, MD (gebruikt onder Creative Commons-licentie)
James Heilman, MD (gebruikt onder Creative Commons-licentie)
Een grote longembolie bij de bifurcatie van de longslagader (zadelembolie).
In de gerandomiseerde, dubbelblinde Pulmonary Embolism-3 Trial van 2002,4 vergeleken Konstantinides en collega’s heparine plus tPA met heparine plus placebo bij 256 patiënten met subassieve PE. Het primaire klinische eindpunt van overlijden of escalatie van zorg in het ziekenhuis was 11,0% in de tPA-groep versus 24,6% in de placebogroep (P = .006); het verschil werd grotendeels veroorzaakt door de escalatie van zorg, gedefinieerd als gebruik van vasopressoren, reddingstrombolyse, mechanische beademing, hartstilstand, en vereiste van chirurgische embolectomie. Het is misschien verrassend dat er in geen van beide groepen gevallen van hemorragische beroerte voorkwamen. De studie toonde aan dat systemische trombolyse bij submassieve PE geassocieerd was met een lager risico op overlijden en escalatie van de behandeling.
De werkzaamheid van lage-dosis trombolyse werd bestudeerd in MOPETT 2013,5 een single-center, prospectieve, gerandomiseerde, open-label studie, waarin 126 deelnemers die submassieve PE bleken te hebben op basis van symptomen en CT-angiografische of ventilatie/perfusiescangegevens, ofwel 50 mg tPA plus heparine ofwel alleen heparine-anticoagulatie kregen. Het samengestelde eindpunt van pulmonale hypertensie en recidiverende PE na 28 maanden was 16% in de tPA-groep vergeleken met 63% in de controlegroep (P minder dan .001). Systemische trombolyse was geassocieerd met een lager risico van pulmonale hypertensie en recidiverende PE, hoewel er geen mortaliteitsvoordeel werd gezien in deze kleine studie.
In de gerandomiseerde, dubbelblinde PEITHO-studie (n = 1.006) van 20146 waarin tenecteplase plus heparine werd vergeleken met heparine bij de subassieve PE-patiënten, deden de primaire uitkomsten van overlijden en hemodynamische decompensatie zich voor bij 2,6% van de tenecteplase-groep, vergeleken met 5,6% in de placebogroep (P = .02). Trombolytische therapie werd geassocieerd met 2% percentage hemorragische beroerte, terwijl het percentage hemorragische beroerte in de placebogroep 0,2% was (P = .03). In dit geval was systemische trombolyse geassocieerd met een 3% lager risico op overlijden en hemodynamische instabiliteit, maar ook met een 1,8% verhoogd risico op hemorragische beroerte.
Catheter-gerichte trombolyse (CDT)
CDT werd oorspronkelijk ontwikkeld voor de behandeling van arteriële, dialysetransplantaat- en diep-veneuze tromboses, maar is nu door de FDA goedgekeurd voor de behandeling van acute submassieve of massale PE.
Er wordt een draad door de embolie geleid en er wordt een multi-hole infusiekatheter geplaatst, waardoor een trombolytisch geneesmiddel gedurende 12-24 uur wordt toegediend. De directe toediening van het geneesmiddel aan de trombus wordt geacht even doeltreffend te zijn als systemische therapie, maar met een lager risico op bloedingen. Als een snellere verwijdering van de trombus nodig is als gevolg van een grote stolsellast en hemodynamische instabiliteit, kunnen mechanische therapieën, zoals fragmentatie en aspiratie, worden gebruikt als aanvulling op CDT. Deze mechanische technieken brengen echter het risico van longslagaderletsel met zich mee en dienen daarom alleen als laatste redmiddel te worden gebruikt. Een ultrasone draad kan aan de multigat infusiekatheter worden toegevoegd om de trombolyse te versnellen door de trombus ultrasoon te onderbreken, een techniek die bekend staat als ultrasone trombolyse (EKOS).7,10
De ULTIMA 2014 trial,8 een kleine, gerandomiseerde, open-label studie van Ultrasound-Assisted Catheter Directed Thrombolysis (USAT, de term kan door elkaar worden gebruikt met EKOS) versus heparine-anticoagulatie alleen bij 59 patiënten, was ontworpen om te onderzoeken of de eerstgenoemde strategie beter was in het verbeteren van de primaire uitkomstmaat RV/LV-ratio bij submassieve PE-patiënten. De gemiddelde vermindering in RV/LV ratio was 0,30 +/- 0,20 in de USAT groep vergeleken met 0,03 +/- 0,16 in de heparine groep (P minder dan .001). Er werd echter geen significant verschil in mortaliteit of bloedingen waargenomen in de groepen bij een follow-up van 90 dagen.
In de PERFECT 2015 Trial,9 een multicenter registry-based studie, werden 101 patiënten prospectief ingeschreven die CDT kregen als eerstelijns therapie voor massale en submassieve PE. Onder patiënten met submassieve PE bleek 97,3% “klinisch succes” te hebben met deze behandeling, gedefinieerd als stabilisatie van de hemodynamica, verbetering van de pulmonale hypertensie en rechterhartspanning, en overleving tot ontslag uit het ziekenhuis. Er waren geen grote bloedingen of intracraniële bloedingen. Subgroepanalyses in deze studie waarbij USAT werd vergeleken met standaard CDT lieten geen significant verschil zien in gemiddelde pulmonale drukveranderingen, gemiddelde trombolytische doses of gemiddelde infusietijden.
Een prospectieve single-arm multicenter trial, SEATTLE II 2015,10 evalueerde de werkzaamheid van EKOS bij een steekproef van 159 patiënten. Patiënten met zowel massale als submassieve PE kregen ongeveer 24 mg tPA toegediend via een katheter gedurende 12-24 uur. Het primaire resultaat van de werkzaamheid was de daling van de RV/LV-ratio gemeten op de CT van de borst ten opzichte van de uitgangswaarde 48 uur na de procedure. De verhouding voor en na de procedure was respectievelijk 1,55 en 1,13 (P minder dan 0,001), wat erop wijst dat EKOS de verwijding van de RV verminderde. Er werden geen intracraniële bloedingen waargenomen en de onderzoekers gaven geen commentaar op langetermijnuitkomsten zoals mortaliteit of levenskwaliteit. De studie werd beperkt door het ontbreken van een vergelijkingsgroep, zoals anticoagulatie met heparine als monotherapie, of systemische trombolyse of standaard CDT.
De behandeling van submassieve PE varieert tussen verschillende instellingen. Er zijn eenvoudigweg niet voldoende gegevens die lage dosis systemische trombolyse, CDT, EKOS, en standaard heparine-anticoagulatie vergelijken om harde aanbevelingen te doen. Sommige onderzoekers menen dat lage-dosis systemische trombolyse waarschijnlijk even goed is als de dure katheter-gebaseerde trombolytische therapieën.11,12 Lage-dosis trombolytische therapie kan worden gevolgd door gebruik van orale directe factor Xa-remmers voor het behoud van de antitrombotische activiteit.13
Bottom line
In onze instelling screent het interventieradiologieteam patiënten die voldoen aan de criteria voor subassieve PE van geval tot geval. We gebruiken pulmonale angiografische gegevens (aard en omvang van de trombus), klinische stabiliteit en analyse van andere comorbide aandoeningen om de beste behandelingsmodaliteit voor een individuele patiënt te bepalen. Ons team geeft de voorkeur aan EKOS voor subassieve PE-patiënten, maar ook voor massieve PE-patiënten en als reddingsprocedure voor patiënten bij wie systemische trombolyse is mislukt.
Tot er meer gegevens beschikbaar zijn om duidelijke richtlijnen te ondersteunen, is het volgens ons verstandig om multidisciplinaire teams samen te stellen, bestaande uit interventieradiologen, intensivisten, cardiologen en vaatchirurgen, om geïndividualiseerde beslissingen te kunnen nemen en de beste resultaten voor onze patiënten te bereiken.14
IVC-filter
Aangezien de patiënte in dit geval al een subzware PE heeft, kan zij een extra stolselbelasting verdragen als haar resterende DVT opnieuw emboliseert? Is er een rol weggelegd voor een IVC-filter?
De implantatie van IVC-filters is de afgelopen 30 jaar sterk toegenomen, zonder kwaliteitsbewijs dat het gebruik ervan rechtvaardigt.15
De 2016 Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report stelt duidelijk: Bij patiënten met acute DVT van het been of PE die worden behandeld met anticoagulantia, wordt het gebruik van een IVC-filter niet aanbevolen (graad 1B).3 Deze aanbeveling is gebaseerd op de bevindingen van het gerandomiseerde Prevention du Risque d’Embolie Pulmonaire par Interruption Cave (PREPIC)-onderzoek,16 en het onlangs gepubliceerde gerandomiseerde PREPIC 2-onderzoek,17 die beide aantonen dat bij anticoagulerende patiënten met PE en DVT de gelijktijdige plaatsing van een IVC-filter gedurende 3 maanden geen recidiverende PE verminderde, inclusief fatale PE.
CHEST-richtlijnen stellen dat een IVC-filter niet routinematig moet worden geplaatst als hulpmiddel bij patiënten met PE en DVT. Hoe zit het echter in de subgroep van patiënten met submassieve of massale PE bij wie nog een PE catastrofaal zou zijn? Klinische gegevens hierover ontbreken.
Deshpande et al. rapporteerden over een serie van zes patiënten met massale PE en cardiopulmonale instabiliteit; alle patiënten kregen een IVC-filter met anticoagulatie. Het resultaat op korte termijn was uitstekend, maar follow-up op lange termijn werd niet verricht.18 Kucher en collega’s meldden dat uit de ICOPER van 2006 bij 11 van de 108 massale PE-patiënten met een systolische arteriële druk van minder dan 90 mm Hg een IVC-filter was geplaatst. Geen van deze 11 patiënten ontwikkelde binnen 90 dagen een recidief PE en 10 van hen overleefden ten minste 90 dagen; plaatsing van een IVC-filter werd geassocieerd met een vermindering van de 90-dagen mortaliteit. In deze studie werd de plaatsing van een IVC-filter volledig beslist door de artsen op verschillende locaties.19 In een studie uit 2012 waarin de fataliteitspercentages werden onderzocht bij 3770 patiënten met acute PE die een pulmonale embolectomie kregen, toonden de gegevens aan dat zowel bij onstabiele als stabiele patiënten de fataliteitspercentages lager waren bij degenen die een IVC-filter kregen.20
Hoewel de bovenstaande gegevens gunstig zijn voor adjunctieve plaatsing van een IVC-filter bij massale PE-patiënten, althans wat betreft de uitkomsten op korte termijn, sluiten de kleine omvang en het gebrek aan randomisatie het opstellen van evidence-based richtlijnen uit. In de CHEST-richtlijnen van 2016 wordt erop gewezen dat, aangezien het onzeker is of er baat is bij het adjunctief plaatsen van een IVC-filter bij anticoagulated patiënten met ernstige PE, in deze specifieke subgroep van patiënten de aanbeveling tegen het plaatsen van een IVC-filter bij patiënten met acute PE die anticoagulated zijn, mogelijk niet van toepassing is.3
Bottom line
Er is geen evidence-based richtlijn over de vraag of IVC-filters adjunctief moeten worden geplaatst bij patiënten met subassief of massaal PE; op basis van consensus onder deskundigen kan het echter gepast zijn om een IVC-filter te plaatsen als adjunct van anticoagulatie bij patiënten met ernstig PE. De beslissing moet individueel worden genomen op basis van de kenmerken van elke patiënt, zijn voorkeuren en de expertise van de instelling.
In ons geval kreeg de patiënt, in de hoop verdere embolische belasting te voorkomen, een IVC-filter de dag na de presentatie. Ondanks het begin van de antistolling met heparine, bleef ze tachycardisch en tachypneïsch, waardoor ze werd doorverwezen voor CDT. Het interventieradiologieteam vond haar geen goede kandidaat, gezien haar aanhoudende vaginale bloedingen en wijdverbreide metastatische uteruscarcinoom. Zij werd overgeschakeld op therapeutische enoxaparine nadat verdere invasieve interventie niet nodig werd geacht. Haar ademhalingsstatus verbeterde niet en er werd begonnen met bilevel positieve luchtwegdruk. Rekening houdend met de terminale aard van haar kanker, koos ze uiteindelijk voor comfort care en overleed kort daarna.
Acknowledgements
De auteurs willen graag Benjamin A. Hohmuth, MD, A. Joseph Layon, MD, en Luis L. Nadal, MD, voor hun beoordeling van het artikel en onschatbare feedback.
Dr. Wenqian Wang, Dr. Vedamurthy, en Dr. Wang zijn gevestigd in de afdeling ziekenhuisgeneeskunde van The Medicine Institute, Geisinger Health System, Danville, Penn. Neem contact op met Dr. Wenqian Wang op .
Key Points
– Gebruik pulmonale angiografische gegevens, klinische stabiliteit, en analyse van andere comorbide aandoeningen om te beslissen wat de beste behandelingsmodaliteit is.
– Ons team geeft de voorkeur aan trombolyse met ultrasound-ondersteuning (EKOS) voor submassieve PE-patiënten, massieve PE-patiënten, en als een reddingsprocedure voor patiënten bij wie systemische trombolyse mislukt.
– Het opzetten van multidisciplinaire teams bestaande uit interventieradiologen, intensivisten, cardiologen en vasculaire chirurgen is verstandig om geïndividualiseerde beslissingen te nemen.
– Het kan aangewezen zijn een IVC-filter te plaatsen als aanvulling op antistolling bij patiënten met ernstige PE.
1. Jaff MR, McMurtry MS, Archer SL, et al. Management of massive and submassive pulmonary embolism, iliofemoral deep vein thrombosis, and chronic thromboembolic pulmonary hypertension: a scientific statement from the American Heart Association. Circulatie. 2011;123:1788-1830.
2. Goldhaber SZ, Visani L, De Rosa M. Acute pulmonary embolism: clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER). Lancet. 1999;353:1386-9.
3. Kearon C, Akl EA, Ornelas J, et al. Antitrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report. Chest. 2016;149:315-52.
4. Konstantinides S, Geibel A, Heusel G, Heinrich F, Kasper W. Management Strategies and Prognosis of Pulmonary Embolism-3 Trial Investigators. Heparine plus alteplase vergeleken met heparine alleen bij patiënten met submassieve longembolie. N Engl J Med. 2002;347:1143-50.
5. Sharifi M, Bay C, Skrocki L, Rahimi F, Mehdipour M, “MOPETT” Investigators. Matige longembolie behandeld met trombolyse (van de “MOPETT” Trial). Am J Cardiol. 2013;111:273-7.
6. Meyer G, Vicaut E, Danays T, et al. Fibrinolyse voor patiënten met intermediair-risico pulmonale embolie. N Engl J Med. 2014;370:1402-11.
7. Kuo WT. Endovasculaire therapie voor acute longembolie. J Vasc Interv Radiol 2012;23:167-79. e164
8. Kucher N, Boekstegers P, Muller OJ, et al. Randomized, controlled trial of ultrasound-assisted catheter-directed thrombolysis for acute intermediate-risk pulmonary embolism. Circulation. 2014;129:479-86.
9. Kuo WT, Banerjee A, Kim PS, et al. Pulmonary Embolism Response to Fragmentation, Embolectomy, and Catheter Thrombolysis (PERFECT): Eerste resultaten van een prospectief multicenter register. Chest. 2015;148:667-73.
10. Piazza G, Hohlfelder B, Jaff MR, et al. A Prospective, Single-Arm, Multicenter Trial of Ultrasound-Facilitated, Catheter-Directed, Low-Dose Fibrinolysis for Acute Massive and Submassive Pulmonary Embolism: De SEATTLE II studie. JACC Cardiovasc Interv. 2015;8:1382-92.
11. Sharifi M. Systemic Full Dose, Half Dose, and Catheter Directed Thrombolysis for Pulmonary Embolism. Wanneer te gebruiken en hoe te kiezen? Curr Treat Options Cardiovasc Med. 2016;18:31.
12. Wang C, Zhai Z, Yang Y, et al. Werkzaamheid en veiligheid van lage dosis recombinant weefseltype plasminogeen activator voor de behandeling van acuut pulmonaal trombo-embolie: een gerandomiseerde, multicenter, gecontroleerde trial. Chest. 2010;137:254-62.
13. Sharifi M, Vajo Z, Freeman W, Bay C, Sharifi M, Schwartz F. Transforming and simplifying the treatment of pulmonary embolism: “safe dose” thrombolysis plus new oral anticoagulants. Lung. 2015;193:369-74.
14. Kabrhel C, Rosovsky R, Channick R, et al. A Multidisciplinary Pulmonary Embolism Response Team: Initial 30-Month Experience With a Novel Approach to Delivery of Care to Patients With Submassive and Massive Pulmonary Embolism. Chest. 2016;150:384-93.
15. Lessne ML, Sing RF. Contrapunt: Do the Benefits Outweigh the Risks for Most Patients Under Consideration for inferior vena cava filters? Nee. Chest. 2016; 150(6):1182-4.
16. De PREPIC Studiegroep. Acht jaar follow-up van patiënten met permanente vena cava filters in de preventie van longembolie: de PREPIC (Prevention du Risque d’Embolie Pulmonaire par Interruption Cave) gerandomiseerde studie. Circulation. 2005;112(3):416-22.
17. Mismetti P, Laporte S, Pellerin O, et al. Effect of a retrievable inferior vena cava filter plus anticoagulation vs. anticoagulation alone on risk of recurrent pulmonary embolism: a randomized clinical trial. JAMA. 2015. 313(16):1627-35.
18. Deshpande KS, Hatem C, Karwa M, et al. The use of inferior vena cava filter as a treatment modality for massive pulmonary embolism. A case series and review of pathophysiology. Respir Med. 2002.96(12):984-9.
19. Kucher N, Rossi E, De Rosa M, et al. Massive Pulmonary embolism. Circulation. 2006;113(4):577-82.
20. Stein P, Matta F. Case Fatality Rate with Pulmonary Embolectomy for Acute Pulmonary Embolism. Am J Med. 2012;125:471-7.