Sagen
En 49-årig morbidt overvægtig kvinde kom til skadestuen med åndenød og udspilet mave. Ved indlæggelsen var hendes blodtryk 100/60 mm Hg med en hjertefrekvens på 110, en respirationsfrekvens på 24 og en pulsoximetrisk saturation (SpO2) på 86 % ved stueluft. Troponin T var forhøjet til 0,3 ng/mL. Computertomografi (CT) af brystkassen med intravenøs kontrast viste en sadelpulmonal emboli (PE) med dilateret højre ventrikel (RV). CT abdomen/pelvis viste en meget stor uterin masse med diffus lymfadenopati.
Heparininfusion blev straks påbegyndt. Ekkokardiografi påviste RV strain. Fund på duplex ultralyd af de nedre ekstremiteter var i overensstemmelse med akut dyb venetrombose (DVT), der involverede den venstre fælles femoralvene og den højre popliteale vene. Biopsi af en supraklavikulær lymfeknude viste højgrads udifferentieret karcinom, der sandsynligvis var af uterin oprindelse.
Kliniske spørgsmål
Hvilke terapeutiske muligheder bør overvejes ud over standard systemisk antikoagulation, hvis der er nogen? Er der en rolle for:
1. Systemisk trombolyse?
2. Kateterstyret trombolyse (CDT)?
3. Placering af IVC-filter?
Hvad er den hensigtsmæssige behandling af “submassiv” PE?
I tilfælde af massiv PE, hvor tromben er placeret i det centrale pulmonale vaskulatur og er forbundet med hypotension på grund af nedsat hjertemængde, er systemisk trombolyse, embolektomi og CDT indiceret som potentielt livreddende foranstaltninger. Derimod er evidensen mindre klar, når PE’en er stor og har ført til RV-belastning, men uden åbenlys hæmodynamisk ustabilitet. Dette er almindeligvis kendt som en intermediær risiko eller “submassiv” PE. Submassiv PE baseret på retningslinjerne fra American Heart Association (AHA) er:1
En akut PE uden systemisk hypotension (systolisk blodtryk mindre end 90 mm Hg), men med enten RV-dysfunktion eller myokardienekrose. RV-dysfunktion er defineret ved tilstedeværelsen af mindst et af følgende:
– RV-dilatation (apikal 4-kammer RV-diameter divideret med LV-diameter større end 0.9) eller RV systolisk dysfunktion på ekkokardiografi;
– RV-dilatation på CT, forhøjelse af BNP (større end 90 pg/mL), forhøjelse af N-terminal pro-BNP (større end 500 pg/mL);
– Elektrokardiografiske ændringer (ny komplet eller ufuldstændig højre grenblok, anteroseptal ST-forhøjelse eller -depression eller anteroseptal T-bølgeinversion).
Myokardienekrose er defineret som forhøjet troponin I (over 0,4 ng/mL) eller forhøjet troponin T (over 0,1 ng/mL).
Hvorfor er submassiv PE af klinisk betydning?
I 1999 viste en analyse af International Cooperative Pulmonary Embolism Registry (ICOPER), at RV-dysfunktion hos PE-patienter var forbundet med en næsten fordobling af 3-måneders mortalitetsrisikoen (hazard ratio 2,0, 1,3-2,9).2 I betragtning af denne øgede risiko kunne man drage den logiske konklusion, at vi er nødt til at behandle submassiv PE mere aggressivt end PE uden RV-belastning. Men vil dette nødvendigvis resultere i et bedre resultat for patienten i betragtning af den 3 % risiko for intrakraniel blødning, der er forbundet med trombolysebehandling?
I det kliniske scenarie ovenfor opfyldte patienten definitionen af submassiv PE. Selv om patienten ikke oplevede systemisk hypotension, havde hun RV-dilatation på CT, RV systolisk dysfunktion på ekko samt et forhøjet Troponin T-niveau. Ud over at starte antikoagulerende behandling, hvad bør der så gøres mere for at øge hendes sandsynlighed for et godt udfald?
AHA anbefaler, at systemisk trombolyse og CDT overvejes til patienter med akut submassiv PE, hvis de har kliniske tegn på ugunstig prognose, herunder forværring af respiratorisk svigt, alvorlig RV-dysfunktion eller større myokardienekrose og lav risiko for blødningskomplikationer (klasse IIB; evidensniveau C).1
Den opdatering af retningslinjerne fra 2016 fra American College of Chest Physicians (CHEST)3 anbefaler systemisk administreret trombolysebehandling frem for ingen behandling hos udvalgte patienter med akut PE, som forværres efter start af antikoagulationsbehandling, men som endnu ikke har udviklet hypotension, og som har en lav blødningsrisiko (anbefaling af grad 2C).
Systemisk trombolyse
Systemisk trombolyse administreres som en intravenøs trombolyseinfusion, der gives over et stykke tid. De trombolytiske lægemidler, der er godkendt af Food and Drug Administration, omfatter i øjeblikket vævsplasminogenaktivator (tPA)/alteplase, streptokinase og urokinase.
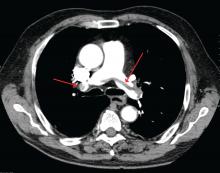 James Heilman, MD (brugt under Creative Commons-licens)
James Heilman, MD (brugt under Creative Commons-licens)
En stor lungeemboli ved bifurkationen af lungearterien (saddelemboli).
I den randomiserede, dobbeltblinde Pulmonary Embolism-3 Trial fra 20024 sammenlignede Konstantinides og kolleger heparin plus tPA med heparin plus placebo hos 256 patienter med submassiv PE. Det primære kliniske endepunkt, død eller optrapning af behandling på hospitalet, var 11,0 % i tPA-gruppen mod 24,6 % i placebogruppen (P = .006); forskellen var i høj grad drevet af optrapning af behandling, defineret som brug af vasopressorer, redningstrombolyse, mekanisk ventilation, hjertestop og krav om kirurgisk embolektomi. Måske overraskende var der ingen tilfælde af hæmorrhagisk slagtilfælde i nogen af disse grupper. Forsøget viste, at systemisk trombolyse ved submassiv PE var forbundet med en lavere risiko for død og behandlingseskalering.
Effektiviteten af lavdosis-trombolyse blev undersøgt i MOPETT 2013,5 et single-center, prospektivt, randomiseret, open label-forsøg, hvor 126 deltagere, der blev fundet at have submassiv PE baseret på symptomer og CT-angiografiske eller ventilations-/perfusionsscanningsdata, modtog enten 50 mg tPA plus heparin eller heparin antikoagulation alene. Det sammensatte endepunkt med pulmonal hypertension og tilbagevendende PE efter 28 måneder var 16 % i tPA-gruppen sammenlignet med 63 % i kontrolgruppen (P mindre end 0,001). Systemisk trombolyse var forbundet med lavere risiko for pulmonal hypertension og tilbagevendende PE, selv om der ikke blev set nogen mortalitetsfordel i denne lille undersøgelse.
I det randomiserede, dobbeltblindede PEITHO-forsøg (n = 1 006) fra 20146 , hvor tenecteplase plus heparin blev sammenlignet med heparin til submassive PE-patienter, forekom de primære udfald, nemlig død og hæmodynamisk dekompensation, hos 2,6 % i tenecteplase-gruppen sammenlignet med 5,6 % i placebogruppen (P = 0,02). Trombolytisk behandling var forbundet med 2 % hyppighed af hæmorrhagisk slagtilfælde, mens hæmorrhagisk slagtilfælde i placebogruppen var 0,2 % (P = .03). I dette tilfælde var systemisk trombolyse forbundet med en 3% lavere risiko for død og hæmodynamisk ustabilitet, men også med en 1,8% øget risiko for hæmoragisk slagtilfælde.
Kateterrettet trombolyse (CDT)
CDT blev oprindeligt udviklet til behandling af arterielle, dialysetransplantater og dybe venetromboer, men er nu godkendt af FDA til behandling af akut submassiv eller massiv PE.
Der føres en ledning gennem embolien, og der placeres et multihulsinfusionskateter, hvorigennem et trombolytisk lægemiddel infunderes i løbet af 12-24 timer. Den direkte tilførsel af lægemidlet til trombus menes at være lige så effektiv som systemisk behandling, men med mindre risiko for blødning. Hvis der er behov for hurtigere fjernelse af trombus på grund af en stor blodprop og hæmodynamisk ustabilitet, kan mekaniske terapier som f.eks. fragmentering og aspiration anvendes som supplement til CDT. Disse mekaniske teknikker indebærer imidlertid en risiko for skade på lungearterien og bør derfor kun anvendes som en sidste udvej. Der kan tilføjes en ultralydsudsende ledning til multihulsinfusionskatetret for at fremskynde trombolysen ved ultralydsforstyrrelse af trombus, en teknik, der er kendt som ultralydsforstærket trombolyse (EKOS).7,10
ULTIMA 2014-forsøget8 , en lille, randomiseret, åben undersøgelse af ultralydsassisteret kateterstyret trombolyse (USAT, udtrykket kan anvendes synonymt med EKOS) versus heparin antikoagulation alene hos 59 patienter, blev designet til at undersøge, om førstnævnte strategi var bedre til at forbedre det primære resultatmål RV/LV-forholdet hos submassive PE-patienter. Den gennemsnitlige reduktion i RV/LV-forholdet var 0,30 +/- 0,20 i USAT-gruppen sammenlignet med 0,03 +/- 0,16 i heparingruppen (P mindre end 0,001). Der blev imidlertid ikke observeret nogen signifikant forskel i mortalitet eller blødning i grupperne ved 90-dages opfølgning.
Den PERFECT 2015 Trial,9 en multicenterregisterbaseret undersøgelse, optog prospektivt 101 patienter, der modtog CDT som førstevalgsbehandling for massiv og submassiv PE. Blandt patienter med submassiv PE blev 97,3 % fundet at have “klinisk succes” med denne behandling, defineret som stabilisering af hæmodynamikken, forbedring af pulmonal hypertension og højre hjertebelastning og overlevelse til udskrivelse fra hospitalet. Der var ingen større blødninger eller intrakranielle blødninger. Subgruppeanalyser i denne undersøgelse, der sammenlignede USAT med standard CDT, afslørede ingen signifikant forskel i gennemsnitlige lungetrykændringer, gennemsnitlige trombolysedoser eller gennemsnitlige infusionstider.
Et prospektivt single-arm multicenterforsøg, SEATTLE II 201510 , evaluerede effekten af EKOS i en stikprøve på 159 patienter. Patienter med både massiv og submassiv PE fik ca. 24 mg tPA infunderet via et kateter over 12-24 timer. Det primære effektresultat var faldet i RV/LV-forholdet målt ved CT af brystkassen fra baseline sammenlignet med 48 timer efter proceduren. Forholdet før og efter proceduren var henholdsvis 1,55 mod 1,13 (P mindre end 0,001), hvilket indikerer, at EKOS mindskede RV-dilatationen. Der blev ikke observeret nogen intrakraniel blødning, og investigatorerne kommenterede ikke på langtidsresultater såsom dødelighed eller livskvalitet. Undersøgelsen var begrænset af manglen på en sammenligningsgruppe, såsom antikoagulation med heparin som monoterapi eller systemisk trombolyse eller standard CDT.
Behandlingen af submassiv PE varierer mellem de forskellige institutioner. Der er simpelthen ikke tilstrækkelige data, der sammenligner lav dosis systemisk trombolyse, CDT, EKOS og standard antikoagulation med heparin, til at der kan gives faste anbefalinger. Nogle investigatorer mener, at lavdosis systemisk trombolyse sandsynligvis er lige så god som de dyre kateterbaserede trombolysebehandlinger.11,12 Lavdosis trombolysebehandling kan efterfølges af brug af orale direkte faktor Xa-hæmmere til opretholdelse af antitrombotisk aktivitet.13
Bottom line
I vores institution screener det interventionelle radiologiske team patienter, der opfylder kriterierne for submassiv PE, på et case-by-case grundlag. Vi bruger pulmonale angiografiske data (trombusens art og omfang), klinisk stabilitet og analyse af andre komorbide tilstande til at afgøre, hvilken behandlingsform der er bedst for den enkelte patient. Vores team foretrækker EKOS til submassive PE-patienter såvel som til massive PE-patienter og som en redningsprocedure til patienter, der har fejlet systemisk trombolyse.
Så længe der ikke foreligger flere data til støtte for faste retningslinjer, mener vi, at det er klogt at oprette tværfaglige teams bestående af interventionsradiologer, intensivister, kardiologer og karkirurgiske læger for at træffe individualiserede beslutninger og opnå de bedste resultater for vores patienter.14
IVC-filter
Da patienten i dette tilfælde allerede har en submassiv PE, kan hun så tolerere en yderligere blodpropbelastning, hvis hendes resterende DVT embolisere igen? Er der en rolle for IVC-filter?
Implantationen af IVC-filtre er steget betydeligt i de sidste 30 år, uden at der foreligger kvalitetsbeviser, der berettiger deres anvendelse.15
The 2016 Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report siger klart og tydeligt: I patienter med akut DVT i benet eller PE, der behandles med antikoagulanter, anbefales det ikke at anvende et IVC-filter (grad 1B).3 Denne anbefaling er baseret på resultaterne af det randomiserede forsøg Prevention du Risque d’Embolie Pulmonaire par Interruption Cave (PREPIC),16 og det nyligt offentliggjorte randomiserede forsøg PREPIC 2,17 der begge viser, at hos antikoagulerede patienter med PE og DVT reducerede samtidig anbringelse af et IVC-filter i 3 måneder ikke tilbagevendende PE, herunder dødelig PE.
CHEST-retningslinjerne angiver, at et IVC-filter ikke rutinemæssigt bør anbringes som et supplement hos patienter med PE og DVT. Men hvad med i undergruppen af patienter med submassiv eller massiv PE, hos hvem endnu en PE ville være katastrofal? Der mangler kliniske data på dette område.
Deshpande et al. rapporterede om en serie på seks patienter med massiv PE og kardiopulmonal ustabilitet; patienterne fik alle et IVC-filter med antikoagulation. Det kortsigtede resultat var fremragende, men der blev ikke foretaget langtidsopfølgning.18 Kucher og kolleger rapporterede fra ICOPER i 2006, at ud af de 108 massive PE-patienter med systolisk arterielt tryk under 90 mm Hg fik 11 patienter supplerende IVC-filterplacering. Ingen af disse 11 patienter udviklede tilbagevendende PE i 90 dage, og 10 af dem overlevede mindst 90 dage; IVC-filterplacering var forbundet med en reduktion i 90-dages mortaliteten. I denne undersøgelse blev placeringen af et IVC-filter udelukkende besluttet af lægerne på de forskellige steder.19 I en undersøgelse fra 2012, der undersøgte dødelighedsprocenten hos 3 770 patienter med akut PE, som fik foretaget en pulmonal embolektomi, viste dataene, at dødelighedsprocenten var lavere hos både ustabile og stabile patienter hos dem, der fik et IVC-filter.20
Og selv om ovenstående data er gunstige for supplerende IVC-filterplacering hos massive PE-patienter, i det mindste med hensyn til kortsigtede resultater, udelukker den lille størrelse og manglen på randomisering, at der kan opstilles evidensbaserede retningslinjer. CHEST-retningslinjerne fra 2016 påpeger, at da det er usikkert, om der er fordele ved at anbringe et IVC-filter adjunktivt hos antikoagulerede patienter med svær PE, gælder anbefalingen mod indsættelse af et IVC-filter hos patienter med akut PE, der er antikoagulerede, muligvis ikke i denne specifikke undergruppe af patienter3 .
Bottom line
Der findes ingen evidensbaseret retningslinje om, hvorvidt IVC-filter bør anbringes adjunktivt hos patienter med submassiv eller massiv PE; baseret på ekspertkonsensus kan det dog være hensigtsmæssigt at anbringe et IVC-filter som supplement til antikoagulation hos patienter med svær PE. Beslutningen bør individualiseres på baggrund af den enkelte patients karakteristika, præferencer og institutionel ekspertise.
I vores tilfælde fik patienten i håb om at forhindre yderligere embolisk belastning et IVC-filter dagen efter præsentationen. Trods iværksættelse af antikoagulation med heparin forblev hun tachykardi og tachypnø, hvilket foranledigede henvisning til CDT. Det interventionelle radiologiske team mente ikke, at hun var en god kandidat på grund af hendes vedvarende vaginalblødning og det bredt metastaserede uteruskarcinom. Hun blev overgået til terapeutisk enoxaparin, da det ikke blev anset for hensigtsmæssigt med yderligere invasiv intervention. Hendes respiratoriske status blev ikke forbedret, og der blev iværksat positivt luftvejstryk på bilevel. Under hensyntagen til den terminale karakter af hendes kræftsygdom valgte hun i sidste ende at fortsætte med komfortpleje og døde kort efter.
Anerkendelser
Forfatterne vil gerne takke Benjamin A. Hohmuth, MD, A. Joseph Layon, MD, og Luis L. Nadal, MD, for deres gennemgang af artiklen og uvurderlig feedback.
Dr. Wenqian Wang, Dr. Vedamurthy og Dr. Wang er baseret i afdelingen for hospitalsmedicin på The Medicine Institute, Geisinger Health System, Danville, Penn. Kontakt Dr. Wenqian Wang på .
Nøglepunkter
– Brug pulmonal angiografiske data, klinisk stabilitet og analyse af andre komorbide tilstande til at beslutte den bedste behandlingsform.
– Vores team foretrækker ultralydsforstærket trombolyse (EKOS) til submassive PE-patienter, massive PE-patienter og som en redningsprocedure for patienter, der ikke kan få systemisk trombolyse.
– Det er klogt at oprette tværfaglige teams bestående af interventionsradiologer, intensivister, kardiologer og karkirurgiske læger for at træffe individualiserede beslutninger.
– Det kan være hensigtsmæssigt at anbringe et IVC-filter som supplement til antikoagulation hos patienter med svær PE.
1. Jaff MR, McMurtry MS, Archer SL, et al. Behandling af massiv og submassiv lungeemboli, iliofemoral dyb venetrombose og kronisk tromboembolisk pulmonal hypertension: en videnskabelig erklæring fra American Heart Association. Circulation. 2011;123:1788-1830.
2. Goldhaber SZ, Visani L, De Rosa M. Acute pulmonary embolism: clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER). Lancet. 1999;353;353:1386-9.
3. Kearon C, Akl EA, Ornelas J, et al. Antithrombotisk behandling af VTE-sygdom: CHEST Guideline and Expert Panel Report. Chest. 2016;149;149:315-52.
4. Konstantinides S, Geibel A, Heusel G, Heinrich F, Kasper W. Management Strategies and Prognosis of Pulmonary Embolism-3 Trial Investigators. Heparin plus alteplase sammenlignet med heparin alene hos patienter med submassiv lungeemboli. N Engl J Med. 2002;347:1143-50.
5. Sharifi M, Bay C, Skrocki L, Rahimi F, Mehdipour M, “MOPETT” Investigators. Moderat lungeemboli behandlet med trombolyse (fra “MOPETT”-forsøget). Am J Cardiol. 2013;111;111:273-7.
6. Meyer G, Vicaut E, Danays T, et al. Fibrinolyse til patienter med intermediær risiko for lungeblodemboli. N Engl J Med. 2014;370;370:1402-11.
7. Kuo WT. Endovaskulær behandling af akut lungeemboli. J Vasc Interv Radiol 2012;23:167-79. e164
8. Kucher N, Boekstegers P, Muller OJ, et al. Randomiseret, kontrolleret forsøg med ultralydsassisteret kateterstyret trombolyse ved akut intermediær risiko for lungeblodemboli. Circulation. 2014;129:479-86.
9. Kuo WT, Banerjee A, Kim PS, et al. Pulmonary Embolism Response to Fragmentation, Embolectomy, and Catheter Thrombolysis (PERFECT): Initial Results From a Prospective Multicenter Registry. Chest. 2015;148:667-73.
10. Piazza G, Hohlfelder B, Jaff MR, et al. A Prospective, Single-Arm, Multicenter Trial of Ultrasound-Facilitated, Catheter-Directed, Low-Dose Fibrinolysis for Acute Massive and Submassive Pulmonary Embolism (Et prospektivt, enarmigt, multicenterforsøg med ultralydsfaciliteret, kateterdirigeret, lavdosisfibrinolyse ved akut massiv og submassiv lungeemboli): The SEATTLE II Study. JACC Cardiovasc Interv. 2015;8:1382-92.
11. Sharifi M. Systemisk fuld dosis, halv dosis og kateterstyret trombolyse ved lungeemboli. Hvornår skal man bruge og hvordan skal man vælge? Curr Treat Options Cardiovasc Med. 2016;18:31.
12. Wang C, Zhai Z, Yang Y, et al. Efficacy and safety of low dose recombinant tissue-type plasminogen activator for the treatment of acute pulmonary thromboembolism: a randomized, multicenter, controlled trial. Chest. 2010;137:254-62.
13. Sharifi M, Vajo Z, Freeman W, Bay C, Sharifi M, Schwartz F. Transforming and simplifying the treatment of pulmonary embolism: “safe dose” thrombolysis plus new oral anticoagulants. Lung. 2015;193:369-74.
14. Kabrhel C, Rosovsky R, Rosovsky R, Channick R, et al. Et multidisciplinært pulmonalemboliberedskab: Initial 30-måneders erfaring med en ny tilgang til levering af pleje til patienter med submassiv og massiv lungeemboli. Chest. 2016;150:384-93.
15. Lessne ML, Sing RF. Counterpoint: Opvejer fordelene risiciene for de fleste patienter, der overvejes til inferior vena cava-filtre? No. Chest. 2016; 150(6):1182-4.
16. PREPIC-undersøgelsesgruppen. Otte års opfølgning af patienter med permanente vena cava-filtre til forebyggelse af lungeemboli: den randomiserede PREPIC-undersøgelse (Prevention du Risque d’Embolie Pulmonaire par Interruption Cave). Circulation. 2005;112(3):416-22.
17. Mismetti P, Laporte S, Pellerin O, et al. Effekten af et genindtageligt inferior vena cava-filter plus antikoagulation vs. antikoagulation alene på risikoen for tilbagevendende lungeemboli: et randomiseret klinisk forsøg. JAMA. 2015. 313(16):1627-35.
18. Deshpande KS, Hatem C, Karwa M, et al. Brugen af inferior vena cava-filter som en behandlingsmodalitet for massiv lungeemboli. En case-serie og gennemgang af patofysiologi. Respir Med. 2002.96(12):984-9.
19. Kucher N, Rossi E, Rossi E, De Rosa M, et al. Massiv lungeemboli. Circulation. 2006;113(4):577-82.
20. Stein P, Matta F. Case Fatality Rate with Pulmonary Embolectomy for Acute Pulmonary Embolism. Am J Med. 2012;125:471-7.