La viscoelasticidad es una propiedad de la sangre humana que se debe principalmente a la energía elástica que se almacena en la deformación de los glóbulos rojos cuando el corazón bombea la sangre a través del cuerpo. La energía transferida a la sangre por el corazón se almacena en parte en la estructura elástica, otra parte se disipa por la viscosidad y la energía restante se almacena en el movimiento cinético de la sangre. Cuando se tiene en cuenta la pulsación del corazón, se hace evidente un régimen elástico. Se ha demostrado que el concepto anterior de la sangre como un fluido puramente viscoso era inadecuado, ya que la sangre no es un fluido ordinario. La sangre puede describirse más exactamente como una suspensión fluidificada de células elásticas (o un sol).
Los glóbulos rojos ocupan aproximadamente la mitad del volumen de la sangre y poseen propiedades elásticas. Esta propiedad elástica es el mayor factor que contribuye al comportamiento viscoelástico de la sangre. El gran porcentaje de volumen de los glóbulos rojos en un nivel normal de hematocrito deja poco espacio para el movimiento y la deformación de las células sin interactuar con una célula vecina. Los cálculos han demostrado que el porcentaje máximo de volumen de los glóbulos rojos sin deformación es del 58%, lo que está en el rango de los niveles que se producen normalmente. Debido al espacio limitado entre los glóbulos rojos, es obvio que para que la sangre fluya, la interacción significativa de célula a célula desempeñará un papel clave. Esta interacción y la tendencia a la agregación de las células contribuyen en gran medida al comportamiento viscoelástico de la sangre. La deformación y la agregación de los glóbulos rojos también van unidas a los cambios inducidos por el flujo en la disposición y la orientación como tercer factor importante en su comportamiento viscoelástico. Otros factores que contribuyen a las propiedades viscoelásticas de la sangre son la viscosidad del plasma, la composición del plasma, la temperatura y la velocidad de flujo o velocidad de cizallamiento. En conjunto, estos factores hacen que la sangre humana sea viscoelástica, no newtoniana y tixotrópica.
Cuando los glóbulos rojos están en reposo o a velocidades de cizallamiento muy pequeñas, tienden a agregarse y apilarse de una manera energéticamente favorable. La atracción se atribuye a los grupos cargados en la superficie de las células y a la presencia de fibrinógeno y globulinas. Esta configuración agregada es una disposición de las células con la menor deformación. Con velocidades de cizallamiento muy bajas, la propiedad viscoelástica de la sangre está dominada por la agregación y la deformabilidad celular es relativamente insignificante. A medida que aumenta la velocidad de cizallamiento, el tamaño de los agregados comienza a disminuir. Con un aumento adicional de la velocidad de cizallamiento, las células se reordenan y orientan para proporcionar canales para el paso del plasma y para el deslizamiento de las células. En este rango de velocidad de cizallamiento de baja a media, las células se menean con respecto a las células vecinas permitiendo el flujo. La influencia de las propiedades de agregación en la viscoelasticidad disminuye y la influencia de la deformabilidad de los eritrocitos comienza a aumentar. A medida que la velocidad de cizallamiento es mayor, los hematíes se estiran o deforman y se alinean con el flujo. Se forman capas de células, separadas por el plasma, y el flujo se atribuye ahora a capas de células que se deslizan sobre capas de plasma. La capa de células permite que la sangre fluya con mayor facilidad y, por tanto, se reduce la viscosidad y la elasticidad. La viscoelasticidad de la sangre está dominada por la deformabilidad de los glóbulos rojos.
Modelo de MaxwellEditar
El Modelo de Maxwell se refiere a los fluidos de Maxwell o al material de Maxwell. El material en el Modelo de Maxwell es un fluido lo que significa que respeta las propiedades de continuidad para las ecuaciones conservativas : Los fluidos son un subconjunto de las fases de la materia e incluyen líquidos, gases, plasmas y, hasta cierto punto, sólidos plásticos. El modelo de Maxwell está hecho para estimar los valores conservativos locales de la viscoelasticidad mediante una medida global en el volumen integral del modelo para ser transpuesto a diferentes situaciones de flujo. La sangre es un material complejo en el que diferentes células, como los glóbulos rojos, son discontinuas en el plasma. Su tamaño y forma también son irregulares porque no son esferas perfectas. Complicando aún más la forma del volumen sanguíneo, los glóbulos rojos no están idénticamente distribuidos en un volumen de muestra de sangre porque migran con gradientes de velocidad en dirección a las áreas de mayor velocidad llamando a la famosa representación del efecto Fåhræus-Lindqvist, se agregan o separan en flujos de vaina o tapón descritos por Thurston. Típicamente, el Modelo Maxwell descrito a continuación está considerando uniformemente el material (color azul uniforme) como un fluido de partículas perfectamente distribuidas en todas partes del volumen (en azul) pero Thurston revela que los paquetes de células rojas, tapones, están más presentes en la región de alta velocidad, si y es la dirección de la altura en la figura del modelo Maxwell, (y~H) y hay una capa de células libres en el área de menor velocidad (y~0) lo que significa que la fase de fluido de plasma que se deforma bajo el Modelo Maxwell se tensa siguiendo revestimientos internos que escapan completamente del modelo analítico por Maxwell.
En teoría, un fluido en un Modelo de Maxwell se comporta exactamente igual en cualquier otra geometría de flujo como tuberías, celdas giratorias o en estado de reposo. Pero en la práctica, las propiedades de la sangre varían con la geometría y la sangre ha demostrado ser un material inadecuado para ser estudiado como un fluido en sentido común. Así que el modelo de Maxwell da tendencias que tienen que ser completadas en la situación real, seguido por el modelo de Thurston en un recipiente con respecto a la distribución de las células en los flujos de vaina y tapón.
Si se considera un pequeño volumen cúbico de sangre, con las fuerzas que actúan sobre él por el bombeo del corazón y las fuerzas de cizallamiento de los límites. El cambio de forma del cubo tendrá 2 componentes:
- Deformación elástica que es recuperable y se almacena en la estructura de la sangre.
- Deslizamiento que se asocia a una entrada continua de energía viscosa.
Cuando se elimina la fuerza, el cubo se recuperaría parcialmente. La deformación elástica se invierte pero el deslizamiento no. Esto explica por qué la parte elástica sólo es perceptible en el flujo inestable. En el flujo estable, el deslizamiento seguirá aumentando y las mediciones de la fuerza no variable en el tiempo despreciarán las contribuciones de la elasticidad.

La figura 1 puede utilizarse para calcular los siguientes parámetros necesarios para la evaluación de la sangre cuando se ejerce una fuerza.
Esfuerzo de cizallamiento: τ = F A {\displaystyle \tau ={frac {F}{A}}

Tensión de corte: γ = D H {\displaystyle \gamma ={frac {D}{H}}

Velocidad de corte: γ ˙ = V H {\displaystyle {\dot {\gamma }}={\frac {V}{H}}

Se utiliza un flujo sinusoidal variable en el tiempo para simular la pulsación de un corazón. Un material viscoelástico sometido a un flujo variable en el tiempo dará lugar a una variación de fase entre τ {\displaystyle \tau }

y γ {\displaystyle \gamma }

representado por ϕ {\displaystyle \phi }

. Si ϕ = 0 {\displaystyle \phi =0}

, el material es puramente elástico porque la tensión y la deformación están en fase, de modo que la respuesta de una causada por la otra es inmediata. Si ϕ {\displaystyle \phi }

= 90°, el material es puramente viscoso porque la deformación va por detrás de la tensión en 90 grados. Un material viscoelástico estará en algún lugar entre 0 y 90 grados.
La variación sinusoidal del tiempo es proporcional a e i ω t {\displaystyle e^{i\omega t}}

. Por lo tanto, la relación de tamaño y fase entre la tensión, la deformación y la velocidad de cizallamiento se describen utilizando esta relación y una frecuencia radial, ω = 2 π f {\displaystyle \omega =2\pi f}

eran f {\displaystyle f}

es la frecuencia en Hertz. Tensión de corte: τ ∗ = τ e – i ϕ {\displaystyle \tau ^{*}=\tau e^{-i\phi }}

Tensión de corte: γ ∗ = γ e – i π 2 {\displaystyle \gamma ^{*}=\gamma e^{-i{\frac {\pi }{2}}}}

Tasa de cizallamiento: γ ˙ ∗ = γ ˙ e – i 0 {\displaystyle {\dot {\gamma }^*}={\dot {\gamma }}e^{-i0}

Las componentes del esfuerzo cortante complejo pueden escribirse como:
τ ∗ = τ ′ – i τ ″ {\displaystyle \tau ^{*}=\tau ‘-i\tau »}

Donde τ ′ {\displaystyle \tau ‘}

es la tensión viscosa y τ ″ {\displaystyle \tau »}

es la tensión elástica.El coeficiente complejo de viscosidad η ∗ {\displaystyle \eta ^{*}}

puede hallarse tomando la relación entre el esfuerzo cortante complejo y la velocidad de corte compleja: η ∗ = τ ∗ γ ˙ ∗ = ( τ ′ γ ˙ + i τ ″ γ ˙ ) = η ′ + i η ″ {\displaystyle \eta ^{*}={\frac {\tau ^{*}}{\dot {\gamma }}^{*}}=({\frac {\tau ‘}{\dot {\gamma }}+i{\frac {\tau »}{\dot {\gamma }})=\eta ‘+i\eta »}

De forma similar, el módulo dinámico complejo G puede obtenerse tomando la relación entre el esfuerzo cortante complejo y la deformación cortante compleja.
G = τ ∗ γ ∗ = ( τ ″ γ + i τ ′ γ ) {\displaystyle G={\frac {\tau ^{*}}{\gamma ^{*}}=({\frac {\tau »}{gamma }}+i{\frac {\tau ‘}{gamma }})}

Relacionando las ecuaciones con términos viscoelásticos comunes obtenemos el módulo de almacenamiento, G’, y el módulo de pérdidas, G».
G = G ′ + i G ″ {\displaystyle G=G’+iG»}

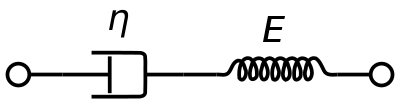
Un modelo de material viscoelástico de Maxwell se utiliza comúnmente para representar las propiedades viscoelásticas de la sangre. Utiliza un amortiguador puramente viscoso y un muelle puramente elástico conectados en serie. El análisis de este modelo da la viscosidad compleja en términos de la constante del amortiguador y la constante del muelle.
η ∗ = η d a s h 1 + i ω ( η d a s h E s p r i n g ) = η ′ – i η ″ {\displaystyle \eta ^{*}={frac {\eta _{dash}}{1+i\omega ({\frac {\eta _{dash}}{E_{spring}})}=\eta ‘-i\eta »}

Modelo Oldroyd-BEdit
Uno de los modelos constitutivos más utilizados para la viscoelasticidad de la sangre es el modelo Oldroyd-B. Existen diversas variaciones del modelo no newtoniano de Oldroyd-B que caracterizan el comportamiento de adelgazamiento por cizallamiento debido a la agregación y dispersión de los glóbulos rojos a baja velocidad de cizallamiento. Aquí consideramos un modelo Oldroyd-B tridimensional acoplado con la ecuación de momento y el tensor de tensión total. Se utiliza un flujo no newtoniano que asegura que la viscosidad de la sangre μ ( h , d ) {\displaystyle \mu (h,d)}

es una función del diámetro del vaso d y del hematocrito h. En el modelo Oldroyd-B, la relación entre el tensor de esfuerzo cortante B y el tensor de esfuerzo de orientación A viene dada por:
S + γ = μ ( h , d ) – g A + C 1 ( g A – C 2 I μ ( h , d ) 2 ) {\displaystyle S+\gamma \left=\mu (h,d)\left-gA+C_{1}left(gA-{frac {{2}I}{\mu (h,d)^{2}}\a la derecha)}

donde D/Dt es la derivada material, V es la velocidad del fluido, C1, C2, g, γ {\displaystyle \gamma }

son constantes. S y B se definen como sigue: S = μ B + g A {\displaystyle S=\mu B+gA}

B = Δ V + ( Δ V ) T {\displaystyle B=\Delta V+(\Delta V)^{T}}

Viscoelasticidad de los glóbulos rojosEditar
Los glóbulos rojos están sometidos a una intensa estimulación mecánica tanto del flujo sanguíneo como de las paredes de los vasos, y sus propiedades reológicas son importantes para su eficacia en el desempeño de sus funciones biológicas en la microcirculación. Se ha demostrado que los glóbulos rojos presentan por sí mismos propiedades viscoelásticas. Hay varios métodos utilizados para explorar las propiedades mecánicas de los glóbulos rojos como:
- aspiración con micropipeta
- micro indentación
- pinzas ópticas
- ensayos de deformación eléctrica de alta frecuencia
Estos métodos funcionaron para caracterizar la deformabilidad de los glóbulos rojos en términos de los módulos de cizallamiento, flexión, expansión de área y tiempos de relajación. Sin embargo, no fueron capaces de explorar las propiedades viscoelásticas. Se han aplicado otras técnicas, como las mediciones fotoacústicas. Esta técnica utiliza un rayo láser de un solo pulso para generar una señal fotoacústica en los tejidos y se mide el tiempo de decaimiento de la señal. Según la teoría de la viscoelasticidad lineal, el tiempo de decaimiento es igual a la relación viscosidad-elasticidad y, por lo tanto, se pueden obtener las características de viscoelasticidad de los glóbulos rojos.
Otra técnica experimental utilizada para evaluar la viscoelasticidad consiste en utilizar perlas de ferromagnetismo adheridas a la superficie de las células. A continuación, se aplican fuerzas a la perla magnética utilizando una citometría de torsión magnética óptica que permitió a los investigadores explorar las respuestas dependientes del tiempo de los glóbulos rojos.
T s ( t ) {\displaystyle T_{s}(t)}

es el par mecánico por unidad de volumen del glóbulo (unidades de tensión) y viene dado por: T s ( t ) = c H cos θ {displaystyle T_{s}(t)=cH\cos \theta }

donde H es el campo magnético de torsión aplicado, θ {\displaystyle {\theta }}

es el ángulo del momento magnético de la perla con respecto a la dirección de magnetización original, y c es la constante de la perla que se encuentra mediante experimentos realizados colocando la perla en un fluido de viscosidad conocida y aplicando un campo de torsión.
El módulo dinámico complejo G puede utilizarse para representar las relaciones entre la tensión y la deformación oscilantes:
G = G ′ + i G ″ {\displaystyle G=G’+iG»}

donde G ′ {\displaystyle G’}

es el módulo de almacenamiento y G ″ {\displaystyle G»}

es el módulo de pérdidas: G ′ = σ 0 ε 0 cos ϕ {\displaystyle G’={frac {\sigma _{0}}{\varepsilon _{0}}\cos \phi }

G ″ = σ 0 ε 0 sin ϕ {\displaystyle G»={frac {\sigma _{0}}{varepsilon _{0}}sin \phi }

donde σ 0 {\displaystyle \sigma _{0}}

y ε 0 {\displaystyle \varepsilon _{0}}

son las amplitudes de la tensión y la deformación y ϕ {\displaystyle \phi }

es el desplazamiento de fase entre ellos.

A partir de las relaciones anteriores, las componentes del módulo complejo se determinan a partir de un bucle que se crea comparando el cambio de par con el cambio de tiempo que forma un bucle cuando se representa gráficamente. Los límites de T s ( t ) {\displaystyle T_{s}(t)}

– d(t) del bucle y el área, A, delimitada por el T s ( t ) {\displaystyle T_{s}(t)}

– d(t), que representa la disipación de energía por ciclo, se utilizan en los cálculos. El ángulo de fase ϕ {\displaystyle \phi }

, el módulo de almacenamiento G’, y el módulo de pérdidas G se convierten entonces en: ϕ = sin – 1 4 A π Δ T s Δ d {\displaystyle \phi =\sin ^{-1}{frac {4A}{pi \Delta T_{s}\Delta d}}

G ′ = Δ T s Δ d cos ϕ {\displaystyle G’={frac {\Delta T_{s}{\Delta d}}cos \phi }

G ″ = Δ T s Δ d sin ϕ = 4 A π ω Δ d 2 {\displaystyle G»={frac {\Delta T_{s}} {\Delta d}sin \phi ={\frac {4A}{pi \omega \Delta d^{2}}}}

donde d es el desplazamiento.
La histéresis mostrada en la figura 3 representa la viscoelasticidad presente en los glóbulos rojos. No está claro si esto está relacionado con las fluctuaciones moleculares de la membrana o con la actividad metabólica controlada por las concentraciones intracelulares de ATP. Se necesitan más investigaciones para explorar a fondo esta interacción y arrojar luz sobre las características de deformación viscoelástica subyacentes de los glóbulos rojos.
Efectos de los vasos sanguíneosEditar
Cuando se examina el comportamiento viscoelástico de la sangre in vivo, es necesario considerar también los efectos de las arterias, los capilares y las venas. La viscosidad de la sangre tiene una influencia primaria en el flujo en las arterias más grandes, mientras que la elasticidad, que reside en la deformabilidad elástica de los glóbulos rojos, tiene una influencia primaria en las arteriolas y los capilares. Comprender la propagación de las ondas en las paredes arteriales, la hemodinámica local y el gradiente de esfuerzo cortante de la pared es importante para entender los mecanismos de la función cardiovascular. Las paredes arteriales son anisotrópicas y heterogéneas, y están compuestas por capas con diferentes características biomecánicas, lo que dificulta mucho la comprensión de las influencias mecánicas que las arterias aportan al flujo sanguíneo.
Razones médicas para una mejor comprensiónEditar
Desde el punto de vista médico, la importancia de estudiar las propiedades viscoelásticas de la sangre se hace evidente. Con el desarrollo de dispositivos protésicos cardiovasculares, como válvulas cardíacas y bombas de sangre, se requiere la comprensión del flujo sanguíneo pulsante en geometrías complejas. Algunos ejemplos concretos son los efectos de la viscoelasticidad de la sangre y sus implicaciones para las pruebas de una bomba sanguínea pulsátil. Se han documentado fuertes correlaciones entre la viscoelasticidad de la sangre y el flujo sanguíneo cerebral regional y global durante el bypass cardiopulmonar.
Esto también ha abierto el camino para el desarrollo de un análogo de la sangre con el fin de estudiar y probar dispositivos protésicos. El análogo clásico de glicerina y agua proporciona una buena representación de la viscosidad y los efectos inerciales, pero carece de las propiedades elásticas de la sangre real. Uno de estos análogos de la sangre es una solución acuosa de goma xantana y glicerina desarrollada para igualar tanto los componentes viscosos como los elásticos de la viscosidad compleja de la sangre.
Los glóbulos rojos normales son deformables, pero muchas condiciones, como la enfermedad de células falciformes, reducen su elasticidad, lo que los hace menos deformables. Los glóbulos rojos con deformabilidad reducida tienen una impedancia creciente al flujo, lo que conduce a un aumento de la agregación de glóbulos rojos y a la reducción de la saturación de oxígeno, lo que puede dar lugar a más complicaciones. La presencia de células con deformabilidad disminuida, como ocurre en la anemia de células falciformes, tiende a inhibir la formación de capas de plasma y midiendo la viscoelasticidad se puede cuantificar el grado de inhibición.
HistoriaEditar
En los primeros trabajos teóricos, la sangre se trataba como un fluido viscoso no newtoniano. Los estudios iniciales habían evaluado la sangre durante el flujo constante y, posteriormente, utilizando el flujo oscilante. El profesor George B. Thurston, de la Universidad de Texas, presentó por primera vez la idea de que la sangre es viscoelástica en 1972. Los estudios anteriores que analizaban la sangre en flujo estacionario mostraban propiedades elásticas insignificantes porque el régimen elástico se almacena en la sangre durante el inicio del flujo y, por tanto, su presencia queda oculta cuando éste alcanza el estado estacionario. Los primeros estudios utilizaron las propiedades encontradas en flujo estacionario para derivar propiedades para situaciones de flujo no estacionario. Los avances en los procedimientos y dispositivos médicos requerían una mejor comprensión de las propiedades mecánicas de la sangre.