Viscoelasticidade é uma propriedade do sangue humano que se deve principalmente à energia elástica que é armazenada na deformação dos glóbulos vermelhos enquanto o coração bombeia o sangue através do corpo. A energia transferida para o sangue pelo coração é parcialmente armazenada na estrutura elástica, outra parte é dissipada pela viscosidade e a energia restante é armazenada no movimento cinético do sangue. Quando a pulsação do coração é levada em consideração, um regime elástico torna-se claramente evidente. Foi demonstrado que o conceito anterior de sangue como um fluido puramente viscoso era inadequado, uma vez que o sangue não é um fluido comum. O sangue pode ser descrito com mais precisão como uma suspensão fluidizada de células elásticas (ou sol).
Os glóbulos vermelhos ocupam cerca de metade do volume de sangue e possuem propriedades elásticas. Esta propriedade elástica é o maior fator que contribui para o comportamento viscoelástico do sangue. A grande percentagem de volume de eritrócitos a um nível normal de hematócrito deixa pouco espaço para o movimento e deformação das células sem interagir com uma célula vizinha. Os cálculos mostraram que a percentagem máxima de volume de eritrócitos sem deformação é de 58%, o que está na faixa de níveis que ocorrem normalmente. Devido ao espaço limitado entre os glóbulos vermelhos, é óbvio que, para que o sangue flua, a interacção significativa de célula para célula desempenhará um papel fundamental. Esta interacção e a tendência das células para agregar é um dos principais factores que contribuem para o comportamento viscoelástico do sangue. A deformação e agregação dos glóbulos vermelhos também está associada a mudanças induzidas pelo fluxo no arranjo e orientação como um terceiro fator importante no seu comportamento viscoelástico. Outros fatores que contribuem para as propriedades viscoelásticas do sangue são a viscosidade plasmática, a composição plasmática, a temperatura e a taxa de fluxo ou de cisalhamento. Juntos, esses fatores tornam o sangue humano viscoelástico, não newtoniano e tixotrópico.
Quando os glóbulos vermelhos estão em repouso ou em taxas de cisalhamento muito pequenas, eles tendem a se agregar e se empilharem juntos de uma forma energeticamente favorável. A atração é atribuída a grupos carregados na superfície das células e à presença de fibrinogênio e globulinas. Esta configuração agregada é um arranjo de células com a menor quantidade de deformação. Com taxas de cisalhamento muito baixas, a propriedade viscoelástica do sangue é dominada pela agregação e a deformabilidade celular é relativamente insignificante. À medida que a taxa de cisalhamento aumenta, o tamanho dos agregados começa a diminuir. Com um novo aumento na taxa de cisalhamento, as células se reorganizam e se orientam para fornecer canais para que o plasma passe e para que as células deslizem. Nesta faixa de baixa a média taxa de cisalhamento, as células se agitam em relação às células vizinhas permitindo o fluxo. A influência das propriedades de agregação sobre a viscoelasticidade diminui e a influência da deformabilidade das células vermelhas começa a aumentar. Quando as taxas de cisalhamento se tornam grandes, os glóbulos vermelhos se esticam ou deformam e se alinham com o fluxo. As camadas celulares são formadas, separadas pelo plasma, e o fluxo é agora atribuído a camadas de células que deslizam sobre camadas de plasma. A camada celular permite um fluxo mais fácil do sangue e, como tal, há uma viscosidade e elasticidade reduzidas. A viscoelasticidade do sangue é dominada pela deformabilidade dos glóbulos vermelhos.
Maxwell modelEdit
Maxwell Model diz respeito aos fluidos Maxwell ou ao material Maxwell. O material no Modelo Maxwell é um fluido, o que significa que ele respeita as propriedades de continuidade para equações conservadoras : Os fluidos são um subconjunto das fases da matéria e incluem líquidos, gases, plasmas e, em certa medida, sólidos plásticos. O modelo Maxwell é feito para estimar valores conservadores locais de viscoelasticidade através de uma medida global no volume integral do modelo a ser transposto para diferentes situações de fluxo. O sangue é um material complexo onde diferentes células como os glóbulos vermelhos são descontínuos no plasma. O seu tamanho e forma também são irregulares porque não são esferas perfeitas. Complicando além disso a forma do volume de sangue, os glóbulos vermelhos não são distribuídos de forma idêntica em um volume de amostra de sangue porque migram com gradientes de velocidade em direção às áreas de maior velocidade chamando a famosa representação do efeito Fåhræus-Lindqvist, agregam ou separam em fluxos de bainha ou tampão descritos por Thurston. Tipicamente, o Modelo Maxwell descrito abaixo é uniformemente considerando o material (cor azul uniforme) como um fluido de partículas perfeitamente distribuído em todo o volume (em azul), mas Thurston revela que pacotes de células vermelhas, tampões, estão mais presentes na região de alta velocidade, se y é a direção da altura na figura do modelo Maxwell, (y~H) e há uma camada de células livres na área de baixa velocidade (y~0) o que significa que a fase do fluido plasmático que deforma sob o Modelo Maxwell é esticada seguindo revestimentos internos que escapam completamente do modelo analítico por Maxwell.
Em teoria, um fluido num Modelo Maxwell comporta-se exactamente da mesma forma em qualquer outra geometria de fluxo como tubos, células rotativas ou em estado de repouso. Mas na prática, as propriedades do sangue variam com a geometria e o sangue tem mostrado ser um material inadequado para ser estudado como um fluido no senso comum. Assim, o Modelo Maxwell dá tendências que têm de ser completadas em situação real, seguido pelo modelo de Thurston num vaso em relação à distribuição de células na bainha e fluxos de tampões.
Se for considerado um pequeno volume cúbico de sangue, com forças sendo atuadas sobre ele pelo bombeamento do coração e forças de cisalhamento a partir dos limites. A mudança na forma do cubo terá 2 componentes:
- Deformação elástica que é recuperável e é armazenada na estrutura do sangue.
- Deslizamento que está associado a uma entrada contínua de energia viscosa.
Quando a força é removida, o cubo se recuperaria parcialmente. A deformação elástica é invertida, mas o deslizamento não é. Isto explica porque a porção elástica só é perceptível em fluxo instável. Em fluxo estável, o escorregamento continuará a aumentar e as medidas de força não variável no tempo negligenciarão as contribuições da elasticidade.

Figure 1 pode ser usado para calcular os seguintes parâmetros necessários para a avaliação do sangue quando uma força é exercida.
Tensão de corte: τ = F A {\displaystyle \tau ={\frac {\F}{A}}}

Tensão de Cisalhamento: γ = D H H {\a1}gamma ={\a1}frac {\a1}

Taxa de Cisalhamento: γ ˙ = V H {\i1}{\i1}displaystyle {\i}={\i1}frac {\i}{\i}

Um fluxo senoidal de tempo variável é usado para simular a pulsação de um coração. Um material viscoelástico sujeito a um fluxo com variação de tempo resultará numa variação de fase entre τ {\displaystyle \displaystyle \displaystyle \displaystyle \displaystyle \displaystyle \displaystyle}

e γ {\i1}displaystyle {\i}gamma

representado por ϕ {\i1}displaystyle {\i}

. Se ϕ = 0 {\\phi =0}

, o material é puramente elástico porque as tensões e tensões estão em fase, de modo que a resposta de uma provocada pela outra é imediata. Se ϕ é ao estilo de um jogo…

= 90°, o material é puramente viscoso porque a deformação fica atrás do stress em 90 graus. Um material viscoelástico estará algures entre 0 e 90 graus.
A variação sinusoidal do tempo é proporcional à e i ω t ^{\i}displaystyle e^{\i}{\i}

. Portanto, a relação de tamanho e fase entre a tensão, deformação e taxa de cisalhamento são descritas usando esta relação e uma frequência radiana, ω = 2 π f {\i1}displaystyle \i}omega =2\i f}

foram f {\i1}displaystyle f

é a frequência em Hertz. Shear Stress: τ ∗ = τ e – i ϕ ^{\i}==tau e^{\i}}

Shear Strain: γ ∗ = γ e – i π 2 {\\i1}gamma ^{\i}=gamma e^{\i}{\i}{\i}frac {\i}{\i}{2}}}}

Taxa de corte: γ ˙ ∗ = γ ˙ e – i 0 {\\i1}}displaystyle {\i0}^{\i0}={\i0}dot {\i0}e^{\i0}

Os componentes da tensão de corte complexa podem ser escritos como:
τ ∗ = τ ′ – i τ ″ ^{\\i}==tau ‘-i=tau ”}

Onde τ ′ {\i1}displaystyle {\i}tau ‘}

é o stress viscoso e τ ″ {\i1}displaystyle {\i}tau ”}

é a tensão elástica. O complexo coeficiente de viscosidade η ∗ ^{\\\i1}eta ^{\i}

pode ser encontrado tomando a razão entre a tensão de cisalhamento complexa e a taxa de cisalhamento complexa: η ∗ = τ ∗ γ γ ˙ ∗ = ( τ ′ γ ˙ ˙ + i τ ″ γ ˙ ) = η ′ + i η ″ ^{\\\i1}={\i1}={\i1}frac “Frac” + “Frac” + “Frac” + “Frac” + “Frac” + “Frac

Simplesmente, o módulo complexo dinâmico G pode ser obtido tomando a razão entre a tensão de cisalhamento complexa e a deformação de cisalhamento complexa.
G = τ ∗ ∗ = ( τ ″ γ γ + i τ ′ γ ) {\displaystyle G={\frac ^{\\gamma ^{\gamma ^{\gamma ^=({\frac ^\gamma ”{\gamma ^+i{\gamma ^frac ^)

Relatando as equações a termos viscoelásticos comuns obtemos o módulo de armazenamento, G’, e o módulo de perda, G”.
G = G ′ + i G ″ {\displaystyle G=G’+iG”}

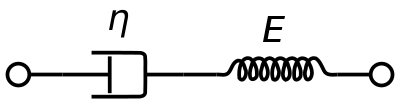
Um modelo de material viscoelástico Maxwell é comumente usado para representar as propriedades viscoelásticas do sangue. Ele usa amortecedor puramente viscoso e uma mola puramente elástica conectada em série. A análise deste modelo dá a viscosidade complexa em termos da constante de traço e da constante de mola.
η ∗ = η d a s h 1 + i ω ( η d a s h E s p r i n g ) = η ′ – i η ″ ^{\i1}={\i}{\i1+i}{\i}}{\i1+i}omega ({\i_frac {\i}}{\i_i_spring}}}=eta ‘-i}eta ”{\i}

Oldroyd-B modelEdit
Um dos modelos constitutivos mais frequentemente utilizados para a viscoelasticidade do sangue é o modelo Oldroyd-B. Existem várias variações do modelo Oldroyd-B não-Newtonian caracterizando o comportamento de desbaste por agregação e dispersão de glóbulos vermelhos a baixa taxa de cisalhamento. Aqui consideramos um modelo de Oldroyd-B tridimensional acoplado à equação de momento e ao tensor de tensão total. Um fluxo não Newtoniano é usado que assegura que a viscosidade do sangue μ ( h , d ) {\i (h,d)}

é uma função do diâmetro do vaso d e hematócrito h. No modelo Oldroyd-B, a relação entre o tensor de tensão de corte B e o tensor de tensão de orientação A é dada por:
S + γ = μ ( h , d ) – g A + C 1 ( g A – C 2 I μ ( h , d ) 2 ) {\i1}displaystyle S+\i}left=\i (h,d){\i}left-gA+C_1}left(gA-{\i}frac {\i}I}{\i}{\i (h,d)^{2}}right)}

onde D/Dt é o material derivado, V é a velocidade do fluido, C1, C2, g, γ {\i1}displaystyle {\i}gamma

são constantes. S e B são definidas da seguinte forma: S = μ B + g A {\\\i1}displaystyle S=\mu B+gA}

B = Δ V + ( Δ V ) T {\i1}displaystyle B=\i}Delta V+(\i}Delta V)^{T}

Viscoelasticidade dos glóbulos vermelhosEditar
Os glóbulos vermelhos são submetidos a intensa estimulação mecânica tanto do fluxo sanguíneo como das paredes dos vasos, e as suas propriedades reológicas são importantes para a sua eficácia no desempenho das suas funções biológicas na microcirculação. Os glóbulos vermelhos por si só demonstraram possuir propriedades viscoelásticas. Existem vários métodos usados para explorar as propriedades mecânicas dos glóbulos vermelhos, como por exemplo:
- aspiração de micropipetas
- inclusão de micropipetas
- pinça óptica
- testes de deformação eléctrica de alta frequência
Estes métodos funcionaram para caracterizar a deformabilidade dos eritrócitos em termos de tempos de cisalhamento, flexão, modulação da área de expansão e relaxamento. No entanto, não foram capazes de explorar as propriedades viscoelásticas. Outras técnicas foram implementadas, tais como medidas fotoacústicas. Esta técnica usa um raio laser de impulso único para gerar um sinal fotoacústico nos tecidos e o tempo de decaimento do sinal é medido. De acordo com a teoria da viscoelasticidade linear, o tempo de decaimento é igual à relação viscosidade-elasticidade e, portanto, as características de viscoelasticidade dos glóbulos vermelhos poderiam ser obtidas.
Outra técnica experimental utilizada para avaliar a viscoelasticidade consistiu na utilização de esferas de Ferromagnetismo ligadas a uma superfície celular. Forças são então aplicadas ao grânulo magnético usando a citometria óptica de torção magnética que permitiu aos pesquisadores explorar as respostas dependentes do tempo dos glóbulos vermelhos.
T s ( t ) {\displaystyle T_{s}(t)}

é o torque mecânico por unidade de volume do grânulo (unidades de tensão) e é dado por: T s ( t ) = c H cos θ {\\i1}(t)=cH\i}cos {\i}cH\i}cH

onde H é o campo de torção magnética aplicada, θ {\\\i1}displaystyle {\i}

é o ângulo do momento magnético do grânulo em relação à direcção de magnetização original, e c é a constante do grânulo que é encontrada por experiências conduzidas colocando o grânulo num fluido de viscosidade conhecida e aplicando um campo de torção.
Complexo O módulo dinâmico G pode ser usado para representar as relações entre a tensão e deformação oscilante:
G = G ′ + i G ″ {\displaystyle G=G’+iG”}

where G ′ {\displaystyle G’}

é o módulo de armazenamento e G ″ {\i1}displaystyle G”}

é o módulo de perda:

G ″ = σ 0 ε 0 sin ϕ {\i1}displaystyle G”={\i}frac {\i}{\i1}{\i1}varepsilon _{\i}sin _\i}

where σ 0 {\i1}displaystyle {\i}sigma _{\i}

e ε 0 {\i1}displaystyle {\i1}varepsilon _{\i}

são as amplitudes do stress e da tensão e ϕ {\phi {\i}

é o deslocamento de fase entre eles.

Das relações acima, os componentes do módulo complexo são determinados a partir de um loop que é criado comparando a mudança de torque com a mudança no tempo que forma um loop quando representado graficamente. Os limites de T s ( t ) {\displaystyle T_{s}(t)}

– d(t) loop and the area, A, bounded by the T s ( t ) {\i}displaystyle T_{s}(t)}

– d(t) loop, que representa a dissipação de energia por ciclo, são usados nos cálculos. O ângulo de fase ϕ
 , módulo de armazenamento G’, e módulo de perda G, então tornam-se: ϕ = sin – 1 4 A π Δ T s Δ d {\i1}displaystyle ^{-1}frac {4A}pi {\i}Delta T_Delta d}}
, módulo de armazenamento G’, e módulo de perda G, então tornam-se: ϕ = sin – 1 4 A π Δ T s Δ d {\i1}displaystyle ^{-1}frac {4A}pi {\i}Delta T_Delta d}}

G ′ = Δ T s Δ d cos ϕ {\i1}displaystyle G’=frac {\i}{\i1}delta T_{\i}delta d}cos {\i}

G ″ = Δ T s Δ d sin ϕ = 4 A π ω Δ d 2 {\i1}displaystyle G”={\i}{\i1}delta T_{\i}{\i}delta d}sin ^{\i}{\i}{\i}{\i}delta d^{\i}delta d^{\i}{\i}d

onde d é o deslocamento.
A histerese mostrada na figura 3 representa a viscoelasticidade presente nos eritrócitos. Não está claro se isto está relacionado com flutuações moleculares de membrana ou atividade metabólica controlada por concentrações intracelulares de ATP. Mais pesquisas são necessárias para explorar completamente estas interações e para esclarecer as características subjacentes da deformação viscoelástica dos glóbulos vermelhos.
Efeitos dos vasos sanguíneosEditar
Ao observar o comportamento viscoelástico do sangue in vivo, é necessário considerar também os efeitos das artérias, capilares e veias. A viscosidade do sangue tem influência primária no fluxo nas artérias maiores, enquanto a elasticidade, que reside na deformabilidade elástica dos glóbulos vermelhos, tem influência primária nas arteríolas e nos capilares. A compreensão da propagação de ondas nas paredes arteriais, da hemodinâmica local e do gradiente de tensão de cisalhamento das paredes é importante para a compreensão dos mecanismos da função cardiovascular. As paredes arteriais são anisotrópicas e heterogêneas, compostas de camadas com diferentes características biomecânicas, o que torna a compreensão das influências mecânicas que as artérias contribuem para o fluxo sanguíneo muito difícil.
Razões médicas para uma melhor compreensãoEditar
Do ponto de vista médico, a importância do estudo das propriedades viscoelásticas do sangue torna-se evidente. Com o desenvolvimento de dispositivos protéticos cardiovasculares como válvulas cardíacas e bombas de sangue, a compreensão do fluxo sanguíneo pulsante em geometrias complexas é necessária. Alguns exemplos específicos são os efeitos da viscoelasticidade do sangue e suas implicações para o teste de uma bomba de sangue pulsátil. Correlações fortes entre a viscoelasticidade do sangue e o fluxo de sangue cerebral regional e global durante a circulação extracorpórea foram documentadas.
Isso também tem liderado o caminho para o desenvolvimento de um análogo de sangue, a fim de estudar e testar dispositivos protéticos. O análogo clássico de glicerina e água fornece uma boa representação da viscosidade e dos efeitos inercial, mas carece das propriedades elásticas do sangue real. Um desses análogos sanguíneos é uma solução aquosa de goma xantana e glicerina desenvolvida para combinar os componentes viscosos e elásticos da viscosidade complexa do sangue.
Os glóbulos vermelhos normais são deformáveis, mas muitas condições, como a doença falciforme, reduzem a sua elasticidade, o que os torna menos deformáveis. Eritrócitos com reduzida deformabilidade têm impedância crescente ao fluxo, levando a um aumento na agregação de eritrócitos e redução da saturação de oxigênio, o que pode levar a complicações adicionais. A presença de células com menor deformabilidade, como é o caso da doença falciforme, tende a inibir a formação de camadas plasmáticas e ao medir a viscoelasticidade, o grau de inibição pode ser quantificado.
HistoryEdit
No trabalho teórico inicial, o sangue foi tratado como um fluido viscoso não newtoniano. Os estudos iniciais tinham avaliado o sangue durante o fluxo constante e mais tarde, usando fluxo oscilante. O Professor George B. Thurston, da Universidade do Texas, apresentou pela primeira vez a ideia de que o sangue era viscoelástico em 1972. Os estudos anteriores que analisaram o sangue em fluxo estável mostraram propriedades elásticas insignificantes porque o regime elástico é armazenado no sangue durante o início do fluxo e, portanto, sua presença é escondida quando um fluxo atinge o estado estável. Os primeiros estudos usaram as propriedades encontradas no fluxo estável para derivar propriedades para situações de fluxo instável. Os avanços nos procedimentos e dispositivos médicos exigiam uma melhor compreensão das propriedades mecânicas do sangue.