Viscoelasticitatea este o proprietate a sângelui uman care se datorează în primul rând energiei elastice care este stocată în deformarea globulelor roșii în timp ce inima pompează sângele prin corp. Energia transferată sângelui de către inimă este parțial stocată în structura elastică, o altă parte este disipată de vâscozitate, iar energia rămasă este stocată în mișcarea cinetică a sângelui. Atunci când se ia în considerare pulsația inimii, un regim elastic devine clar evident. S-a demonstrat că conceptul anterior de sânge ca fiind un fluid pur vâscos era inadecvat, deoarece sângele nu este un fluid obișnuit. Sângele poate fi descris mai exact ca o suspensie fluidizată de celule elastice (sau un sol).
Globulele roșii ocupă aproximativ jumătate din volumul sângelui și posedă proprietăți elastice. Această proprietate elastică este cel mai mare factor care contribuie la comportamentul viscoelastic al sângelui. Procentul mare de volum al globulelor roșii la un nivel normal al hematocritului lasă puțin loc pentru mișcarea și deformarea celulelor fără a interacționa cu o celulă învecinată. Calculele au arătat că procentul maxim de volum al globulelor roșii fără deformare este de 58%, ceea ce se situează în intervalul nivelurilor care apar în mod normal. Din cauza spațiului limitat dintre globulele roșii, este evident că, pentru ca sângele să circule, interacțiunea semnificativă între celule va juca un rol esențial. Această interacțiune și tendința de agregare a celulelor este un factor important care contribuie la comportamentul viscoelastic al sângelui. Deformarea și agregarea celulelor roșii din sânge este, de asemenea, cuplată cu modificările induse de curgere în aranjamentul și orientarea acestora, ca un al treilea factor major în comportamentul său viscoelastic. Alți factori care contribuie la proprietățile viscoelastice ale sângelui sunt vâscozitatea plasmei, compoziția plasmei, temperatura și viteza de curgere sau viteza de forfecare. Împreună, acești factori fac ca sângele uman să fie viscoelastic, nenewtonian și tixotrop.
Când globulele roșii sunt în repaus sau la viteze de forfecare foarte mici, ele tind să se agregheze și să se îngrămădească într-o manieră favorabilă din punct de vedere energetic. Atracția este atribuită grupărilor încărcate de pe suprafața celulelor și prezenței fibrinogenului și globulinelor. Această configurație agregată este un aranjament al celulelor cu cea mai mică cantitate de deformare. La viteze de forfecare foarte mici, proprietatea vâscoelastică a sângelui este dominată de agregare, iar deformabilitatea celulelor este relativ nesemnificativă. Pe măsură ce rata de forfecare crește, dimensiunea agregatelor începe să scadă. Cu o creștere suplimentară a ratei de forfecare, celulele se vor rearanja și se vor orienta pentru a oferi canale prin care plasma să treacă și celulele să alunece. În acest interval de viteză de forfecare mică și medie, celulele se mișcă în raport cu celulele învecinate, permițând curgerea. Influența proprietăților de agregare asupra vâscoelasticitații scade, iar influența deformabilității celulelor roșii începe să crească. Pe măsură ce ratele de forfecare devin mari, globulele roșii se vor întinde sau deforma și se vor alinia cu fluxul. Se formează straturi de celule, separate de plasmă, iar curgerea este acum atribuită unor straturi de celule care alunecă pe straturi de plasmă. Stratul de celule permite o curgere mai ușoară a sângelui și, ca atare, există o vâscozitate redusă și o elasticitate redusă. Viscoelasticitatea sângelui este dominată de deformabilitatea globulelor roșii.
Modelul MaxwellEdit
Modelul Maxwell se referă la fluidele Maxwell sau la materialul Maxwell. Materialul din modelul Maxwell este un fluid, ceea ce înseamnă că respectă proprietățile de continuitate pentru ecuațiile conservative : Fluidele sunt un subset al fazelor materiei și includ lichidele, gazele, plasmele și, într-o anumită măsură, solidele plastice. Modelul Maxwell este realizat pentru a estima valorile conservative locale ale viscoelasticității printr-o măsură globală în volumul integral al modelului pentru a fi transpus la diferite situații de curgere. Sângele este un material complex în care diferite celule, cum ar fi globulele roșii, sunt discontinue în plasmă. Dimensiunea și forma lor sunt și ele neregulate, deoarece nu sunt sfere perfecte. Complicând și mai mult forma volumului de sânge, globulele roșii nu sunt distribuite identic într-un volum de probă de sânge, deoarece migrează cu gradienți de viteză în direcția zonelor cu cea mai mare viteză, ceea ce reprezintă faimoasa reprezentare a efectului Fåhræus-Lindqvist, se agregă sau se separă în fluxurile de tip teacă sau dop descrise de Thurston. În mod obișnuit, modelul Maxwell descris mai jos consideră în mod uniform materialul (culoare albastră uniformă) ca un fluid cu particule perfect distribuite peste tot în volum (în albastru), dar Thurston relevă că pachetele de globule roșii, dopuri, sunt mai prezente în regiunea cu viteză mare, dacă y este direcția înălțimii în figura modelului Maxwell, (y~H) și există un strat de celule libere în zona cu viteză mai mică (y~0) ceea ce înseamnă că faza fluidului de plasmă care se deformează conform modelului Maxwell este tensionată în urma unor garnituri interioare care scapă complet din modelul analitic al lui Maxwell.
În teorie, un fluid într-un model Maxwell se comportă exact în mod similar în orice altă geometrie de curgere, cum ar fi conducte, celule rotative sau în stare de repaus. Dar, în practică, proprietățile sângelui variază în funcție de geometrie și sângele s-a dovedit a fi un material inadecvat pentru a fi studiat ca un fluid în sensul comun. Astfel, modelul Maxwell oferă tendințe care trebuie completate în situația reală, urmate de modelul Thurston într-un vas în ceea ce privește distribuția celulelor în fluxurile de teacă și de dop.
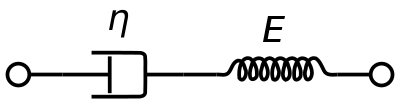
Dacă se consideră un volum cubic mic de sânge, cu forțe care acționează asupra lui prin pomparea inimii și forțele de forfecare de la granițe. Schimbarea formei cubului va avea 2 componente:
- Deformarea elastică care este recuperabilă și este stocată în structura sângelui.
- Dezlipirea care este asociată cu un aport continuu de energie vâscoasă.
Când forța este eliminată, cubul se va recupera parțial. Deformarea elastică este inversată, dar nu și alunecarea. Acest lucru explică de ce porțiunea elastică este vizibilă doar în curgerea instabilă. În curgerea stabilă, alunecarea va continua să crească și măsurătorile forței care nu variază în timp vor neglija contribuțiile elasticității.

Figura 1 poate fi folosită pentru a calcula următorii parametri necesari pentru evaluarea sângelui atunci când se exercită o forță.
Tensiune de forfecare: τ = F A {\displaystyle \tau ={\frac {F}{A}}}}.

Deformație de forfecare: γ = D H {\displaystyle \gamma ={\frac {D}{H}}}.

Viteza de forfecare: γ ˙ = V H {\displaystyle {\dot {\gamma }}={\frac {V}{H}}}.

Un flux sinusoidal care variază în timp este utilizat pentru a simula pulsațiile unei inimi. Un material viscoelastic supus unui flux variabil în timp va avea ca rezultat o variație de fază între τ {\displaystyle \tau }

și γ {\displaystyle \gamma }

reprezentată de ϕ {\displaystyle \phi }

. Dacă ϕ = 0 {\displaystyle \phi =0}

, materialul este unul pur elastic deoarece tensiunea și deformația sunt în fază, astfel încât răspunsul uneia provocat de cealaltă este imediat. Dacă ϕ {\displaystyle \phi }

= 90°, materialul este unul pur vâscos, deoarece deformația întârzie cu 90 de grade în urma tensiunii. Un material vâscoelastic va fi undeva între 0 și 90 de grade.
Variația sinusoidală în timp este proporțională cu e i ω t {\displaystyle e^{i\omega t}}.

. Prin urmare, relația de mărime și fază dintre tensiune, deformație și viteza de forfecare este descrisă folosind această relație și o frecvență radiană, ω = 2 π f {\displaystyle \omega =2\pi f}

au fost f {\displaystyle f}

este frecvența în Hertz. Tensiunea de forfecare: τ ∗ = τ e – i ϕ {\displaystyle \tau ^{*}=\tau e^{-i\phi }}.

Deformație de forfecare: γ ∗ = γ e – i π 2 {\displaystyle \gamma ^{*}=\gamma e^{-i{\frac {\pi }{2}}}}

Rata de forfecare: γ ˙ ∗ = γ ˙ e – i 0 {\displaystyle {\dot {\gamma }}^{*}={\dot {\gamma }}e^{-i0}}

Componentele tensiunii complexe de forfecare pot fi scrise sub forma:
τ ∗ = τ ′ – i τ ″ {\displaystyle \tau ^{*}=\tau ‘-i\tau ”}

Unde τ ′ {\displaystyle \tau ‘}

este tensiunea vâscoasă și τ ″ {\displaystyle \tau ”}

este tensiunea elastică.Coeficientul complex de vâscozitate η ∗ {\displaystyle \eta ^{*}}

poate fi găsit prin luarea raportului dintre tensiunea complexă de forfecare și viteza complexă de forfecare: η ∗ = τ ∗ γ ˙ ∗ = ( τ ′ γ ˙ + i τ ″ γ ˙ ) = η ′ + i η ″ {\displaystyle \eta ^{*}={\frac {\tau ^{*}}}{{\dot {\gamma }}^{*}}}=({\frac {\tau ‘}{\dot {\gamma }}}+i{\frac {\tau ”}{\dot {\gamma }}})=\eta ‘+i\eta ”}

În mod similar, modulul dinamic complex G poate fi obținut prin luarea raportului dintre tensiunea complexă de forfecare și deformația complexă de forfecare.
G = τ ∗ γ ∗ = ( τ ″ γ γ + i τ ′ γ γ ) {\displaystyle G={\frac {\tau ^{*}}}{\gamma ^{*}}}}=({\frac {\tau ”}{\gamma }}+i{\frac {\tau ‘}{\gamma }})} }

Relaționând ecuațiile la termenii viscoelastici obișnuiți obținem modulul de stocare, G’, și modulul de pierdere, G”.
G = G ′ + i G ″ {\displaystyle G=G’+iG”}

Un model de material viscoelastic Maxwell este utilizat în mod obișnuit pentru a reprezenta proprietățile viscoelastice ale sângelui. Acesta utilizează un amortizor pur vâscos și un resort pur elastic conectat în serie. Analiza acestui model oferă vâscozitatea complexă în funcție de constanta amortizorului și de constanta resortului.
η ∗ = η d a s h 1 + i ω ( η d a s h E s p r i n g ) = η ′ – i η ″ {\displaystyle \eta ^{*}={\frac {\eta _{dash}}}{1+i\omega ({\frac {\eta _{dash}}}{E_{spring}}})}}=\eta ‘-i\eta ”}

Modelul Oldroyd-BEdit
Unul dintre cele mai frecvent utilizate modele constitutive pentru viscoelasticitatea sângelui este modelul Oldroyd-B. Există mai multe variante ale modelului newtonian Oldroyd-B care caracterizează comportamentul de subțiere prin forfecare datorat agregării și dispersiei globulelor roșii la o viteză de forfecare mică. Aici considerăm un model Oldroyd-B tridimensional cuplat cu ecuația momentului și tensorul de tensiune totală. Se utilizează o curgere non-newtoniană care asigură că vâscozitatea sângelui μ ( h , d ) {\displaystyle \mu (h,d)}

este o funcție de diametrul vasului d și de hematocritul h. În modelul Oldroyd-B, relația dintre tensorul de tensiune de forfecare B și tensorul de tensiune de orientare A este dată de:
S + γ = μ ( h , d ) – g A + C 1 ( g A – C 2 I μ ( h , d ) 2 ) {\displaystyle S+\gamma \left=\mu (h,d)\left-gA+C_{1}\left(gA-{\frac {C_{2}I}{\mu (h,d)^{2}}}}\right)}

unde D/Dt este derivata materialului, V este viteza fluidului, C1, C2, g, γ {\displaystyle \gamma }

sunt constante. S și B sunt definite după cum urmează: S = μ B + g A {\displaystyle S=\mu B+gA}

B = Δ V + ( Δ V ) T {\displaystyle B=\Delta V+(\Delta V)^{T}}.

Viscoelasticitatea globulelor roșiiEdit
Globulele roșii sunt supuse la o stimulare mecanică intensă atât din partea fluxului sanguin cât și a pereților vaselor, iar proprietățile lor reologice sunt importante pentru eficiența lor în îndeplinirea funcțiilor lor biologice în microcirculație. S-a demonstrat că globulele roșii, prin ele însele, prezintă proprietăți viscoelastice. Există mai multe metode utilizate pentru a explora proprietățile mecanice ale globulelor roșii, cum ar fi:
- aspirația cu micropipeta
- micro indentarea
- pensete optice
- teste de deformare electrică de înaltă frecvență
Aceste metode au lucrat pentru a caracteriza deformabilitatea globulelor roșii în ceea ce privește modulele de forfecare, de încovoiere, de expansiune de suprafață și timpii de relaxare. Cu toate acestea, ele nu au fost capabile să exploreze proprietățile viscoelastice. Au fost implementate alte tehnici, cum ar fi măsurătorile fotoacustice. Această tehnică utilizează un fascicul laser cu un singur impuls pentru a genera un semnal fotoacustic în țesuturi și se măsoară timpul de descreștere al semnalului. Conform teoriei viscoelasticității liniare, timpul de descreștere este egal cu raportul vâscozitate-elasticitate și, prin urmare, s-au putut obține caracteristicile viscoelasticitate ale globulelor roșii.
O altă tehnică experimentală utilizată pentru a evalua viscoelasticitatea a constat în utilizarea de bile de feromagnetism lipite de suprafața celulelor. Forțele sunt apoi aplicate pe bila magnetică folosind citometria optică de răsucire magnetică care a permis cercetătorilor să exploreze răspunsurile în funcție de timp ale globulelor roșii.
T s ( t ) {\displaystyle T_{s}(t)}

este cuplul mecanic pe unitatea de volum al bilei (unități de tensiune) și este dat de: T s ( t ) = c H cos θ {\displaystyle T_{s}(t)=cH\cos \theta }

unde H este câmpul magnetic de torsiune aplicat, θ {\displaystyle {\theta }}

este unghiul momentului magnetic al mărgelelor în raport cu direcția inițială de magnetizare, iar c este constanta mărgelelor care se găsește prin experimente efectuate prin plasarea mărgelelor într-un fluid cu vâscozitate cunoscută și aplicarea unui câmp de torsiune.
Modulul dinamic complex G poate fi utilizat pentru a reprezenta relațiile dintre tensiunea oscilantă și deformația:
G = G ′ + i G ″ {\displaystyle G=G’+iG”}

unde G ′ {\displaystyle G’}

este modulul de stocare și G ″ {\displaystyle G”}

este modulul de pierdere: G ′ = σ 0 ε 0 cos ϕ {\displaystyle G’={\frac {\sigma _{0}}}{\varepsilon _{0}}}}\cos \phi }

G ″ = σ 0 ε 0 sin ϕ {\displaystyle G”={\frac {\sigma _{0}}}{\varepsilon _{0}}}\sin \phi }

unde σ 0 {\displaystyle \sigma _{0}}

și ε 0 {\displaystyle \varepsilon _{0}}

sunt amplitudinile tensiunilor și deformațiilor și ϕ {\displaystyle \phi }

este defazajul dintre ele.

Din relațiile de mai sus, componentele modulului complex sunt determinate dintr-o buclă care este creată prin compararea variației cuplului cu variația în timp, care formează o buclă atunci când este reprezentată grafic. Limitele lui T s ( t ) {\displaystyle T_{s}(t)}

– d(t) bucla și aria, A, delimitată de T s ( t ) {\displaystyle T_{s}(t)}

– d(t) buclă, care reprezintă disiparea de energie pe ciclu, sunt utilizate în calcule. Unghiul de fază ϕ {\displaystyle \phi }

, modulul de stocare G’ și modulul de pierdere G devin atunci: ϕ = sin – 1 4 A π Δ Δ T s Δ d {\displaystyle \phi =\sin ^{-1}{\frac {4A}{\pi \Delta T_{s}\Delta d}}}.

G ′ = Δ T s Δ d cos ϕ {\displaystyle G’={\frac {\Delta T_{s}}}{\Delta d}}\cos \phi }

G ″ = Δ T s Δ d sin ϕ = 4 A π ω Δ d 2 {\displaystyle G”={\frac {\Delta T_{s}}}{\Delta d}}\sin \phi ={\frac {4A}{\pi \omega \Delta d^{2}}}}

unde d este deplasarea.
Histerezisul prezentat în figura 3 reprezintă viscoelasticitatea prezentă în globulele roșii. Nu este clar dacă aceasta este legată de fluctuațiile moleculare ale membranei sau de activitatea metabolică controlată de concentrațiile intracelulare de ATP. Sunt necesare cercetări suplimentare pentru a explora pe deplin aceste interacțiuni și pentru a face lumină asupra caracteristicilor de deformare viscoelastică care stau la baza celulelor roșii din sânge.
Efectele vaselor de sângeEdit
Când se analizează comportamentul viscoelastic al sângelui in vivo, este necesar să se ia în considerare și efectele arterelor, capilarelor și venelor. Vâscozitatea sângelui are o influență primară asupra curgerii în arterele mari, în timp ce elasticitatea, care rezidă în deformabilitatea elastică a globulelor roșii, are o influență primară în arteriole și capilare. Înțelegerea propagării undelor în pereții arteriali, a hemodinamicii locale și a gradientului de tensiune de forfecare a peretelui este importantă pentru înțelegerea mecanismelor funcției cardiovasculare. Pereții arteriali sunt anizotropi și eterogeni, compuși din straturi cu caracteristici biomecanice diferite, ceea ce face foarte dificilă înțelegerea influențelor mecanice cu care arterele contribuie la fluxul sanguin.
Motive medicale pentru o mai bună înțelegereEdit
Din punct de vedere medical, importanța studierii proprietăților viscoelastice ale sângelui devine evidentă. Odată cu dezvoltarea dispozitivelor protetice cardiovasculare, cum ar fi valvele cardiace și pompele de sânge, este necesară înțelegerea curgerii pulsatorii a sângelui în geometrii complexe. Câteva exemple specifice sunt efectele viscoelasticității sângelui și implicațiile sale pentru testarea unei pompe de sânge pulsatile. Au fost documentate corelații puternice între viscoelasticitatea sângelui și fluxul sanguin cerebral regional și global în timpul bypass-ului cardiopulmonar.
Acesta a deschis, de asemenea, calea pentru dezvoltarea unui analog al sângelui în vederea studierii și testării dispozitivelor protetice. Analogul clasic de glicerină și apă oferă o bună reprezentare a vâscozității și a efectelor inerțiale, dar nu are proprietățile elastice ale sângelui real. Un astfel de analog de sânge este o soluție apoasă de gumă Xanthan și glicerină dezvoltată pentru a se potrivi atât cu componentele vâscoase, cât și cu cele elastice ale vâscozității complexe a sângelui.
Globulele roșii normale sunt deformabile, dar multe afecțiuni, cum ar fi boala celulelor secerătoare, le reduc elasticitatea, ceea ce le face mai puțin deformabile. Globulele roșii cu deformabilitate redusă au o impedanță crescândă la curgere, ceea ce duce la o creștere a agregării globulelor roșii și la reducerea saturației de oxigen, ceea ce poate duce la alte complicații. Prezența celulelor cu deformabilitate diminuată, așa cum este cazul în boala celulelor secerătoare, tinde să inhibe formarea straturilor de plasmă și, prin măsurarea viscoelasticității, se poate cuantifica gradul de inhibiție.
IstoricEdit
În primele lucrări teoretice, sângele a fost tratat ca un fluid vâscos newtonian. Studiile inițiale au evaluat sângele în timpul curgerii constante și, mai târziu, folosind curgerea oscilantă. Profesorul George B. Thurston, de la Universitatea din Texas, a prezentat pentru prima dată ideea că sângele este viscoelastic în 1972. Studiile anterioare care au analizat sângele în curgere constantă au arătat proprietăți elastice neglijabile, deoarece regimul elastic este stocat în sânge în timpul inițierii fluxului și, astfel, prezența sa este ascunsă atunci când un flux atinge starea constantă. Primele studii au folosit proprietățile găsite în curgerea constantă pentru a obține proprietăți pentru situațiile de curgere nestaționară. Progresele în procedurile și dispozitivele medicale au necesitat o mai bună înțelegere a proprietăților mecanice ale sângelui.
.