La viscoélasticité est une propriété du sang humain qui est principalement due à l’énergie élastique qui est stockée dans la déformation des globules rouges lorsque le cœur pompe le sang dans le corps. L’énergie transférée au sang par le cœur est partiellement stockée dans la structure élastique, une autre partie est dissipée par la viscosité, et l’énergie restante est stockée dans le mouvement cinétique du sang. Lorsque la pulsation du cœur est prise en compte, un régime élastique devient clairement évident. Il a été démontré que le concept précédent du sang en tant que fluide purement visqueux était inadéquat puisque le sang n’est pas un fluide ordinaire. Le sang peut être décrit plus précisément comme une suspension fluidisée de cellules élastiques (ou un sol).
Les globules rouges occupent environ la moitié du volume du sang et possèdent des propriétés élastiques. Cette propriété élastique est le plus grand facteur contribuant au comportement viscoélastique du sang. Le pourcentage volumique important des globules rouges à un niveau d’hématocrite normal laisse peu de place au mouvement et à la déformation des cellules sans interaction avec une cellule voisine. Les calculs ont montré que le pourcentage maximal de volume des globules rouges sans déformation est de 58%, ce qui est dans la fourchette des niveaux normalement observés. En raison de l’espace limité entre les globules rouges, il est évident que pour que le sang circule, une interaction importante entre les cellules jouera un rôle clé. Cette interaction et la tendance des cellules à s’agréger sont un facteur important du comportement viscoélastique du sang. La déformation et l’agrégation des globules rouges sont également couplées à des changements de disposition et d’orientation induits par l’écoulement, ce qui constitue un troisième facteur majeur du comportement viscoélastique du sang. Les autres facteurs contribuant aux propriétés viscoélastiques du sang sont la viscosité du plasma, sa composition, la température et la vitesse d’écoulement ou taux de cisaillement. Ensemble, ces facteurs rendent le sang humain viscoélastique, non newtonien et thixotropique.
Lorsque les globules rouges sont au repos ou à de très faibles taux de cisaillement, ils ont tendance à s’agréger et à s’empiler d’une manière énergétiquement favorable. Cette attraction est attribuée aux groupes chargés à la surface des cellules et à la présence de fibrinogène et de globulines. Cette configuration agrégée est un arrangement de cellules présentant le moins de déformation possible. Avec des taux de cisaillement très faibles, la propriété viscoélastique du sang est dominée par l’agrégation et la déformabilité des cellules est relativement insignifiante. Lorsque le taux de cisaillement augmente, la taille des agrégats commence à diminuer. Avec une augmentation supplémentaire du taux de cisaillement, les cellules se réarrangent et s’orientent pour former des canaux permettant au plasma de passer et aux cellules de glisser. Dans cette gamme de taux de cisaillement faible à moyen, les cellules se tortillent par rapport aux cellules voisines, permettant ainsi l’écoulement. L’influence des propriétés d’agrégation sur la viscoélasticité diminue et l’influence de la déformabilité des globules rouges commence à augmenter. Lorsque les taux de cisaillement deviennent importants, les globules rouges s’étirent ou se déforment et s’alignent avec le flux. Des couches de cellules se forment, séparées par du plasma, et l’écoulement est maintenant attribué à des couches de cellules glissant sur des couches de plasma. La couche de cellules permet un écoulement plus facile du sang et, de ce fait, la viscosité et l’élasticité sont réduites. La viscoélasticité du sang est dominée par la déformabilité des globules rouges.
Modèle de MaxwellEdit
Le modèle de Maxwell concerne les fluides de Maxwell ou le matériau de Maxwell. Le matériau dans le modèle de Maxwell est un fluide, ce qui signifie qu’il respecte les propriétés de continuité pour les équations conservatives : Les fluides sont un sous-ensemble des phases de la matière et comprennent les liquides, les gaz, les plasmas et, dans une certaine mesure, les solides plastiques. Le modèle de Maxwell est fait pour estimer les valeurs conservatives locales de la viscoélasticité par une mesure globale dans le volume intégral du modèle à transposer à différentes situations d’écoulement. Le sang est un matériau complexe où différentes cellules comme les globules rouges sont discontinues dans le plasma. Leur taille et leur forme sont également irrégulières car elles ne sont pas des sphères parfaites. Compliquant de plus la forme du volume sanguin, les globules rouges ne sont pas distribués de manière identique dans un volume d’échantillon sanguin car ils migrent avec des gradients de vitesse en direction des zones de plus grande vitesse appelant la célèbre représentation de l’effet Fåhræus-Lindqvist, s’agrègent ou se séparent dans des écoulements en gaine ou en bouchon décrits par Thurston. Typiquement, le modèle de Maxwell décrit ci-dessous considère uniformément la matière (couleur bleue uniforme) comme un fluide de particules parfaitement distribuées partout dans le volume (en bleu) mais Thurston révèle que les paquets de globules rouges, les bouchons, sont plus présents dans la région à haute vitesse, si y est la direction de la hauteur dans la figure du modèle de Maxwell, (y~H) et qu’il y a une couche de cellules libres dans la zone à plus basse vitesse (y~0) ce qui signifie que la phase fluide du plasma qui se déforme sous le modèle de Maxwell est déformée suivant des revêtements internes qui échappent complètement au modèle analytique de Maxwell.
En théorie, un fluide dans un modèle de Maxwell se comporte exactement de la même manière dans toute autre géométrie d’écoulement comme des tuyaux, des cellules en rotation ou à l’état de repos. Mais en pratique, les propriétés du sang varient avec la géométrie et le sang s’est révélé être un matériau inadéquat pour être étudié comme un fluide au sens commun. Ainsi, le modèle de Maxwell donne des tendances qui doivent être complétées en situation réelle, suivi par le modèle de Thurston dans un vaisseau concernant la distribution des cellules dans les flux de gaine et de bouchon.
Si l’on considère un petit volume cubique de sang, avec des forces exercées sur lui par le pompage cardiaque et les forces de cisaillement provenant des frontières. Le changement de forme du cube aura 2 composantes :
- La déformation élastique qui est récupérable et est stockée dans la structure du sang.
- Le glissement qui est associé à un apport continu d’énergie visqueuse.
Lorsque la force est supprimée, le cube se rétablirait partiellement. La déformation élastique est inversée mais le glissement ne l’est pas. Cela explique pourquoi la partie élastique n’est perceptible qu’en écoulement instable. Dans un écoulement stable, le glissement continuera à augmenter et les mesures de la force non variable dans le temps négligeront les contributions de l’élasticité.

La figure 1 peut être utilisée pour calculer les paramètres suivants nécessaires à l’évaluation du sang lorsqu’une force est exercée.
Contrainte de cisaillement : τ = F A {\displaystyle \tau ={\frac {F}{A}}}.

Déformation en cisaillement : γ = D H {\displaystyle \gamma ={\frac {D}{H}}}

Taux de cisaillement : γ ˙ = V H {\displaystyle {\dot {\gamma }}={\frac {V}{H}}}

Un écoulement sinusoïdal variant dans le temps est utilisé pour simuler la pulsation d’un cœur. Un matériau viscoélastique soumis à un écoulement variant dans le temps entraînera une variation de phase entre τ {\displaystyle \tau }.

et γ {\displaystyle \gamma }

représentés par ϕ {\displaystyle \phi }

. Si ϕ = 0 {\displaystyle \phi =0}

, le matériau est un matériau purement élastique car la contrainte et la déformation sont en phase, de sorte que la réponse de l’une provoquée par l’autre est immédiate. Si ϕ {\displaystyle \phi }

= 90°, le matériau est un matériau purement visqueux car la déformation est en retard de 90 degrés sur la contrainte. Un matériau viscoélastique se situera quelque part entre 0 et 90 degrés.
La variation sinusoïdale du temps est proportionnelle à e i ω t {\displaystyle e^{i\omega t}}.

. Par conséquent, la relation de taille et de phase entre la contrainte, la déformation et le taux de cisaillement sont décrits en utilisant cette relation et une fréquence radiale, ω = 2 π f {\displaystyle \omega =2\pi f}.

étaient f {\displaystyle f}

est la fréquence en Hertz. Contrainte de cisaillement : τ ∗ = τ e – i ϕ {\displaystyle \tau ^{*}=\tau e^{-i\phi }}.

Contrainte de cisaillement : γ ∗ = γ e – i π 2 {\displaystyle \gamma ^{*}=\gamma e^{-i{\frac {\pi }{2}}}}

Taux de cisaillement : γ ˙ ∗ = γ ˙ e – i 0 {\displaystyle {\dot {\gamma }}^{*}={\dot {\gamma }}e^{-i0}}

Les composantes de la contrainte de cisaillement complexe peuvent être écrites comme:
τ ∗ = τ ′ – i τ ″ {\displaystyle \tau ^{*}=\tau ‘-i\tau »}.

Where τ ′ {\displaystyle \tau ‘}

est la contrainte visqueuse et τ ″ {\displaystyle \tau »}

est la contrainte élastique.Le coefficient complexe de viscosité η ∗ {\displaystyle \eta ^{*}}

peut être trouvé en prenant le rapport entre la contrainte de cisaillement complexe et le taux de cisaillement complexe : η ∗ = τ ∗ γ ˙ ∗ = ( τ ′ γ ˙ + i τ ″ γ ˙ ) = η ′ + i η ″ {\displaystyle \eta ^{*}={frac {\tau ^{*}}{{\dot {\gamma }}^{*}}=({\frac {\tau ‘}{\dot {\gamma }}+i{\frac {\tau »}{\dot {\gamma }})=\eta ‘+i\eta »}

De même, le module dynamique complexe G peut être obtenu en prenant le rapport de la contrainte de cisaillement complexe sur la déformation de cisaillement complexe.
G = τ ∗ γ ∗ = ( τ ″ γ + i τ ′ γ ) {\displaystyle G={\frac {\tau ^{*}}{\gamma ^{*}}=({\frac {\tau »}{\gamma }}+i{\frac {\tau ‘}{\gamma }})}

En rapportant les équations aux termes viscoélastiques courants, on obtient le module de stockage, G’, et le module de perte, G ».
G = G ′ + i G ″ {\displaystyle G=G’+iG »}

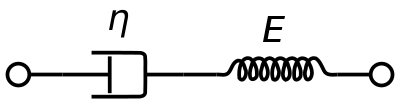
Un modèle de matériau viscoélastique de Maxwell est couramment utilisé pour représenter les propriétés viscoélastiques du sang. Il utilise un amortisseur purement visqueux et un ressort purement élastique connectés en série. L’analyse de ce modèle donne la viscosité complexe en fonction de la constante du dashpot et de la constante du ressort.
η ∗ = η d a s h 1 + i ω ( η d a s h E s p r i n g ) = η ′ – i η ″ {\displaystyle \eta ^{*}={\frac {\eta _{dash}}{1+i\omega ({\frac {\eta _{dash}}{E_{spring}})}}=\eta ‘-i\eta »}.

Modèle Oldroyd-BEdit
Un des modèles constitutifs les plus fréquemment utilisés pour la viscoélasticité du sang est le modèle Oldroyd-B. Il existe plusieurs variantes du modèle non newtonien d’Oldroyd-B caractérisant le comportement d’amincissement par cisaillement dû à l’agrégation et à la dispersion des globules rouges à faible taux de cisaillement. Nous considérons ici un modèle Oldroyd-B tridimensionnel couplé à l’équation de la quantité de mouvement et au tenseur des contraintes totales. Un écoulement non newtonien est utilisé qui assure que la viscosité du sang μ ( h , d ) {\displaystyle \mu (h,d)}

est une fonction du diamètre du vaisseau d et de l’hématocrite h. Dans le modèle Oldroyd-B, la relation entre le tenseur des contraintes de cisaillement B et le tenseur des contraintes d’orientation A est donnée par :
S + γ = μ ( h , d ) – g A + C 1 ( g A – C 2 I μ ( h , d ) 2 ) {\displaystyle S+\gamma \left=\mu (h,d)\left-gA+C_{1}\left(gA-{\frac {C_{2}I}{\mu (h,d)^{2}}}\right)}

où D/Dt est la dérivée de la matière, V est la vitesse du fluide, C1, C2, g, γ {\displaystyle \gamma }.

sont des constantes. S et B sont définis comme suit : S = μ B + g A {\displaystyle S=\mu B+gA}

B = Δ V + ( Δ V ) T {\displaystyle B=\Delta V+(\Delta V)^{T}}

Viscoélasticité des globules rougesEdit
Les globules rouges sont soumis à une stimulation mécanique intense à la fois par le flux sanguin et les parois des vaisseaux, et leurs propriétés rhéologiques sont importantes pour leur efficacité à remplir leurs fonctions biologiques dans la microcirculation. Il a été démontré que les globules rouges eux-mêmes présentent des propriétés viscoélastiques. Il existe plusieurs méthodes utilisées pour explorer les propriétés mécaniques des globules rouges telles que :
- l’aspiration par micropipette
- la micro indentation
- les pinces optiques
- les tests de déformation électrique à haute fréquence
Ces méthodes ont travaillé pour caractériser la déformabilité du globule rouge en termes de modules de cisaillement, de flexion, d’expansion de surface et de temps de relaxation. Cependant, elles n’ont pas permis d’explorer les propriétés viscoélastiques. D’autres techniques ont été mises en œuvre, comme les mesures photoacoustiques. Cette technique utilise un faisceau laser à impulsion unique pour générer un signal photoacoustique dans les tissus et le temps de décroissance du signal est mesuré. Selon la théorie de la viscoélasticité linéaire, le temps de décroissance est égal au rapport viscosité-élasticité et donc les caractéristiques de viscoélasticité des globules rouges ont pu être obtenues.
Une autre technique expérimentale utilisée pour évaluer la viscoélasticité a consisté à utiliser des billes de Ferromagnétisme collées à la surface des cellules. Des forces sont ensuite appliquées à la perle magnétique en utilisant la cytométrie optique de torsion magnétique qui a permis aux chercheurs d’explorer les réponses dépendantes du temps des globules rouges.
T s ( t ) {\displaystyle T_{s}(t)}

est le couple mécanique par unité de volume de billes (unités de contrainte) et est donné par : T s ( t ) = c H cos θ {\displaystyle T_{s}(t)=cH\cos \theta }

où H est le champ de torsion magnétique appliqué, θ {\displaystyle {\theta }}.

est l’angle du moment magnétique de la perle par rapport à la direction d’aimantation originale, et c est la constante de la perle qui est trouvée par des expériences menées en plaçant la perle dans un fluide de viscosité connue et en appliquant un champ de torsion.
Le module dynamique complexe G peut être utilisé pour représenter les relations entre la contrainte et la déformation oscillantes:
G = G ′ + i G ″ {\displaystyle G=G’+iG »}.

où G ′ {\displaystyle G’}

est le module de stockage et G ″ {\displaystyle G »}

est le module de perte : G ′ = σ 0 ε 0 cos ϕ {\displaystyle G’={\frac {\sigma _{0}}{\varepsilon _{0}}\cos \phi }

G ″ = σ 0 ε 0 sin ϕ {\displaystyle G »={\frac {\sigma _{0}}{\varepsilon _{0}}\sin \phi }

where σ 0 {\displaystyle \sigma _{0}}

et ε 0 {\displaystyle \varepsilon _{0}}

sont les amplitudes de la contrainte et de la déformation et ϕ {\displaystyle \phi }

est le déphasage entre elles.

À partir des relations ci-dessus, les composantes du module complexe sont déterminées à partir d’une boucle qui est créée en comparant la variation du couple avec la variation du temps qui forme une boucle lorsqu’elle est représentée graphiquement. Les limites de T s ( t ) {\displaystyle T_{s}(t)}

– d(t) boucle et la zone, A, délimitée par la T s ( t ) {\displaystyle T_{s}(t)}

– d(t) boucle, qui représente la dissipation d’énergie par cycle, sont utilisées dans les calculs. L’angle de phase ϕ {\displaystyle \phi }

, le module de stockage G’ et le module de perte G deviennent alors : ϕ = sin – 1 4 A π Δ T s Δ d {\displaystyle \phi =\sin ^{-1}{\frac {4A}{\pi \Delta T_{s}\Delta d}}.

G ′ = Δ T s Δ d cos ϕ {\displaystyle G’={\frac {\Delta T_{s}}{\Delta d}}\cos \phi }

G ″ = Δ T s Δ d sin ϕ = 4 A π ω Δ d 2 {\displaystyle G »={\frac {\Delta T_{s}}{\Delta d}\sin \phi ={\frac {4A}{pi \omega \Delta d^{2}}}}

où d est le déplacement.
L’hystérésis présentée dans la figure 3 représente la viscoélasticité présente dans les globules rouges. Il n’est pas clair si cela est lié aux fluctuations moléculaires de la membrane ou à l’activité métabolique contrôlée par les concentrations intracellulaires d’ATP. Des recherches supplémentaires sont nécessaires pour explorer pleinement cette interaction et pour faire la lumière sur les caractéristiques de déformation viscoélastique sous-jacentes des globules rouges.
Effets des vaisseaux sanguinsEdit
Lorsque l’on examine le comportement viscoélastique du sang in vivo, il est nécessaire de considérer également les effets des artères, des capillaires et des veines. La viscosité du sang a une influence primordiale sur l’écoulement dans les grosses artères, tandis que l’élasticité, qui réside dans la déformabilité élastique des globules rouges, a une influence primordiale dans les artérioles et les capillaires. La compréhension de la propagation des ondes dans les parois artérielles, de l’hémodynamique locale et du gradient de contrainte de cisaillement dans les parois est importante pour comprendre les mécanismes de la fonction cardiovasculaire. Les parois artérielles sont anisotropes et hétérogènes, composées de couches avec des caractéristiques bio-mécaniques différentes, ce qui rend très difficile la compréhension des influences mécaniques que les artères contribuent à l’écoulement du sang.
Raisons médicales pour une meilleure compréhensionEdit
D’un point de vue médical, l’importance d’étudier les propriétés viscoélastiques du sang devient évidente. Avec le développement de prothèses cardiovasculaires telles que les valves cardiaques et les pompes à sang, la compréhension de l’écoulement sanguin pulsé dans des géométries complexes est nécessaire. Quelques exemples spécifiques sont les effets de la viscoélasticité du sang et ses implications pour le test d’une pompe à sang pulsatile. De fortes corrélations entre la viscoélasticité du sang et le débit sanguin cérébral régional et global pendant une dérivation cardiopulmonaire ont été documentées.
Ceci a également ouvert la voie au développement d’un analogue du sang afin d’étudier et de tester les dispositifs prothétiques. L’analogue classique constitué de glycérine et d’eau fournit une bonne représentation de la viscosité et des effets d’inertie, mais ne possède pas les propriétés élastiques du vrai sang. Un de ces analogues du sang est une solution aqueuse de gomme de xanthane et de glycérine développée pour correspondre à la fois aux composantes visqueuses et élastiques de la viscosité complexe du sang.
Les globules rouges normaux sont déformables mais de nombreuses conditions, comme la drépanocytose, réduisent leur élasticité ce qui les rend moins déformables. Les globules rouges à déformabilité réduite ont une impédance croissante au flux, ce qui entraîne une augmentation de l’agrégation des globules rouges et une réduction de la saturation en oxygène, ce qui peut entraîner d’autres complications. La présence de cellules à déformabilité diminuée, comme c’est le cas dans la drépanocytose, tend à inhiber la formation des couches de plasma et en mesurant la viscoélasticité, le degré d’inhibition peut être quantifié.
HistoriqueModification
Dans les premiers travaux théoriques, le sang était traité comme un fluide visqueux non newtonien. Les premières études avaient évalué le sang pendant un écoulement régulier et, plus tard, en utilisant un écoulement oscillant. Le professeur George B. Thurston, de l’Université du Texas, a présenté pour la première fois l’idée que le sang était viscoélastique en 1972. Les études précédentes qui ont examiné le sang en écoulement constant ont montré des propriétés élastiques négligeables parce que le régime élastique est stocké dans le sang pendant l’initiation de l’écoulement et donc sa présence est cachée lorsqu’un écoulement atteint l’état stable. Les premières études ont utilisé les propriétés trouvées dans un écoulement stable pour dériver des propriétés pour des situations d’écoulement instable. Les progrès des procédures et des dispositifs médicaux ont nécessité une meilleure compréhension des propriétés mécaniques du sang.