La viscoelasticità è una proprietà del sangue umano che è principalmente dovuta all’energia elastica che è immagazzinata nella deformazione dei globuli rossi quando il cuore pompa il sangue attraverso il corpo. L’energia trasferita al sangue dal cuore è parzialmente immagazzinata nella struttura elastica, un’altra parte è dissipata dalla viscosità, e l’energia rimanente è immagazzinata nel movimento cinetico del sangue. Quando si prende in considerazione la pulsazione del cuore, un regime elastico diventa chiaramente evidente. È stato dimostrato che il precedente concetto di sangue come un fluido puramente viscoso era inadeguato, poiché il sangue non è un fluido ordinario. Il sangue può essere descritto più accuratamente come una sospensione fluida di cellule elastiche (o un sol).
I globuli rossi occupano circa la metà del volume del sangue e possiedono proprietà elastiche. Questa proprietà elastica è il fattore che contribuisce maggiormente al comportamento viscoelastico del sangue. La grande percentuale di volume dei globuli rossi ad un livello normale di ematocrito lascia poco spazio al movimento e alla deformazione delle cellule senza interagire con una cellula vicina. I calcoli hanno dimostrato che la percentuale massima di volume dei globuli rossi senza deformazione è del 58%, che è nella gamma dei livelli che si verificano normalmente. A causa dello spazio limitato tra i globuli rossi, è ovvio che per far scorrere il sangue, una significativa interazione tra cellule giocherà un ruolo chiave. Questa interazione e la tendenza delle cellule ad aggregarsi è una delle principali cause del comportamento viscoelastico del sangue. La deformazione e l’aggregazione dei globuli rossi è anche accoppiata ai cambiamenti indotti dal flusso nella disposizione e nell’orientamento come terzo fattore principale nel suo comportamento viscoelastico. Altri fattori che contribuiscono alle proprietà viscoelastiche del sangue sono la viscosità del plasma, la composizione del plasma, la temperatura e la velocità del flusso o velocità di taglio. Insieme, questi fattori rendono il sangue umano viscoelastico, non newtoniano e tissotropico.
Quando i globuli rossi sono a riposo o a velocità di taglio molto piccole, tendono ad aggregarsi e impilarsi insieme in un modo energeticamente favorevole. L’attrazione è attribuita ai gruppi carichi sulla superficie delle cellule e alla presenza di fibrinogeno e globuline. Questa configurazione aggregata è una disposizione delle cellule con la minor quantità di deformazione. Con tassi di taglio molto bassi, la proprietà viscoelastica del sangue è dominata dall’aggregazione e la deformabilità delle cellule è relativamente insignificante. Con l’aumento della velocità di taglio, la dimensione degli aggregati comincia a diminuire. Con un ulteriore aumento della velocità di taglio, le cellule si riorganizzano e si orientano per fornire canali per il passaggio del plasma e per lo scorrimento delle cellule. In questa gamma di velocità di taglio da bassa a media, le cellule si muovono rispetto alle cellule vicine permettendo il flusso. L’influenza delle proprietà di aggregazione sulla viscoelasticità diminuisce e l’influenza della deformabilità dei globuli rossi comincia ad aumentare. Quando la velocità di taglio diventa elevata, i globuli rossi si allungano o si deformano e si allineano al flusso. Si formano strati di cellule, separati dal plasma, e il flusso è ora attribuito a strati di cellule che scivolano su strati di plasma. Lo strato di cellule permette un flusso di sangue più facile e come tale c’è una ridotta viscosità e una ridotta elasticità. La viscoelasticità del sangue è dominata dalla deformabilità dei globuli rossi.
Modello MaxwellModifica
Maxwell Model riguarda i fluidi Maxwell o il materiale Maxwell. Il materiale in Maxwell Model è un fluido, il che significa che rispetta le proprietà di continuità per le equazioni conservative: I fluidi sono un sottoinsieme delle fasi della materia e includono liquidi, gas, plasmi e, in una certa misura, solidi plastici. Il modello Maxwell è fatto per stimare i valori conservativi locali della viscoelasticità con una misura globale nel volume integrale del modello da trasporre a diverse situazioni di flusso. Il sangue è un materiale complesso in cui diverse cellule come i globuli rossi sono discontinue nel plasma. Anche la loro dimensione e forma sono irregolari perché non sono sfere perfette. Complicando inoltre la forma del volume di sangue, i globuli rossi non sono distribuiti in modo identico nel volume di un campione di sangue perché migrano con gradienti di velocità in direzione delle aree a più alta velocità chiamando la famosa rappresentazione dell’effetto Fåhræus-Lindqvist, si aggregano o si separano nei flussi a guaina o a spina descritti da Thurston. Tipicamente, il modello Maxwell descritto di seguito è uniformemente considerando il materiale (colore blu uniforme) come un fluido di particelle perfettamente distribuito ovunque nel volume (in blu) ma Thurston rivela che i pacchetti di globuli rossi, le spine, sono più presenti nella regione ad alta velocità, se y è la direzione dell’altezza nella figura del modello Maxwell, (y~H) e c’è uno strato di cellule libere nella zona di velocità inferiore (y~0) che significa che la fase fluida del plasma che si deforma sotto il modello Maxwell è tesa a seguito di rivestimenti interni che sfuggono completamente dal modello analitico di Maxwell.
In teoria, un fluido in un Modello Maxwell si comporta esattamente in modo simile in qualsiasi altra geometria di flusso come tubi, celle rotanti o in stato di riposo. Ma in pratica, le proprietà del sangue variano con la geometria e il sangue ha dimostrato di essere un materiale inadeguato per essere studiato come un fluido nel senso comune. Quindi il modello di Maxwell fornisce tendenze che devono essere completate nella situazione reale, seguito dal modello di Thurston in una nave per quanto riguarda la distribuzione delle cellule nei flussi di guaine e tappi.
Se si considera un piccolo volume cubico di sangue, con forze agite su di esso dal cuore che pompa e forze di taglio dai confini. Il cambiamento di forma del cubo avrà 2 componenti:
- Deformazione elastica che è recuperabile ed è immagazzinata nella struttura del sangue.
- Slippage che è associato ad un input continuo di energia viscosa.
Quando la forza viene rimossa, il cubo recupererebbe parzialmente. La deformazione elastica è invertita ma lo slittamento no. Questo spiega perché la parte elastica si nota solo nel flusso instabile. In flusso stazionario, lo slittamento continuerà ad aumentare e le misurazioni della forza non variabile nel tempo trascureranno i contributi dell’elasticità.

La figura 1 può essere usata per calcolare i seguenti parametri necessari alla valutazione del sangue quando viene esercitata una forza.
Sforzo di taglio: τ = F A {\displaystyle \tau ={frac {F}{A}}}

Sforzo di taglio: γ = D H {\displaystyle \gamma ={frac {D}{H}}}

Velocità di taglio: γ ˙ = V H {displaystyle \punto {\gamma }={frac {V}{H}}

Un flusso sinusoidale variabile nel tempo è usato per simulare la pulsazione di un cuore. Un materiale viscoelastico sottoposto a un flusso variabile nel tempo provocherà una variazione di fase tra τ {displaystyle \tau }

e γ {displaystyle \gamma }

rappresentato da ϕ {displaystyle \phi }

. Se ϕ = 0 {\displaystyle \phi =0}

, il materiale è un puramente elastico perché la sollecitazione e la deformazione sono in fase, in modo che la risposta di uno causata dall’altro è immediata. Se ϕ {displaystyle \phi }

= 90°, il materiale è puramente viscoso perché la deformazione è in ritardo di 90 gradi rispetto alla sollecitazione. Un materiale viscoelastico sarà da qualche parte tra 0 e 90 gradi.
La variazione sinusoidale del tempo è proporzionale a e i ω t {displaystyle e^{i\omega t}}

. Pertanto, la dimensione e la relazione di fase tra la sollecitazione, la deformazione e la velocità di taglio sono descritte utilizzando questa relazione e una frequenza radiante, ω = 2 π f {\displaystyle \omega =2\pi f}

erano f {displaystyle f}

è la frequenza in Hertz. Sforzo di taglio: τ ∗ = τ e – i ϕ {displaystyle \tau ^{*}=\tau e^{-i\phi }}

Sforzo di taglio: γ ∗ = γ e – i π 2 {displaystyle \gamma ^{*}=\gamma e^{-i{frac {\pi}{2}}}}

Velocità di taglio: γ ˙ ∗ = γ ˙ e – i 0 {\displaystyle {\punto {\gamma }^{*}={\punto {\gamma}e^{-i0}}

Le componenti dello sforzo di taglio complesso possono essere scritte come:
τ ∗ = τ ′ – i τ ″ {\displaystyle \tau ^{*}=\tau ‘-i\tau ”}

dove τ ′ {\displaystyle \tau ‘}

è la sollecitazione viscosa e τ ″ {\displaystyle \tau ”}

è lo stress elastico.Il coefficiente complesso di viscosità η ∗ {displaystyle \eta ^{*}}

può essere trovato prendendo il rapporto tra lo sforzo di taglio complesso e la velocità di taglio complessa: η ∗ = τ ∗ γ ˙ ∗ = ( τ ′ γ ˙ + i τ ″ γ ˙ ) = η ′ + i η ″ {\displaystyle \eta ^{*}={\frac {\tau ^{*}}}{{{punto {\gamma }^{*}}}=({\frac {\tau ‘}{ punto {\gamma }}+i{\frac {\tau ”}{ punto {\gamma }})=\eta ‘+i\eta ”}

Similmente, il modulo dinamico complesso G può essere ottenuto prendendo il rapporto tra lo sforzo di taglio complesso e la deformazione di taglio complessa.
G = τ ∗ γ ∗ = ( τ ″ γ + i τ ′ γ ) {\displaystyle G= {\frac {\tau ^{*}}{\gamma ^{*}}=({\frac {\tau”}{\gamma}+i{\frac {\tau”}{\gamma})}

Relaborando le equazioni ai termini viscoelastici comuni otteniamo il modulo di immagazzinamento, G’, e il modulo di perdita, G”.
G = G ′ + i G ″ {\displaystyle G=G’+iG”}

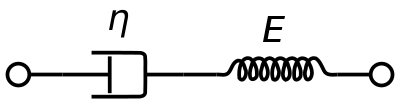
Un modello di materiale viscoelastico Maxwell è comunemente usato per rappresentare le proprietà viscoelastiche del sangue. Utilizza uno smorzatore puramente viscoso e una molla puramente elastica collegati in serie. L’analisi di questo modello dà la viscosità complessa in termini della costante del dashpot e della costante della molla.
η ∗ = η d a s h 1 + i ω ( η d a s h E s p r i n g ) = η ′ – i η ″ {\displaystyle \eta ^{*}={frac {\eta _{dash}}{1+i\omega ({\frac {\eta _{dash}}{E_{spring}}})}}=\eta ‘-i\eta”}

Modello Oldroyd-BEdit
Uno dei modelli costitutivi più utilizzati per la viscoelasticità del sangue è il modello Oldroyd-B. Ci sono diverse varianti del modello non newtoniano Oldroyd-B che caratterizzano il comportamento di assottigliamento da taglio dovuto all’aggregazione e alla dispersione dei globuli rossi a bassa velocità di taglio. Qui consideriamo un modello tridimensionale Oldroyd-B accoppiato con l’equazione della quantità di moto e il tensore di stress totale. Viene utilizzato un flusso non newtoniano che assicura che la viscosità del sangue μ ( h , d ) {\displaystyle \mu (h,d)}

è una funzione del diametro del vaso d e dell’ematocrito h. Nel modello Oldroyd-B, la relazione tra il tensore dello sforzo di taglio B e il tensore dello sforzo di orientamento A è data da:
S + γ = μ ( h , d ) – g A + C 1 ( g A – C 2 I μ ( h , d ) 2 ) {\displaystyle S+\gamma \left=\mu (h,d)\left-gA+C_{1}\left(gA-{\frac {C_{2}I}{\mu (h,d)^{2}}destra)}

dove D/Dt è la derivata del materiale, V è la velocità del fluido, C1, C2, g, γ {displaystyle \gamma }

sono costanti. S e B sono definiti come segue: S = μ B + g A {\displaystyle S=\mu B+gA}

B = Δ V + ( Δ V ) T {\displaystyle B=\Delta V+(\Delta V)^{T}

Viscoelasticità dei globuli rossiModifica
I globuli rossi sono sottoposti a un’intensa stimolazione meccanica sia dal flusso sanguigno che dalle pareti dei vasi, e le loro proprietà reologiche sono importanti per la loro efficacia nello svolgere le loro funzioni biologiche nel microcircolo. È stato dimostrato che i globuli rossi da soli presentano proprietà viscoelastiche. Ci sono diversi metodi utilizzati per esplorare le proprietà meccaniche dei globuli rossi come:
- aspirazione con micropipetta
- micro indentazione
- pinzette ottiche
- prove di deformazione elettrica ad alta frequenza
Questi metodi hanno lavorato per caratterizzare la deformabilità del globulo rosso in termini di taglio, flessione, moduli di espansione dell’area e tempi di rilassamento. Tuttavia, non sono stati in grado di esplorare le proprietà viscoelastiche. Sono state implementate altre tecniche come le misurazioni fotoacustiche. Questa tecnica utilizza un raggio laser a singolo impulso per generare un segnale fotoacustico nei tessuti e si misura il tempo di decadimento del segnale. Secondo la teoria della viscoelasticità lineare, il tempo di decadimento è uguale al rapporto viscosità-elasticità e quindi le caratteristiche di viscoelasticità dei globuli rossi potrebbero essere ottenute.
Un’altra tecnica sperimentale usata per valutare la viscoelasticità consiste nell’usare perline di ferromagnetismo legate alla superficie delle cellule. Le forze vengono poi applicate alla perlina magnetica utilizzando la citometria ottica a torsione magnetica che ha permesso ai ricercatori di esplorare le risposte dipendenti dal tempo dei globuli rossi.
T s ( t ) {\displaystyle T_{s}(t)}

è la coppia meccanica per unità di volume delle sfere (unità di stress) ed è data da: T s ( t ) = c H cos θ {\displaystyle T_{s}(t)=cH\cos \theta }

dove H è il campo magnetico di torsione applicato, θ {displaystyle {\theta }}

è l’angolo del momento magnetico della perlina rispetto alla direzione di magnetizzazione originale, e c è la costante della perlina che viene trovata da esperimenti condotti mettendo la perlina in un fluido di viscosità nota e applicando un campo di torsione.
Il modulo dinamico complesso G può essere usato per rappresentare le relazioni tra lo stress oscillante e la deformazione:
G = G ′ + i G ″ {\displaystyle G=G’+iG”}

dove G ′ {displaystyle G’}

è il modulo di immagazzinamento e G ″ {\displaystyle G”}

è il modulo di perdita: G ′ = σ 0 ε 0 cos ϕ {\displaystyle G’={frac {\sigma _{0}}{{varepsilon _{0}}}cos \phi }

G ″ = σ 0 ε 0 sin ϕ {\displaystyle G”={frac {sigma _{0}}{\varepsilon _{0}}}sin \phi }

dove σ 0 {displaystyle \sigma _{0}}

e ε 0 {displaystyle \varepsilon _{0}}

sono le ampiezze di sollecitazione e di deformazione e ϕ {displaystyle \phi }

è lo spostamento di fase tra loro.

Dalle relazioni di cui sopra, le componenti del modulo complesso sono determinate da un ciclo che si crea confrontando la variazione di coppia con la variazione di tempo che forma un ciclo quando viene rappresentato graficamente. I limiti di T s ( t ) {displaystyle T_{s}(t)}

– d(t) loop e l’area, A, delimitata dal loop T s ( t ) {displaystyle T_{s}(t)}

– d(t) loop, che rappresenta la dissipazione di energia per ciclo, sono utilizzati nei calcoli. L’angolo di fase ϕ {displaystyle \phi }

, modulo di immagazzinamento G’, e modulo di perdita G diventano quindi: ϕ = sin – 1 4 A π Δ T s Δ d {\displaystyle \phi =sin ^{-1}{\frac {4A}{\pi \Delta T_{s}\Delta d}}

G ′ = Δ T s Δ d cos ϕ {\displaystyle G’={frac {\Delta T_{s}{\Delta d}}cos \phi }

G ″ = Δ T s Δ d sin ϕ = 4 A π ω Δ d 2 {\displaystyle G”={frac {\Delta T_{s}}{\Delta d}}sin \phi ={frac {4A}{\pi \omega \Delta d^{2}}}}

dove d è lo spostamento.
L’isteresi mostrata nella figura 3 rappresenta la viscoelasticità presente nei globuli rossi. Non è chiaro se ciò sia legato alle fluttuazioni molecolari di membrana o all’attività metabolica controllata dalle concentrazioni intracellulari di ATP. Ulteriori ricerche sono necessarie per esplorare completamente queste interazioni e per far luce sulle caratteristiche di deformazione viscoelastica sottostante dei globuli rossi.
Effetti dei vasi sanguigniModifica
Quando si guarda al comportamento viscoelastico del sangue in vivo, è necessario considerare anche gli effetti di arterie, capillari e vene. La viscosità del sangue ha un’influenza primaria sul flusso nelle arterie più grandi, mentre l’elasticità, che risiede nella deformabilità elastica dei globuli rossi, ha un’influenza primaria nelle arteriole e nei capillari. Comprendere la propagazione delle onde nelle pareti arteriose, l’emodinamica locale e il gradiente di sforzo di taglio della parete è importante per comprendere i meccanismi della funzione cardiovascolare. Le pareti arteriose sono anisotrope ed eterogenee, composte da strati con diverse caratteristiche bio-meccaniche che rendono molto difficile la comprensione delle influenze meccaniche che le arterie contribuiscono al flusso sanguigno.
Motivi medici per una migliore comprensioneModifica
Dal punto di vista medico, l’importanza di studiare le proprietà viscoelastiche del sangue diventa evidente. Con lo sviluppo di dispositivi protesici cardiovascolari come le valvole cardiache e le pompe per il sangue, è necessaria la comprensione del flusso sanguigno pulsante in geometrie complesse. Alcuni esempi specifici sono gli effetti della viscoelasticità del sangue e le sue implicazioni per il test di una pompa di sangue pulsante. Sono state documentate forti correlazioni tra la viscoelasticità del sangue e il flusso sanguigno cerebrale regionale e globale durante il bypass cardiopolmonare.
Questo ha anche aperto la strada allo sviluppo di un analogo del sangue per studiare e testare dispositivi protesici. L’analogo classico di glicerina e acqua fornisce una buona rappresentazione della viscosità e degli effetti inerziali, ma manca delle proprietà elastiche del sangue reale. Uno di questi analoghi del sangue è una soluzione acquosa di gomma Xanthan e glicerina sviluppata per corrispondere sia ai componenti viscosi che elastici della viscosità complessa del sangue.
I globuli rossi normali sono deformabili ma molte condizioni, come la malattia falciforme, riducono la loro elasticità che li rende meno deformabili. I globuli rossi con deformabilità ridotta hanno un’impedenza crescente al flusso, che porta a un aumento dell’aggregazione dei globuli rossi e a una riduzione della saturazione di ossigeno che può portare a ulteriori complicazioni. La presenza di cellule con deformabilità ridotta, come nel caso della falcemia, tende a inibire la formazione di strati di plasma e misurando la viscoelasticità, il grado di inibizione può essere quantificato.
StoriaModifica
Nei primi lavori teorici, il sangue era trattato come un fluido viscoso non newtoniano. Gli studi iniziali avevano valutato il sangue durante il flusso costante e più tardi, usando il flusso oscillante. Il professor George B. Thurston, dell’Università del Texas, ha presentato per la prima volta l’idea che il sangue fosse viscoelastico nel 1972. Gli studi precedenti che guardavano il sangue in flusso costante mostravano proprietà elastiche trascurabili perché il regime elastico è immagazzinato nel sangue durante l’inizio del flusso e quindi la sua presenza è nascosta quando un flusso raggiunge lo stato stazionario. I primi studi hanno utilizzato le proprietà trovate in flusso stazionario per derivare le proprietà per le situazioni di flusso instabile. I progressi nelle procedure e nei dispositivi medici richiedevano una migliore comprensione delle proprietà meccaniche del sangue.