粘弾性は、主に心臓が血液を全身に送り出す際に赤血球が変形して蓄えられる弾性エネルギーによる人間の血液の特性である。 心臓が血液に伝えるエネルギーは、一部が弾性構造に蓄えられ、別の一部が粘性によって散逸し、残りのエネルギーが血液の運動量に蓄えられる。 心臓の脈動が考慮されると、弾性領域が明らかになる。 血液は普通の流体ではないので、これまでの純粋な粘性流体という概念では不十分であることが示されている。 血液は弾性細胞の流動化した懸濁液(またはゾル)としてより正確に表現できる。
赤血球は血液の体積の約半分を占め、弾性的な性質を持つ。 この弾性的性質が血液の粘弾性挙動に最も大きく寄与している。 通常のヘマトクリット値では赤血球の体積比率が大きいため、隣接する細胞との相互作用なしに細胞が運動したり変形したりする余地はほとんどない。 計算の結果、変形しない赤血球の体積比率は最大で58%であり、これは通常発生するレベルの範囲内である。 赤血球と赤血球の間は狭いので、血液が流れるためには、細胞と細胞の相互作用が重要な役割を果たすことは明らかである。 この相互作用と細胞が凝集する傾向が、血液の粘弾性挙動に大きく寄与している。 赤血球の変形や凝集は、その粘弾性挙動における第三の主要な要因として、流動に起因する配列や配向の変化とも結びついている。 その他、血漿粘度、血漿組成、温度、流動速度(せん断速度)が血液の粘弾性特性に寄与している。
赤血球が静止しているとき、あるいはせん断速度が非常に小さいときには、エネルギー的に有利な方法で凝集して積み重なる傾向がある。 この引力は細胞表面の荷電基とフィブリノーゲンおよびグロブリンの存在に起因する。 この凝集した構成は、変形が最も少ない細胞の配置である。 非常に低いせん断速度では、血液の粘弾性特性は凝集に支配され、細胞の変形能は比較的軽微である。 せん断速度が大きくなるにつれて、凝集体の大きさは小さくなり始める。 さらにせん断速度を上げると、血漿が通過するためのチャンネルと細胞が滑るためのチャンネルを提供するために、細胞は再配列し、配向する。 この低から中程度のせん断速度域では、細胞は隣接する細胞に対してくねくねと動き、流れを可能にする。 粘弾性に対する凝集特性の影響は減少し、赤血球の変形能の影響が大きくなり始める。 せん断速度が大きくなると、赤血球は伸びたり変形したりして、流れに沿うようになる。 細胞層が形成され、血漿によって分離され、流れは血漿の層の上を細胞の層が滑ることに起因するようになった。 細胞層によって血液が流れやすくなるため、粘度が低下し、弾力性も低下する。
Maxwell modelEdit
Maxwell ModelはMaxwell流体またはMaxwell材料に関するものである。 Maxwell Model の材料は流体であり、保存方程式に対する連続性の特性を尊重することを意味する。 流体は、物質の相のサブセットであり、液体、気体、プラズマ、そしてある程度はプラスチック固体を含んでいます。 Maxwellモデルは、粘弾性の局所的な保存値を、モデルの積分体積におけるグローバルな尺度によって推定し、異なる流れの状況に転嫁できるように作られている。 血液は、赤血球のような異なる細胞が血漿中で不連続に存在する複雑な物質である。 赤血球は完全な球体ではないので、その大きさや形も不規則です。 さらに血液の体積形状を複雑にしているのは、赤血球が血液サンプルの体積中に一様に分布していないことです。赤血球は、Fåhræus-Lindqvist効果として有名な速度勾配を持って最高速度領域へ移動し、Thurstonが説明したシース流れやプラグ流れの中で凝集または分離するからです。 一般に、後述のMaxwellモデルは、物質(一様な青色)を体積のいたるところに完全な分布粒子流体として一様に考えているが、Thurstonは、Maxwellモデル図の高さ方向をyとすると、(y〜H)、低速領域に自由細胞層(y〜0)があり、高速領域に赤血球、プラグ、より存在することを示している、これはMaxwellモデルの下で変形するプラズマ液相が内張りに従ってひずみ、Maxwellによる解析モデルから完全に逃げていることを意味する。
理論的には、Maxwellモデル中の流体は、パイプ、回転する細胞、静止状態など他の流れの形状でも全く同じように振舞う。 しかし実際には、血液の性質は形状によって異なり、血液は常識的に考えて流体として研究するには不適切な物質であることが分かっています。 そこで、Maxwellモデルは、実際の状況で完成させなければならない傾向を与え、次に血管内のThurstonモデルは、鞘流と栓流における細胞の分布に関して与える。
小さな立方体の血液体積を考える場合、心臓のポンプ作用と境界からのずり力によってそれに作用する力がある。 立方体の形状の変化には2つの要素がある:
- 回復可能で血液の構造に保存される弾性変形。
- 粘性エネルギーの継続的な入力に関連する滑り。 弾性変形は元に戻るが、滑りは元に戻らない。 このことは、弾性部分が非定常流においてのみ顕著であることを説明する。
図1-弾性と粘性の影響による変位
図1を用いて、力が加わったときの血液の評価に必要な以下のパラメータを計算することができる。
Shear Stress: τ = F A {displaystyle \tau ={frac {F}{A}}}。
Shear Strain: γ = D H {displaystyle \gamma ={frac {D}{H}}}}.
Shear Rate: γ˙ = V H {displaystyle {\dot { γgamma }}={Аfrac {V}}{H}}} 。
正弦波時間変化流を用いて、心臓の脈動をシミュレーションする。 粘弾性体に時間変化する流れを与えると、τ {displaystyle \tau }の間の位相変動が生じます。
and γ {displaystyle \gamma } }.
で表されるφ{displaystyle \phi }。
. If ϕ = 0 {displaystyle \phi =0} 。
の場合、応力とひずみが同相なので、材料は純弾性であり、一方による応答は即座に起こります。 もし、φ {\displaystyle ˶ˆ꒳ˆ˵ )
= 90°の場合、ひずみが応力に90°遅れるため、材料は純粋な粘性体である。 粘弾性材料は0度と90度の間のどこかにあることになる。
正弦波時間変化はe i ω t {displaystyle e^{iomega t}} に比例します。
. したがって、応力、ひずみ、せん断速度の大小関係、位相関係は、この関係とラジアン周波数、ω = 2 π f {displaystyle \ =2pi f} を用いて記述されることになる。
were f {displaystyle f}.
は周波数(ヘルツ)である。 Shear Stress: τ ∗ = τ e – i ϕ {displaystyle \tau ^{*}=\tau e^{-i}phi }}
Shear Strain: γ∗ = γ e – i π 2 {}displaystyle \gamma ^{*}=gamma e^{-i{thefrac {pi }{2}}}} γ – i π {}displaystyle γ e – i π {}=gamma …
Shear Rate: ˙∗ = γ˙ e – i 0 {displaystyle {dot {Gamma }}^{*}={dot {Gamma }}e^{-i0}} }.
複素せん断応力の成分は次のように書ける:
τ ∗ = τ ′ – i τ ″ {displaystyle \tau ^{*}=tau ‘-i ◇tau ”}.
Where τ ′ {displaystyle \tau ‘}.
は粘性応力、 τ ″ {displaystyle \tau ”} は粘性応力。
は弾性応力。複素粘性係数 η∗ {displaystyle \eta ^{*}} は弾性応力。
は複素せん断応力と複素せん断速度の比をとることによって求められる。 η∗ = τ γ∗ ˙ ∗ = ( τ′γ ˙ + i τ ″γ ˙ ) = η′ + i η ″ {displaystyle \eta ^{*}={frac {tau ^{*}}{{dot {Gamma }}^{*}}=({}frac {Tau ‘}{dot {Gamma }}+i{frac {Tau ”}{dot {Gamma }})=Tau ‘+i}
同様に、複素動的弾性率Gは複素せん断応力と複素せん断ひずみの比をとることによって求めることができる。
G = τ ∗ γ∗ = ( τ ″ γ + i τ′ γ ) {displaystyle G=({frac {Tau ^{*}}{Gamma ^{*}}}=({frac {Tau ”}{Gamma }}+i{frac {Tau ‘}{Gamma }})
式を一般的な粘弾性項に置き換えると、貯蔵弾性率G’と損失弾性率G “が得られます。
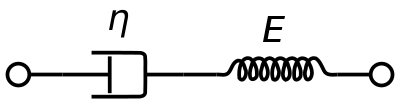 図2-ダッシュポット1個とばね1個の直列接続によるMaxwellモデルの概略
図2-ダッシュポット1個とばね1個の直列接続によるMaxwellモデルの概略G = G′ + i G″ {displaystyle G=G’+iG”}
G = G′ + i G″ {displaystyle G=G’+iG”}
血液の粘弾性特性を表すには、粘弾性マクスウェル材料モデルがよく使われます。 これは純粘性ダンパーと純弾性スプリングを直列に接続したものである。 このモデルを解析すると、ダッシュポット定数とバネ定数で複素粘性が求まる。
η ∗ = η d a s h 1 + i ω ( η d a s h E s p r i n g ) = η ′ – i η ″ {displaystyle ^{*}= {eta _{dash}{1+iomega ({Chefrac {E_spring}}) }}=enta ‘-ienta ”}} {dash} {eta_{dash}} = } }=enta _{data }} {{dash}} {dash}} {dash}} {dash} {dash} {dash}} {dash} {dash} {dash} {dash} = {dash} {dash } {dash} {dash} {dash} {dash } {dash}} {dash
Oldroyd-B modelEdit
血液の粘弾性で最もよく使われる構成モデルの一つがOldroyd-Bモデルである。 Oldroyd-B非ニュートンモデルには、低せん断速度での赤血球の凝集と分散によるせん断減粘挙動を特徴付けるいくつかのバリエーションがある。 ここでは、運動量方程式と全応力テンソルを結合した3次元Oldroyd-Bモデルを検討する。 非ニュートン流を用い、血液の粘性係数μ ( h , d ) は、以下のように保証される。
は血管径dとヘマトクリットhの関数である。Oldroyd-Bモデルでは、せん断応力テンソルBと配向応力テンソルAの関係は次のように与えられる。
S + γ = μ ( h , d ) – g A + C 1 ( g A – C 2 I μ ( h , d ) 2 ) {displaystyle S+γ \left=mu (h,d)\left-gA+C_{1} ◇(gA-{frac {C_{2}I}{mu (h. h.) }} {Displaystyle S+γ(gA)δδ(gA)δ(gAδ)d)^{2}}right)}
where D/Dt is material derivative, V is velocity of the fluid, C1, C2, g, γ {displaystyle \gamma} …ここで、D/Dtは物質微分、Vは流速。}
は定数である。 SとBは次のように定義される。 S = μ B + g A {displaystyle S=mu B+gA}.
B = Δ V + ( Δ V ) T { {displaystyle B=Delta V+(\Delta V)^{T}} } }.
赤血球の粘弾性Edit
赤血球は血流と血管壁の両方から強い力学的刺激を受け、そのレオロジー特性は微小循環における生体機能の実行に重要です。 赤血球はそれ自体が粘弾性を示すことが分かっている。 赤血球の力学的特性を調べるには、以下のような方法がある。
- マイクロピペットによる吸引
- マイクロインデンテーション
- 光ピンセット
- 高周波電気変形試験
これらの方法は、赤血球の変形能をせん断、曲げ、面積拡大係数および緩和時間という観点から特徴付けるのに有効であった。 しかし、粘弾性的な性質を探ることはできなかった。 他の技術として、光音響測定が実施されている。 これは、単一パルスのレーザー光を用いて組織内に光音響信号を発生させ、その信号の減衰時間を測定する技術である。 線形の粘弾性理論によれば、減衰時間は粘弾性比に等しいので、赤血球の粘弾性特性を得ることができる。
粘弾性を評価するための別の実験手法として、細胞表面に接着した強磁性ビーズがある。 その後、光磁気ねじれサイトメトリーを用いて磁性ビーズに力を加え、赤血球の時間依存的な反応を調べることができました。
は単位ビーズ体積あたりの機械的トルク(応力の単位)であり、次式で与えられます。 T s ( t ) = c H cos θ {displaystyle T_{s}(t)=cH}cos \theta } で表されます。
ここで、Hは印加される磁気ねじれ磁場、θ {displaystyle {theta }}である。
はビーズの磁気モーメントの元の磁化方向に対する角度、cはビーズを粘度既知の液体中に置き、ねじり磁場をかけた実験によって求めたビーズ定数である。
振動応力とひずみの関係を表すには複素動的弾性率Gが用いられる。
where G ′ {displaystyle G’}.
は貯蔵弾性率、G ″ {displaystyle G”} は貯蔵弾性率です。
は損失弾性率です。 G ′ = ε 0 0 cos ϕ {displaystyle G’} {frac ³ σ _{0}{parepsilon _{0}} ³cos ³phi }.
G ″ = σ 0 ε 0 sin ϕ {displaystyle G”={frac {sigma _{0}}{varepsilon _{0}}}sin \phi }}.
where σ 0 {displaystyle \sigma _{0}}} {displaystyle}}の場合
and ε 0 {displaystyle \varepsilon _{0}}.
は応力と歪みの振幅、φ {displaystyle \phi } は応力と歪みの振幅である。
は両者間の位相差である。
図3 粘弾性挙動を示すトルク-変位グラフ以上の関係から、複素弾性率の成分はトルクの変化と時間変化を比較して、グラフに表すとループができることから決定されたものである。 T s ( t ) {displaystyle T_{s}(t)} の極限。
– d(t) ループと、T s ( t ) {displaystyle T_{s}(t)} で囲まれた領域A。
– d(t)ループは、1サイクルあたりのエネルギー散逸を表すもので、計算に使用される。 位相角φ{displaystyle ↵pi}は、1.5°から1.5°の範囲にある。
、貯蔵弾性率G’、損失弾性率Gは次のようになります。 φ = sin – 1 4 A π Δ T s Δ d {displaystyle \phi = sin ^{-1}{frac {4A}{Пpi \Delta T_{s} Detelta d}}}
G ′ = Δ T s Δ d cos ϕ {displaystyle G’={frac ◇Delta T_{s} ◇Delta d} ◇cos ◇phi } {displaystyle G’={frac ◇T_{s} ◇Delta d} ◇displaystyle G’={frac ◇T_{s} ◇cos ◇phi
G ″ = Δ T s Δ d sin ϕ = 4 A π ω Δ d } {displaystyle G”={frac {4A}{pi }}{delta d^{2}} {sin \pi}} ={frac {4A}{pi }} {delta d^{2}} }} {displaystyle G”= {displaystyle G”= {4A}{sp} {sp} {sp} {sins{sins{sins}{sins}{sin}}}{deltad/2}}。
ここでdは変位である。
図3に示すヒステリシスは赤血球に存在する粘弾性を表している。 これが膜分子の揺らぎと関係しているのか、それとも細胞内濃度のATPによって制御される代謝活動に関係しているのかは不明である。 7310>
血管が及ぼす影響編集部
生体内の血液の粘弾性挙動を見るとき、動脈、毛細血管、静脈の影響も考慮する必要がある。 血液の粘性は太い動脈で流れに大きな影響を与え、赤血球の弾性変形能に存在する弾性は細動脈と毛細血管で大きな影響を与える。 動脈壁における波動伝播、局所的な血流動態、壁面せん断応力勾配を理解することは、心血管系機能のメカニズムを理解する上で重要である。
より良い理解のための医学的理由編集
医学的観点から、血液の粘弾性特性を研究することの重要性は明白である。 心臓弁や血液ポンプなどの心臓血管系の人工器官の開発に伴い、複雑な形状における脈動する血流の理解が求められているのである。 具体的な例として、血液の粘弾性の影響とその脈動血液ポンプの試験への影響について紹介します。 また、血液の粘弾性と心肺バイパス時の局所および大脳血流との間に強い相関があることが報告されている。
このことは、人工器官の研究や試験を行うための血液アナログを開発する道にもつながっている。 グリセリンと水からなる古典的な類似体は、粘性と慣性の効果をよく表しているが、実際の血液のような弾性特性には欠ける。
正常な赤血球は変形可能ですが、鎌状赤血球症などの多くの疾患により弾力性が低下し、変形しにくくなります。 変形能が低下した赤血球は、流れに対するインピーダンスが増大し、赤血球凝集の増加や酸素飽和度の低下を招き、さらなる合併症を引き起こす可能性があります。 鎌状赤血球症のように変形能が低下した細胞が存在すると、血漿層の形成が阻害される傾向があり、粘弾性を測定することで阻害の程度を定量化できる。
HistoryEdit
初期の理論研究において、血液は非ニュートン粘性流体と扱われた。 初期の研究では定常流で、後には振動流で血液を評価していた。 テキサス大学のジョージ・B・サーストン教授は、1972年に初めて血液が粘弾性体であるという考えを発表した。 なぜなら、弾性領域は流れの開始時に血液中に蓄積されるため、流れが定常状態になるとその存在が見えなくなってしまうからである。 初期の研究では、定常流で見出された特性を用いて、非定常流の状況での特性を導き出しました。 医療技術や医療機器の進歩により、血液の力学的特性をより深く理解することが求められるようになりました。







































