Egyszerűbben fogalmazva a harmadik törvény kimondja, hogy egy tiszta anyag tökéletes kristályának entrópiája a hőmérséklet nullához közeledve nullához közelít. A tökéletes kristály igazodása nem hagy kétséget a kristály egyes részeinek elhelyezkedését és orientációját illetően. A kristály energiájának csökkenésével az egyes atomok rezgései a nullára csökkennek, és a kristály mindenhol egyforma lesz.
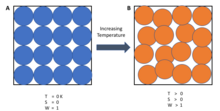
A harmadik törvény abszolút viszonyítási pontot ad az entrópia meghatározásához bármely más hőmérsékleten. Egy zárt rendszer entrópiája, amelyet ehhez a nullponthoz viszonyítva határozunk meg, azután az adott rendszer abszolút entrópiája. Matematikailag bármely rendszer abszolút entrópiája nulla hőmérsékleten az alapállapotok számának természetes logaritmusa szorozva a Boltzmann-állandóval kB = 1,38×10-23 J K-1.
A Nernst-tétel által meghatározott tökéletes kristályrács entrópiája nulla, feltéve, hogy alapállapota egyedi, mert ln(1)=0. Ha a rendszer egymilliárd egyforma atomból áll, és mind egy tökéletes kristály mátrixában fekszik, akkor az egymilliárd azonos dolog egymilliárd egyenként vett kombinációinak száma Ω = 1. Tehát:
S – S 0 = k B ln Ω = k B ln 1 = 0 {\displaystyle S-S_{0}=k_{\text{B}}\ln \Omega =k_{\text{B}}\ln {1}=0}

A különbség nulla, tehát a kezdeti entrópia S0 bármilyen választott érték lehet, amíg minden más hasonló számításban ez szerepel kezdeti entrópiaként. Ennek eredményeképpen az egyszerűség kedvéért a nulla kezdeti entrópiaértéket választjuk S0 = 0.
S – S 0 = S – 0 = 0 {\displaystyle S-S_{0}=S-0=0}

S = 0 {\displaystyle S=0}

Példa : Bejövő foton által felmelegített kristályrács entrópiaváltozásaSzerkesztés
Tegyük fel, hogy a rendszer egy T = 0 K hőmérsékletű, N azonos atomból álló V térfogatú kristályrácsból és egy bejövő λ hullámhosszú és ε energiájú fotonból áll.
Eredetileg csak egy elérhető mikroállapot van :
S 0 = k B ln Ω = k B ln 1 = 0 {\displaystyle S_{0}=k_{\text{B}}\ln \Omega =k_{\text{B}}\ln {1}=0}

.
Tegyük fel, hogy a kristályrács elnyeli a beérkező fotont. A rácsban van egy egyedi atom, amely kölcsönhatásba lép és elnyeli ezt a fotont. Az abszorpció után tehát N lehetséges mikroállapot érhető el a rendszerben, mindegyik mikroállapot egy-egy gerjesztett atomnak felel meg, a többi atom pedig alapállapotban marad.
A zárt rendszer entrópiája, energiája és hőmérséklete megemelkedik és kiszámítható. Az entrópia változása:
Δ S = S – S 0 = k B ln Ω {\displaystyle \Delta S=S-S_{0}=k_{\text{B}}\ln {\Omega }}

A termodinamika második törvényéből:
Δ S = S – S 0 = δ Q T {\displaystyle \Delta S=S-S_{0}={\frac {\delta Q}{T}}}}

Hence:
Δ S = S – S 0 = k B ln ( Ω ) = δ Q T {\displaystyle \Delta S=S-S_{0}=k_{\text{B}}}\ln(\Omega )={\frac {\delta Q}{T}}}

Az entrópiaváltozás kiszámítása:
S – 0 = k B ln N = 1.38 × 10 – 23 × ln ( 3 × 10 22 ) = 70 × 10 – 23 J K – 1 {\displaystyle S-0=k_{\text{B}}\ln {N}=1.38\times 10^{-23}\times \ln {(3\times 10^{22})}=70\times 10^{-23}\,\mathrm {J} \,\mathrm {K} ^{-1}}

Feltételezzük, hogy N = 3 – 1022 és λ = 1 cm . A rendszer energiaváltozása az egyetlen foton elnyelése következtében, amelynek energiája ε:
δ Q = ϵ = h c λ = 6.62 × 10 – 34 J ⋅ s × 3 × 10 8 m s – 1 0,01 m = 2 × 10 – 23 J {\displaystyle \delta Q=\epsilon ={\frac {hc}{\lambda }}={\frac {6.62\times 10^{-34}\,\mathrm {J} \cdot \mathrm {s} \times 3\times 10^{8}\,\mathrm {m} \,\mathrm{s} ^{-1}}{0.01\,\mathrm {m} }}=2\times 10^{-23}\,\mathrm {J} }

A zárt rendszer hőmérséklete a következőképpen emelkedik:
T = ϵ Δ S = 2 × 10 – 23 J 70 × 10 – 23 J K – 1 = 0,02857 K {\displaystyle T={\frac {\epsilon }{\Delta S}}={\frac {2\times 10^{-23}\,\mathrm {J}} }{70\times 10^{-23}\,\mathrm {J} \,\mathrm {K} ^{-1}}}=0,02857\,\mathrm {K} }

Ez úgy értelmezhető, mint a rendszer átlagos hőmérséklete a 0 < S < 70 × 10 – 23 J K – 1 {\displaystyle 0<S<70\times 10^{-23}\,\mathrm {J} \,\mathrm {K} ^{-1}}

. Feltételeztük, hogy egyetlen atom nyeli el a fotont, de a hőmérséklet- és entrópiaváltozás az egész rendszert jellemzi.
Nem nulla entrópiájú rendszerek abszolút nullánálSzerkesztés
Egy példa olyan rendszerre, amelynek nincs egyedi alapállapota, az, amelynek nettó spinje fél egész, és amelyre az időfordított szimmetria két degenerált alapállapotot ad. Ilyen rendszerek esetén az entrópia nulla hőmérsékleten legalább kB ln(2) (ami makroszkopikus léptékben elhanyagolható). Egyes kristályos rendszerek geometriai frusztrációt mutatnak, amikor a kristályrács szerkezete megakadályozza az egyedi alapállapot kialakulását. Az alapállapotú hélium (hacsak nincs nyomás alatt) folyékony marad.
Az üvegek és a szilárd oldatok emellett 0 K-en nagy entrópiát tartanak fenn, mert közel degenerált állapotok nagy gyűjteményei, amelyekben az egyensúlyon kívül csapdába esnek. Egy másik példa a sok közel degenerált alapállapotú, egyensúlyon kívül rekedt szilárd anyagra az Ih jég, amely “protonrendezetlenséggel” rendelkezik.
Hogy az entrópia az abszolút nullponton nulla legyen, egy tökéletesen rendezett kristály mágneses momentumainak maguknak is tökéletesen rendezettnek kell lenniük; entrópiai szempontból ez a “tökéletes kristály” definíciójának részének tekinthető. Ezt a feltételt csak ferromágneses, antiferromágneses és diamágneses anyagok teljesíthetik. A ferromágneses anyagok azonban valójában nem rendelkeznek nulla entrópiával nulla hőmérsékleten, mivel a párosítatlan elektronok spinjei mind egymáshoz igazodnak, és ez alapállapotbeli spin-degenerációt eredményez. Ezzel szemben azok az anyagok, amelyek 0 K-en paramágnesesek maradnak, sok közel degenerált alapállapottal rendelkezhetnek (például egy spinüvegben), vagy dinamikus rendezetlenséget tarthatnak fenn (egy kvantum-spin folyadékban).