Wiskoelastyczność jest właściwością ludzkiej krwi, która wynika głównie z energii sprężystej, która jest przechowywana w odkształceniu czerwonych krwinek, gdy serce pompuje krew przez ciało. Energia przekazywana krwi przez serce jest częściowo przechowywana w strukturze sprężystej, inna część jest rozpraszana przez lepkość, a pozostała energia jest przechowywana w ruchu kinetycznym krwi. Gdy uwzględni się pulsację serca, reżim sprężysty staje się wyraźnie widoczny. Wykazano, że poprzednia koncepcja krwi jako płynu o czystej lepkości była nieadekwatna, ponieważ krew nie jest zwykłym płynem. Krew może być dokładniej opisana jako płynna zawiesina elastycznych komórek (lub zol).
Czerwone krwinki zajmują około połowy objętości krwi i posiadają właściwości elastyczne. Ta sprężysta właściwość jest największym czynnikiem przyczyniającym się do lepkosprężystego zachowania krwi. Duża objętość procentowa krwinek czerwonych przy normalnym poziomie hematokrytu pozostawia niewiele miejsca na ruch i deformację krwinek bez interakcji z sąsiednimi komórkami. Obliczenia wykazały, że maksymalny procent objętości krwinek czerwonych bez deformacji wynosi 58%, co mieści się w zakresie normalnie występujących poziomów. Ze względu na ograniczoną przestrzeń pomiędzy czerwonymi krwinkami, oczywistym jest, że aby krew mogła płynąć, kluczową rolę odgrywa interakcja pomiędzy komórkami. Ta interakcja i tendencja komórek do agregacji jest głównym czynnikiem wpływającym na lepkosprężyste zachowanie krwi. Deformacja i agregacja krwinek czerwonych jest również powiązana z wywołanymi przez przepływ zmianami w ich ułożeniu i orientacji, co stanowi trzeci główny czynnik wpływający na ich lepkosprężyste zachowanie. Innymi czynnikami wpływającymi na właściwości lepkosprężyste krwi są: lepkość osocza, skład osocza, temperatura oraz prędkość przepływu lub prędkość ścinania. Razem, te czynniki czynią ludzką krew lepkosprężystą, nienewtonowską i tiksotropową.
Gdy czerwone krwinki są w spoczynku lub przy bardzo małych prędkościach ścinania, mają tendencję do agregacji i układania się razem w energetycznie korzystny sposób. Przyciąganie to przypisuje się naładowanym grupom na powierzchni komórek oraz obecności fibrynogenu i globulin. Taka zagregowana konfiguracja jest układem komórek o najmniejszej deformacji. Przy bardzo niskich prędkościach ścinania, lepkosprężyste właściwości krwi są zdominowane przez agregację, a odkształcalność komórek jest stosunkowo niewielka. Wraz ze wzrostem szybkości ścinania wielkość agregatów zaczyna się zmniejszać. Przy dalszym wzroście szybkości ścinania, komórki ulegają reorganizacji i orientacji, aby zapewnić kanały, przez które osocze może przechodzić, a komórki mogą się ślizgać. W zakresie od niskiej do średniej szybkości ścinania, komórki poruszają się względem sąsiednich komórek, umożliwiając przepływ. Wpływ właściwości agregacji na lepkosprężystość zmniejsza się, a wpływ odkształcalności krwinek czerwonych zaczyna wzrastać. Gdy szybkości ścinania stają się duże, krwinki czerwone rozciągają się lub deformują i ustawiają się zgodnie z przepływem. Tworzą się warstwy komórek, oddzielone osoczem, a przepływ jest teraz przypisywany warstwom komórek ślizgającym się po warstwach osocza. Warstwa komórek pozwala na łatwiejszy przepływ krwi i jako taka ma zmniejszoną lepkość i elastyczność. Lepkosprężystość krwi jest zdominowana przez odkształcalność czerwonych krwinek.
Model MaxwellaEdit
Model Maxwella dotyczy płynów Maxwella lub materiału Maxwella. Materiał w Modelu Maxwella jest płynem, co oznacza, że respektuje własności ciągłości dla równań konserwatywnych: Płyny są podzbiorem faz materii i obejmują ciecze, gazy, plazmy i, do pewnego stopnia, plastyczne ciała stałe. Model Maxwella został stworzony w celu oszacowania lokalnych konserwatywnych wartości lepkosprężystości poprzez globalną miarę w integralnej objętości modelu, która może być transponowana do różnych sytuacji przepływu. Krew jest złożonym materiałem, w którym różne komórki, takie jak czerwone krwinki, są nieciągłe w osoczu. Ich rozmiar i kształt są również nieregularne, ponieważ nie są one idealnymi kulami. Komplikując dodatkowo kształt objętości krwi, czerwone krwinki nie są identycznie rozmieszczone w objętości próbki krwi, ponieważ migrują z gradientami prędkości w kierunku obszarów o największej prędkości, nazywając to słynnym przedstawieniem efektu Fåhræusa-Lindqvista, agregują się lub oddzielają w przepływach płaszczowych lub korkowych opisanych przez Thurstona. Typowo, Model Maxwella opisany poniżej jest jednolicie biorąc pod uwagę materiał (jednolity niebieski kolor) jako doskonały rozproszony płyn cząstek wszędzie w objętości (w kolorze niebieskim), ale Thurston ujawnia, że pakiety czerwonych krwinek, wtyczki, są bardziej obecne w regionie wysokiej prędkości, jeśli y jest kierunkiem wysokości na rysunku modelu Maxwella, (y~H) i jest wolna warstwa komórek w obszarze niższej prędkości (y~0), co oznacza, że faza płynu plazmowego, która odkształca się pod Modelem Maxwella jest naprężona po wewnętrznych okładzinach, które całkowicie uciekają z modelu analitycznego Maxwella.
W teorii, płyn w Modelu Maxwella zachowuje się dokładnie tak samo w każdej innej geometrii przepływu jak rury, obracające się komórki lub w stanie spoczynku. Ale w praktyce, właściwości krwi zmieniają się w zależności od geometrii i krew okazała się nieodpowiednim materiałem do badania jako płyn w potocznym rozumieniu tego słowa. Więc Model Maxwella daje tendencje, które muszą być uzupełnione w rzeczywistej sytuacji, a następnie modelu Thurstona w naczyniu w odniesieniu do dystrybucji komórek w płaszczu i plug flows.
Jeśli mała sześcienna objętość krwi jest uważana, z siłami działającymi na niego przez serce pompowania i siły ścinające z granic. Zmiana kształtu sześcianu będzie miała 2 składniki:
- Odkształcenie sprężyste, które można odzyskać i które jest przechowywane w strukturze krwi.
- Poślizg, który jest związany z ciągłym dopływem energii lepkiej.
Gdy siła zostanie usunięta, sześcian odzyska częściowo swój kształt. Odkształcenie sprężyste ulega odwróceniu, ale poślizg nie. To wyjaśnia, dlaczego część sprężysta jest zauważalna tylko w przepływie niespokojnym. W przepływie ustalonym, poślizg będzie się zwiększał, a pomiary siły niezmiennej w czasie pominą wkład sprężystości.

Rysunek 1 może być użyty do obliczenia następujących parametrów niezbędnych do oceny krwi po przyłożeniu siły.
Naprężenie ścinające: τ = F A {{displaystyle ™tau ={frac {F}{A}}}

Naprężenie ścinające: γ = D H {displaystyle ®gamma ={{frac {D}{H}}}

Szybkość ścinania: γ ˙ = V H {displaystyle {{dot {gamma }}={{frac {V}{H}}}

Przepływ sinusoidalny zmienny w czasie jest używany do symulacji pulsacji serca. Materiał lepkosprężysty poddany zmiennemu w czasie przepływowi spowoduje zmianę fazy pomiędzy τ {{displaystyle }

i γ {displaystyle ™gamma }

reprezentowane przez ϕ {displaystyle \\phi }

. Jeśli ϕ = 0 {displaystyle \phi =0}

, materiał jest czysto sprężysty, ponieważ naprężenie i odkształcenie są w fazie, tak że reakcja jednego z nich spowodowana przez drugie jest natychmiastowa. Jeśli ϕ {displaystyle \phi }

= 90°, materiał jest czysto lepki, ponieważ odkształcenie jest opóźnione w stosunku do naprężenia o 90 stopni. Materiał lepkosprężysty będzie znajdował się gdzieś pomiędzy 0 a 90 stopni.
Zmiana sinusoidalna w czasie jest proporcjonalna do e i ω t {{displaystyle e^{iomega t}}

. Dlatego zależność wielkości i fazy pomiędzy naprężeniem, odkształceniem i szybkością ścinania opisuje się za pomocą tej zależności i częstotliwości radianowej, ω = 2 π f {displaystyle ^omega =2 ^pi f}

.

były f {displaystyle f}

jest częstotliwością w hercach. Naprężenie ścinające: τ ∗ = τ e – i ϕ { {displaystyle ^{*}= τ e^{-i ^phi }}

Szybkość ścinania: γ ˙ ∗ = γ ˙ e – i 0 {displaystyle {{dot {gamma }}^{*}={dot {gamma }}e^{-i0}}

Składowe złożonego naprężenia ścinającego można zapisać jako:
τ ∗ = τ ′ – i τ ″ { {displaystyle \tau ^{*}=\tau ’-i\tau ”}

Where τ ′ {displaystyle \\\ ’}

jest naprężeniem lepkim, a τ ′ {displaystyle \tau ’}

jest naprężeniem sprężystym.Złożony współczynnik lepkości η ∗ {displaystyle ^{*}}

może być znaleziony przez wzięcie stosunku złożonego naprężenia ścinającego i złożonej szybkości ścinania: η ∗ = τ ∗ γ ˙ ∗ = ( τ ′ γ ˙ + i τ ″ γ ˙ ) = η ′ + i η ˙ {displaystyle ˙eta ^{*}={frac. {^{*}}{{}}}=({{frac {{tau ’}}+i{frac {{tau ”}}})={eta '+i{tau ”}}}.

Podobnie, złożony moduł dynamiczny G może być otrzymany jako stosunek złożonego naprężenia ścinającego do złożonego odkształcenia ścinającego.
G = τ ∗ γ ∗ = ( τ ″ γ + i τ ′ γ ) {displaystyle G={ {frac {{tau ^{*}}}{{gamma ^{*}}}=({{frac {{tau ”}}{{gamma }}+i{frac {{tau ’}}{{gamma }})}.

Odnosząc te równania do wspólnych terminów lepkosprężystych otrzymujemy moduł spiętrzenia, G’, i moduł stratności, G”.
G = G ′ + i G ″ {styl G=G’+iG”}

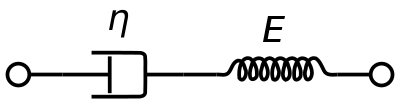
Wiskoelastyczny model materiałowy Maxwella jest powszechnie stosowany do reprezentowania lepkosprężystych właściwości krwi. Wykorzystuje on czysto lepki tłumik i czysto sprężystą sprężynę połączoną szeregowo. Analiza tego modelu daje złożoną lepkość w kategoriach stałej dashpot i stałej sprężyny.
η ∗ = η d a s h 1 + i ω ( η d a s h E s p r i n g ) = η ′ – i η ″ {{displaystyle ^{*}={{frac {{dash}}{1+i}omega ({{drac {{dash}}{E_{spring}}})}}= η ′ – i η ′}.

Oldroyd-B modelEdit
Jednym z najczęściej stosowanych modeli konstytutywnych dla lepkosprężystości krwi jest model Oldroyda-B. Istnieje kilka odmian nienewtonowskiego modelu Oldroyda-B charakteryzujących zachowanie się krwi przy rozrzedzaniu w wyniku agregacji i dyspersji krwinek czerwonych przy niskiej prędkości ścinania. Tutaj rozważamy trójwymiarowy model Oldroyda-B sprzężony z równaniem pędu i tensorem naprężeń całkowitych. Stosowany jest przepływ nienewtonowski, który zapewnia, że lepkość krwi μ ( h , d ) {przyp. tłum.

jest funkcją średnicy naczynia d i hematokrytu h. W modelu Oldroyda-B zależność pomiędzy tensorem naprężeń ścinających B a tensorem naprężeń orientacyjnych A jest dana przez:
S + γ = μ ( h , d ) – g A + C 1 ( g A – C 2 I μ ( h , d ) 2 ) {{displaystyle S+gamma \left= \mu (h,d)\left-gA+C_{1} \left(gA-{frac {C_{2}I}{\mu (h,d)^{2}}} prawo)}

gdzie D/Dt jest pochodną materiałową, V jest prędkością płynu, C1, C2, g, γ {displaystyle ^gamma }

są stałymi. S i B są zdefiniowane w następujący sposób: S = μ B + g A {displaystyle S= μ B+gA}

B = Δ V + ( Δ V ) T {displaystyle B= ΔDelta V+(ΔDelta V)^{T}}

Lepkosprężystość krwinek czerwonychEdit
Krwinki czerwone podlegają intensywnej stymulacji mechanicznej zarówno ze strony przepływu krwi, jak i ścian naczyń krwionośnych, a ich właściwości reologiczne są istotne dla ich skuteczności w pełnieniu funkcji biologicznych w mikrokrążeniu. Wykazano, że krwinki czerwone same w sobie wykazują właściwości lepkosprężyste. Istnieje kilka metod wykorzystywanych do badania właściwości mechanicznych krwinek czerwonych, takich jak:
- zasysanie mikropipetą
- mikrowgłębianie
- pęseta optyczna
- badania odkształceń elektrycznych o wysokiej częstotliwości
Metody te pracowały nad scharakteryzowaniem odkształcalności krwinki czerwonej w zakresie modułów ścinania, zginania, rozszerzalności powierzchniowej i czasów relaksacji. Jednakże, nie były one w stanie zbadać właściwości lepkosprężystych. Zastosowano również inne techniki, takie jak pomiary fotoakustyczne. Technika ta wykorzystuje jednoimpulsową wiązkę laserową do generowania sygnału fotoakustycznego w tkankach i mierzony jest czas zaniku tego sygnału. Zgodnie z teorią liniowej lepkosprężystości, czas zaniku jest równy stosunkowi lepkość-sprężystość i dlatego można uzyskać charakterystykę lepkosprężystości krwinek czerwonych.
Inna technika eksperymentalna stosowana do oceny lepkosprężystości polegała na użyciu kulek ferromagnetyzmu związanych z powierzchnią komórek. Siły są następnie stosowane do koralików magnetycznych przy użyciu optycznej magnetycznej cytometrii skrętnej, która pozwoliła badaczom na zbadanie odpowiedzi czerwonych krwinek zależnych od czasu.
T s ( t ) {{displaystyle T_{s}(t)}

jest momentem mechanicznym przypadającym na jednostkę objętości koralika (jednostki naprężenia) i jest dany przez: T s ( t ) = c H cos θ {displaystyle T_{s}(t)=cH cos θ }

gdzie H jest przyłożonym magnetycznym polem skręcającym, θ {displaystyle {theta }

jest kątem momentu magnetycznego paciorka względem pierwotnego kierunku namagnesowania, a c jest stałą paciorka, którą znajduje się na podstawie eksperymentów przeprowadzonych przez umieszczenie paciorka w cieczy o znanej lepkości i przyłożenie pola skręcającego.
Kompleksowy moduł dynamiczny G może być użyty do przedstawienia relacji pomiędzy oscylującym naprężeniem i odkształceniem:
G = G ′ + i G ″ {{displaystyle G=G’+iG”}

gdzie G ′ {displaystyle G’}

jest modułem zachowawczym, a G ′ {displaystyle G”}

jest modułem strat: G ′ = σ 0 ε 0 cos ϕ {{displaystyle G’={frac {{sigma _{0}}}{{varepsilon _{0}}}}cos \\phi }

G ″ = σ 0 ε 0 sin ϕ { {displaystyle G”={sigma _{0}}{varepsilon _{0}}}sin \phi }

gdzie σ 0 {{displaystyle \sigma _{0}}

oraz ε 0 {displaystyle \varepsilon _{0}}

są amplitudami naprężenia i odkształcenia, a ϕ {displaystyle \\phi }

to przesunięcie fazowe między nimi.

Z powyższych zależności składowe modułu złożonego są wyznaczane z pętli, która powstaje przez porównanie zmiany momentu obrotowego ze zmianą czasu, która tworzy pętlę, gdy jest przedstawiona graficznie. Granice T s ( t ) {przykład T_{s}(t)}

– d(t) pętli i obszar, A, ograniczony przez pętlę T s ( t ) {displaystyle T_{s}(t)}

– d(t) pętli, która reprezentuje rozpraszanie energii na cykl, są używane w obliczeniach. Kąt fazowy ϕ {displaystyle \phi }

G ″ = Δ T s Δ d sin ϕ = 4 A π ω Δ d 2 {displaystyle G”={sin ″phi ={sin ″frac {4A}{ppi ″omega ″Delta d^{2}}}}

gdzie d jest przemieszczeniem.
Histereza pokazana na rysunku 3 reprezentuje lepkosprężystość obecną w czerwonych krwinkach. Nie jest jasne, czy jest to związane z fluktuacjami molekularnymi błony, czy z aktywnością metaboliczną kontrolowaną przez wewnątrzkomórkowe stężenia ATP. Konieczne są dalsze badania, aby w pełni zbadać te interakcje i rzucić światło na leżące u podstaw właściwości lepkosprężystych odkształceń czerwonych krwinek.
Wpływ naczyń krwionośnychEdit
Przyglądając się lepkosprężystemu zachowaniu krwi in vivo, konieczne jest również rozważenie wpływu tętnic, naczyń włosowatych i żył. Lepkość krwi ma główny wpływ na przepływ w większych tętnicach, podczas gdy sprężystość, która jest związana z elastyczną odkształcalnością czerwonych krwinek, ma główny wpływ na tętniczki i naczynia włosowate. Zrozumienie propagacji fal w ścianach tętnic, lokalnej hemodynamiki i gradientu naprężeń ścinających w ścianach jest ważne dla zrozumienia mechanizmów funkcjonowania układu sercowo-naczyniowego. Ściany tętnic są anizotropowe i heterogeniczne, składają się z warstw o różnych właściwościach biomechanicznych, co sprawia, że zrozumienie mechanicznego wpływu tętnic na przepływ krwi jest bardzo trudne.
Medyczne powody lepszego zrozumieniaEdit
Z medycznego punktu widzenia, znaczenie badania właściwości lepkosprężystych krwi staje się oczywiste. Wraz z rozwojem urządzeń protetycznych układu krążenia, takich jak zastawki serca i pompy krwi, wymagane jest zrozumienie pulsacyjnego przepływu krwi w złożonych geometriach. Kilka konkretnych przykładów dotyczy wpływu lepkosprężystości krwi i jej implikacji w badaniach pulsacyjnych pomp krwi. Udokumentowano silne korelacje pomiędzy lepkosprężystością krwi a regionalnym i globalnym przepływem krwi mózgowej podczas ominięcia krążeniowo-oddechowego.
To również doprowadziło do opracowania analogu krwi w celu badania i testowania urządzeń protetycznych. Klasyczny analog gliceryny i wody zapewnia dobre odwzorowanie lepkości i efektów bezwładnościowych, ale nie posiada właściwości elastycznych prawdziwej krwi. Jednym z takich analogów krwi jest wodny roztwór gumy ksantanowej i gliceryny opracowany w celu dopasowania zarówno lepkich, jak i elastycznych składników złożonej lepkości krwi.
Normalne czerwone krwinki są odkształcalne, ale wiele warunków, takich jak choroba sierpowatokrwinkowa, zmniejsza ich elastyczność, co czyni je mniej odkształcalnymi. Czerwone krwinki o zmniejszonej odkształcalności mają rosnącą impedancję dla przepływu, co prowadzi do wzrostu agregacji czerwonych krwinek i zmniejszenia wysycenia tlenem, co może prowadzić do dalszych powikłań. Obecność komórek o zmniejszonej odkształcalności, jak to ma miejsce w chorobie sierpowatokrwinkowej, ma tendencję do hamowania tworzenia się warstw osocza, a poprzez pomiar lepkosprężystości można określić ilościowo stopień tego hamowania.
HistoryEdit
W początkowych pracach teoretycznych krew była traktowana jako nienewtonowski płyn lepki. Początkowe badania oceniały krew podczas stałego przepływu, a później przy użyciu przepływu oscylacyjnego. Profesor George B. Thurston, z Uniwersytetu w Teksasie, po raz pierwszy przedstawił pomysł, że krew jest lepkosprężysta w 1972 roku. Poprzednie badania, które dotyczyły krwi w przepływie ustalonym, wykazały znikome właściwości elastyczne, ponieważ reżim elastyczny jest przechowywany we krwi podczas inicjacji przepływu i dlatego jego obecność jest ukryta, gdy przepływ osiąga stan ustalony. Wczesne badania wykorzystywały właściwości znalezione w przepływie ustalonym do wyprowadzenia właściwości dla sytuacji przepływu nieustalonego. Postęp w procedurach i urządzeniach medycznych wymagał lepszego zrozumienia mechanicznych właściwości krwi.
.