Viscoelastizität ist eine Eigenschaft des menschlichen Blutes, die in erster Linie auf die elastische Energie zurückzuführen ist, die in der Verformung der roten Blutkörperchen gespeichert wird, wenn das Herz das Blut durch den Körper pumpt. Die vom Herzen auf das Blut übertragene Energie wird zum Teil in der elastischen Struktur gespeichert, ein weiterer Teil wird durch die Viskosität abgeleitet, und die verbleibende Energie wird in der kinetischen Bewegung des Blutes gespeichert. Wenn die Pulsation des Herzens berücksichtigt wird, wird ein elastisches Regime deutlich. Es hat sich gezeigt, dass das bisherige Konzept des Blutes als rein viskose Flüssigkeit unzureichend war, da Blut keine gewöhnliche Flüssigkeit ist. Blut kann vielmehr als eine fluidisierte Suspension elastischer Zellen (oder ein Sol) beschrieben werden.
Die roten Blutkörperchen machen etwa die Hälfte des Blutvolumens aus und besitzen elastische Eigenschaften. Diese elastische Eigenschaft ist der größte Faktor, der zum viskoelastischen Verhalten des Blutes beiträgt. Der große Volumenanteil der roten Blutkörperchen bei einem normalen Hämatokritwert lässt nur wenig Raum für die Bewegung und Verformung der Zellen, ohne dass es zu Wechselwirkungen mit einer benachbarten Zelle kommt. Berechnungen haben ergeben, dass der maximale Volumenanteil der roten Blutkörperchen ohne Verformung 58 % beträgt, was im Bereich der normalerweise auftretenden Werte liegt. Aufgrund des begrenzten Raums zwischen den roten Blutkörperchen liegt es auf der Hand, dass die Interaktion zwischen den einzelnen Zellen eine wichtige Rolle spielt, damit das Blut fließen kann. Diese Wechselwirkung und die Tendenz der Zellen zur Aggregation tragen wesentlich zum viskoelastischen Verhalten des Blutes bei. Die Verformung und Aggregation roter Blutkörperchen ist auch mit strömungsbedingten Veränderungen in der Anordnung und Ausrichtung gekoppelt und stellt einen dritten wichtigen Faktor für das viskoelastische Verhalten dar. Weitere Faktoren, die zu den viskoelastischen Eigenschaften von Blut beitragen, sind die Plasmaviskosität, die Plasmazusammensetzung, die Temperatur und die Fließgeschwindigkeit oder Scherrate. Zusammen machen diese Faktoren menschliches Blut viskoelastisch, nicht-newtonsch und thixotrop.
Wenn die Erythrozyten in Ruhe oder bei sehr geringen Schergeschwindigkeiten sind, neigen sie dazu, zu aggregieren und sich in einer energetisch günstigen Weise zusammenzustapeln. Die Anziehungskraft wird auf geladene Gruppen auf der Oberfläche der Zellen und auf das Vorhandensein von Fibrinogen und Globulinen zurückgeführt. Diese aggregierte Konfiguration ist eine Anordnung von Zellen mit der geringsten Verformung. Bei sehr niedrigen Schergeschwindigkeiten wird die viskoelastische Eigenschaft des Blutes von der Aggregation dominiert und die Verformbarkeit der Zellen ist relativ unbedeutend. Mit zunehmender Scherrate nimmt die Größe der Aggregate ab. Bei einer weiteren Erhöhung der Schergeschwindigkeit ordnen sich die Zellen neu an und orientieren sich, um Kanäle für den Durchgang des Plasmas und das Gleiten der Zellen zu schaffen. In diesem niedrigen bis mittleren Schergeschwindigkeitsbereich wackeln die Zellen in Bezug auf die benachbarten Zellen und ermöglichen so den Fluss. Der Einfluss der Aggregationseigenschaften auf die Viskoelastizität nimmt ab und der Einfluss der Verformbarkeit der Erythrozyten beginnt zuzunehmen. Wenn die Scherraten groß werden, dehnen oder verformen sich die Erythrozyten und richten sich mit der Strömung aus. Es bilden sich Zellschichten, die durch Plasma getrennt sind, und der Fluss wird nun auf Schichten von Zellen zurückgeführt, die auf Plasmaschichten gleiten. Die Zellschicht ermöglicht einen leichteren Blutfluss und damit eine geringere Viskosität und eine geringere Elastizität. Die Viskoelastizität des Blutes wird von der Verformbarkeit der roten Blutkörperchen dominiert.
Maxwell-ModellBearbeiten
Das Maxwell-Modell betrifft Maxwell-Fluide oder Maxwell-Material. Das Material im Maxwell-Modell ist eine Flüssigkeit, was bedeutet, dass es die Kontinuitätseigenschaften für konservative Gleichungen respektiert: Fluide sind eine Teilmenge der Materiephasen und umfassen Flüssigkeiten, Gase, Plasmen und bis zu einem gewissen Grad auch plastische Festkörper. Das Maxwell-Modell dient zur Schätzung lokaler konservativer Werte der Viskoelastizität durch ein globales Maß im Integralvolumen des Modells, das auf verschiedene Strömungssituationen übertragen werden kann. Blut ist ein komplexes Material, in dem verschiedene Zellen wie die roten Blutkörperchen im Plasma diskontinuierlich sind. Auch ihre Größe und Form sind unregelmäßig, da sie keine perfekten Kugeln sind. Erschwerend kommt hinzu, dass die Erythrozyten in einem Blutvolumen nicht identisch verteilt sind, da sie mit Geschwindigkeitsgradienten in Richtung der Bereiche mit der höchsten Geschwindigkeit wandern, was als die berühmte Darstellung des Fåhræus-Lindqvist-Effekts bezeichnet wird, und sich in den von Thurston beschriebenen Hüllen- oder Pfropfenströmungen zusammenballen oder trennen. Typischerweise ist das unten beschriebene Maxwell-Modell einheitlich betrachtet das Material (einheitliche blaue Farbe) als eine perfekt verteilte Teilchen Flüssigkeit überall im Volumen (in blau), aber Thurston zeigt, dass Pakete von roten Zellen, Stecker, sind mehr in der hohen Geschwindigkeit Region, wenn y ist die Richtung der Höhe in der Maxwell-Modell Figur, (y ~ H) und es gibt eine freie Zellen Schicht in der unteren Geschwindigkeit Bereich (y ~ 0), was bedeutet, dass die Plasma-Fluid-Phase, die unter Maxwell-Modell verformt wird nach inneren Auskleidungen, die vollständig aus dem analytischen Modell von Maxwell entkommen angespannt.
In der Theorie verhält sich ein Fluid in einem Maxwell-Modell in jeder anderen Strömungsgeometrie wie Rohren, rotierenden Zellen oder im Ruhezustand genau gleich. Aber in der Praxis variieren die Bluteigenschaften mit der Geometrie, und es hat sich gezeigt, dass Blut ein ungeeignetes Material ist, um als Flüssigkeit im allgemeinen Sinne untersucht zu werden. Das Maxwell-Modell gibt also Tendenzen an, die in der realen Situation vervollständigt werden müssen, gefolgt vom Thurston-Modell in einem Gefäß hinsichtlich der Verteilung von Zellen in Mantel- und Pfropfenströmungen.
Betrachtet man ein kleines würfelförmiges Blutvolumen, auf das Kräfte durch das Pumpen des Herzens und Scherkräfte von den Grenzen einwirken. Die Formveränderung des Würfels besteht aus zwei Komponenten:
- Elastische Verformung, die rückgängig gemacht werden kann und in der Struktur des Blutes gespeichert ist.
- Rutschen, das mit einer kontinuierlichen Zufuhr von viskoser Energie verbunden ist.
Wenn die Kraft weggenommen wird, würde sich der Würfel teilweise erholen. Die elastische Verformung wird rückgängig gemacht, das Gleiten jedoch nicht. Das erklärt, warum der elastische Anteil nur bei instationärer Strömung auffällt. Bei stationärer Strömung nimmt der Schlupf weiter zu, und bei den Messungen der nicht zeitlich veränderlichen Kraft werden die Beiträge der Elastizität vernachlässigt.

Abbildung 1 kann zur Berechnung der folgenden Parameter verwendet werden, die für die Bewertung des Blutes erforderlich sind, wenn eine Kraft ausgeübt wird.
Scherspannung: τ = F A {\displaystyle \tau ={\frac {F}{A}}}

Scherdehnung: γ = D H {\displaystyle \gamma ={\frac {D}{H}}}

Scherrate: γ ˙ = V H {\displaystyle {\dot {\gamma }}={\frac {V}{H}}}

Eine sinusförmige, zeitlich veränderliche Strömung wird verwendet, um die Pulsation eines Herzens zu simulieren. Ein viskoelastisches Material, das einer zeitlich variierenden Strömung ausgesetzt ist, führt zu einer Phasenvariation zwischen τ {\displaystyle \tau }

und γ {\displaystyle \gamma }

, dargestellt durch ϕ {\displaystyle \phi }

. Wenn ϕ = 0 {\displaystyle \phi =0}

, ist das Material rein elastisch, weil Spannung und Dehnung in Phase sind, so dass die Reaktion des einen auf das andere unmittelbar erfolgt. Wenn ϕ {\displaystyle \phi }

= 90°, handelt es sich um ein rein viskoses Material, da die Dehnung der Spannung um 90 Grad nacheilt. Ein viskoelastisches Material wird irgendwo zwischen 0 und 90 Grad liegen.
Der sinusförmige Zeitverlauf ist proportional zu e i ω t {\displaystyle e^{i\omega t}}

. Daher werden die Größen- und Phasenbeziehung zwischen Spannung, Dehnung und Scherrate mit dieser Beziehung und einer Kreisfrequenz ω = 2 π f {\displaystyle \omega =2\pi f}

waren f {\displaystyle f}

die Frequenz in Hertz ist. Schubspannung: τ ∗ = τ e – i ϕ {\displaystyle \tau ^{*}=\tau e^{-i\phi }}

Scherdehnung: γ ∗ = γ e – i π 2 {\displaystyle \gamma ^{*}=\gamma e^{-i{\frac {\pi }{2}}}}

Scherrate: γ ˙ ∗ = γ ˙ e – i 0 {\displaystyle {\dot {\gamma }}^{*}={\dot {\gamma }}e^{-i0}}

Die Komponenten der komplexen Schubspannung können geschrieben werden als:
τ ∗ = τ ′ – i τ ″ {\displaystyle \tau ^{*}=\tau ‚-i\tau “}

Wo τ ′ {\displaystyle \tau ‚}

die viskose Spannung ist und τ ″ {\displaystyle \tau “}

ist die elastische Spannung, der komplexe Viskositätskoeffizient η ∗ {\displaystyle \eta ^{*}}

lässt sich aus dem Verhältnis zwischen der komplexen Schubspannung und der komplexen Scherrate ermitteln: η ∗ = τ ∗ γ ˙ ∗ = ( τ ′ γ ˙ + i τ ″ γ ˙ ) = η ′ + i η ″ {\displaystyle \eta ^{*}={\frac {\tau ^{*}}{{\dot {\gamma }}^{*}}}=({\frac {\tau ‚}{\dot {\gamma }}}+i{\frac {\tau “}{\dot {\gamma }})=\eta ‚+i\eta “}

In ähnlicher Weise kann der komplexe dynamische Modul G durch das Verhältnis der komplexen Schubspannung zur komplexen Scherdehnung erhalten werden.
G = τ ∗ γ ∗ = ( τ ″ γ + i τ ′ γ ) {\displaystyle G={\frac {\tau ^{*}}{\gamma ^{*}}=({\frac {\tau “}{\gamma }}+i{\frac {\tau ‚}{\gamma }})}

Wenn man die Gleichungen auf gängige viskoelastische Terme bezieht, erhält man den Speichermodul G‘ und den Verlustmodul G“.
G = G ′ + i G ″ {\displaystyle G=G’+iG“}

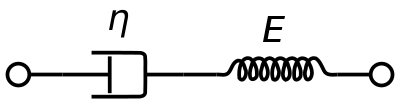
Ein viskoelastisches Maxwell-Materialmodell wird üblicherweise zur Darstellung der viskoelastischen Eigenschaften von Blut verwendet. Dabei werden ein rein viskoser Dämpfer und eine rein elastische Feder in Reihe geschaltet. Die Analyse dieses Modells ergibt die komplexe Viskosität in Abhängigkeit von der Dashpot-Konstante und der Federkonstante.
η ∗ = η d a s h 1 + i ω ( η d a s h E s p r i n g ) = η ′ – i η ″ {\displaystyle \eta ^{*}={\frac {\eta _{dash}}{1+i\omega ({\frac {\eta _{dash}}{E_{spring}})}}=\eta ‚-i\eta “}

Oldroyd-B-ModellBearbeiten
Eines der am häufigsten verwendeten konstitutiven Modelle für die Viskoelastizität von Blut ist das Oldroyd-B-Modell. Es gibt mehrere Variationen des nicht-newtonschen Oldroyd-B-Modells, die das Scherverdünnungsverhalten aufgrund der Aggregation und Dispersion roter Blutkörperchen bei niedriger Scherrate beschreiben. Hier betrachten wir ein dreidimensionales Oldroyd-B-Modell, das mit der Impulsgleichung und dem Gesamtspannungstensor gekoppelt ist. Es wird eine nicht Newtonsche Strömung verwendet, die sicherstellt, dass die Viskosität des Blutes μ ( h , d ) {\displaystyle \mu (h,d)}

eine Funktion des Gefäßdurchmessers d und des Hämatokrits h ist. Im Oldroyd-B-Modell ist die Beziehung zwischen dem Schubspannungstensor B und dem Orientierungsspannungstensor A gegeben durch:
S + γ = μ ( h , d ) – g A + C 1 ( g A – C 2 I μ ( h , d ) 2 ) {\displaystyle S+\gamma \left=\mu (h,d)\left-gA+C_{1}\left(gA-{\frac {C_{2}I}{\mu (h,d)^{2}}\rechts)}

wobei D/Dt die materielle Ableitung ist, V die Geschwindigkeit des Fluids, C1, C2, g, γ {\displaystyle \gamma }

sind Konstanten. S und B sind wie folgt definiert: S = μ B + g A {\displaystyle S=\mu B+gA}

B = Δ V + ( Δ V ) T {\displaystyle B=\Delta V+(\Delta V)^{T}}

Viskoelastizität roter BlutkörperchenBearbeiten
Rote Blutkörperchen werden sowohl durch den Blutfluss als auch durch die Gefäßwände stark mechanisch stimuliert, und ihre rheologischen Eigenschaften sind wichtig für ihre Effektivität bei der Ausübung ihrer biologischen Funktionen in der Mikrozirkulation. Es wurde nachgewiesen, dass rote Blutkörperchen selbst viskoelastische Eigenschaften aufweisen. Es gibt verschiedene Methoden zur Untersuchung der mechanischen Eigenschaften roter Blutkörperchen, wie z. B.:
- Mikropipettenaspiration
- Mikroeindrückung
- optische Pinzette
- hochfrequente elektrische Verformungstests
Diese Methoden haben dazu beigetragen, die Verformbarkeit der roten Blutkörperchen in Form von Scher-, Biege-, Flächenausdehnungsmodulen und Relaxationszeiten zu charakterisieren. Sie waren jedoch nicht in der Lage, die viskoelastischen Eigenschaften zu untersuchen. Es wurden andere Techniken angewandt, wie z. B. photoakustische Messungen. Bei dieser Technik wird mit einem Einzelpuls-Laserstrahl ein photoakustisches Signal in Geweben erzeugt und die Abklingzeit des Signals gemessen. Nach der Theorie der linearen Viskoelastizität ist die Abklingzeit gleich dem Viskositäts-Elastizitäts-Verhältnis, so dass die Viskoelastizitätseigenschaften der roten Blutkörperchen ermittelt werden können.
Eine weitere experimentelle Technik zur Bewertung der Viskoelastizität besteht in der Verwendung von Ferromagnetismuskügelchen, die an die Zelloberfläche gebunden sind. Die Kräfte werden dann mit Hilfe der optischen magnetischen Verdrehungszytometrie auf das magnetische Kügelchen ausgeübt, wodurch die Forscher die zeitabhängigen Reaktionen der roten Blutkörperchen untersuchen konnten.
T s ( t ) {\displaystyle T_{s}(t)}

ist das mechanische Drehmoment pro Volumeneinheit der Kügelchen (Spannungseinheiten) und ist gegeben durch: T s ( t ) = c H cos θ {\displaystyle T_{s}(t)=cH\cos \theta }

wobei H das angelegte magnetische Torsionsfeld ist, θ {\displaystyle {\theta }}

der Winkel des magnetischen Moments der Perle relativ zur ursprünglichen Magnetisierungsrichtung ist und c die Perlenkonstante ist, die durch Experimente ermittelt wird, die durchgeführt werden, indem die Perle in eine Flüssigkeit mit bekannter Viskosität gelegt und ein Verdrehungsfeld angelegt wird.
Der komplexe dynamische Modul G kann verwendet werden, um die Beziehungen zwischen der schwingenden Spannung und der Dehnung darzustellen:
G = G ′ + i G ″ {\displaystyle G=G’+iG“}

wobei G ′ {\displaystyle G‘}

der Speichermodul ist und G ″ {\displaystyle G“}

ist der Verlustmodul: G ′ = σ 0 ε 0 cos ϕ {\displaystyle G’={\frac {\sigma _{0}}{\varepsilon _{0}}}\cos \phi }

G ″ = σ 0 ε 0 sin ϕ {\displaystyle G“={\frac {\sigma _{0}}{\varepsilon _{0}}}\sin \phi }

wobei σ 0 {\displaystyle \sigma _{0}}

und ε 0 {\displaystyle \varepsilon _{0}}

sind die Amplituden von Spannung und Dehnung und ϕ {\displaystyle \phi }

ist die Phasenverschiebung zwischen ihnen.

Aus den obigen Beziehungen werden die Komponenten des komplexen Moduls aus einer Schleife bestimmt, die durch den Vergleich der Änderung des Drehmoments mit der Änderung der Zeit entsteht, die bei grafischer Darstellung eine Schleife bildet. Die Grenzen von T s ( t ) {\displaystyle T_{s}(t)}

– d(t) Schleife und die Fläche A, die von der T s ( t ) {\displaystyle T_{s}(t)}

– d(t)-Schleife begrenzt wird, die die Energiedissipation pro Zyklus darstellt, werden für die Berechnungen verwendet. Der Phasenwinkel ϕ {\displaystyle \phi }

, Speichermodul G‘ und Verlustmodul G werden dann zu: ϕ = sin – 1 4 A π Δ T s Δ d {\displaystyle \phi =\sin ^{-1}{\frac {4A}{\pi \Delta T_{s}\Delta d}}

G ′ = Δ T s Δ d cos ϕ {\displaystyle G’={\frac {\Delta T_{s}}{\Delta d}}\cos \phi }

G ″ = Δ T s Δ d sin ϕ = 4 A π ω Δ d 2 {\displaystyle G“={\frac {\Delta T_{s}}{\Delta d}}\sin \phi ={\frac {4A}{\pi \omega \Delta d^{2}}}}

wobei d die Verschiebung ist.
Die in Abbildung 3 gezeigte Hysterese stellt die Viskoelastizität der roten Blutkörperchen dar. Es ist unklar, ob dies mit molekularen Fluktuationen der Membran oder mit der durch die intrazelluläre ATP-Konzentration gesteuerten Stoffwechselaktivität zusammenhängt. Weitere Forschungen sind erforderlich, um diese Wechselwirkung vollständig zu erforschen und die zugrunde liegenden viskoelastischen Verformungseigenschaften der roten Blutkörperchen zu erhellen.
Auswirkungen der BlutgefäßeBearbeiten
Bei der Untersuchung des viskoelastischen Verhaltens von Blut in vivo müssen auch die Auswirkungen von Arterien, Kapillaren und Venen berücksichtigt werden. Die Viskosität des Blutes hat einen primären Einfluss auf den Fluss in den größeren Arterien, während die Elastizität, die in der elastischen Verformbarkeit der roten Blutkörperchen liegt, einen primären Einfluss in den Arteriolen und Kapillaren hat. Das Verständnis der Wellenausbreitung in den Arterienwänden, der lokalen Hämodynamik und des Wandschubspannungsgradienten ist wichtig, um die Mechanismen der kardiovaskulären Funktion zu verstehen. Arterielle Wände sind anisotrop und heterogen und bestehen aus Schichten mit unterschiedlichen biomechanischen Eigenschaften, was das Verständnis der mechanischen Einflüsse, die Arterien zum Blutfluss beitragen, sehr schwierig macht.
Medizinische Gründe für ein besseres VerständnisEdit
Aus medizinischer Sicht wird die Bedeutung der Untersuchung der viskoelastischen Eigenschaften des Blutes deutlich. Mit der Entwicklung von kardiovaskulären prothetischen Geräten wie Herzklappen und Blutpumpen ist das Verständnis des pulsierenden Blutflusses in komplexen Geometrien erforderlich. Ein paar konkrete Beispiele sind die Auswirkungen der Viskoelastizität des Blutes und ihre Folgen für die Prüfung einer pulsierenden Blutpumpe. Starke Korrelationen zwischen der Viskoelastizität des Blutes und dem regionalen und globalen zerebralen Blutfluss während eines kardiopulmonalen Bypasses wurden dokumentiert.
Dies hat auch den Weg für die Entwicklung eines Blutanalogons geebnet, um prothetische Geräte zu untersuchen und zu testen. Das klassische Analogon aus Glycerin und Wasser bietet eine gute Darstellung der Viskosität und der Trägheitseffekte, verfügt aber nicht über die elastischen Eigenschaften von echtem Blut. Ein solches Blutanalogon ist eine wässrige Lösung aus Xanthangummi und Glycerin, die entwickelt wurde, um sowohl die viskosen als auch die elastischen Komponenten der komplexen Viskosität des Blutes abzubilden.
Normale rote Blutkörperchen sind verformbar, aber viele Erkrankungen, wie z. B. die Sichelzellenkrankheit, verringern ihre Elastizität, wodurch sie weniger verformbar sind. Erythrozyten mit verminderter Verformbarkeit haben einen erhöhten Strömungswiderstand, was zu einer verstärkten Aggregation der Erythrozyten und einer Verringerung der Sauerstoffsättigung führt, was weitere Komplikationen zur Folge haben kann. Das Vorhandensein von Zellen mit verminderter Verformbarkeit, wie es bei der Sichelzellkrankheit der Fall ist, hemmt tendenziell die Bildung von Plasmaschichten, und durch Messung der Viskoelastizität kann der Grad der Hemmung quantifiziert werden.
GeschichteBearbeiten
In frühen theoretischen Arbeiten wurde Blut als eine nicht-newtonsche viskose Flüssigkeit behandelt. In ersten Studien wurde Blut bei gleichmäßiger Strömung und später bei oszillierender Strömung untersucht. Professor George B. Thurston von der University of Texas stellte 1972 erstmals die Idee vor, dass Blut viskoelastisch ist. Die früheren Studien, die das Blut bei gleichmäßiger Strömung untersuchten, zeigten vernachlässigbare elastische Eigenschaften, da das elastische Regime während des Beginns der Strömung im Blut gespeichert ist und daher verborgen bleibt, wenn die Strömung einen gleichmäßigen Zustand erreicht. In den frühen Studien wurden die bei stationärer Strömung gefundenen Eigenschaften zur Ableitung von Eigenschaften für instationäre Strömungssituationen verwendet. Fortschritte bei medizinischen Verfahren und Geräten erforderten ein besseres Verständnis der mechanischen Eigenschaften von Blut.