Il s’agit d’une page technique sur la façon dont le Norman Parathyroid Center réalise le scanner au sestamibi pour les maladies parathyroïdiennes et l’hyperparathyroïdie. Une grande partie de ces informations est destinée aux médecins et aux technologues qui effectuent des scintigraphies au Sestamibi. Ces informations seront trop techniques pour la plupart des patients atteints de parathyroïde. Si vous êtes un patient atteint d’une maladie parathyroïdienne, vous pouvez lire cette page, mais ne faites pas de cette page la première page de Parathyroid.com que vous lisez – elle est trop technique et vous dépassera. IL S’AGIT D’UNE PAGE AVANCÉE. Si vous voulez en savoir plus sur la scintigraphie au sestamibi, lisez d’abord plusieurs fois notre page de présentation du sestamibi ! (Cliquez ici). La chose la plus importante à retenir en lisant ces pages est que les scanners sestamibi sont plus souvent faux que vrais. Si elles sont négatives, elles sont fausses dans 100 % des cas. Si elles sont positives, elles sont fausses dans 60 % des cas. Les scintigraphies ne devraient jamais être utilisées pour déterminer si quelqu’un a une hyperparathyroïdie… elles ne peuvent pas vous le dire ! On accorde BEAUCOUP trop d’importance aux scanners et nous aimerions que les gens cessent d’en faire. Rappelez-vous que les scans sont plus souvent faux que bons. Arrêtez de passer des scanners – ils vous embrouilleront – et ils seront faux !
Buts de la procédure de la scintigraphie au Sestamibi pour la maladie parathyroïdienne.
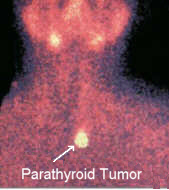 Une façon très simple de regarder ces scanners est la suivante : Le but de la scintigraphie au sestamibi est de détecter les adénomes parathyroïdiens chez les patients atteints d’hyperparathyroïdie primaire sporadique. Le sestamibi est utilisé pour distinguer les maladies parathyroïdiennes à une ou plusieurs glandes. Le Sestamibi aidera le chirurgien à localiser un adénome parathyroïdien dans un cadre tridimensionnel, permettant une approche chirurgicale plus dirigée des parathyroïdes. L’utilisation de la scintigraphie au Sestamibi pour « confirmer » le diagnostic d’hyperparathyroïdie est déconseillée – la sensibilité n’est pas assez élevée pour être utilisée de cette manière (mais la spécificité est proche de 100 %). Nous allons répéter ce concept encore et encore parce que cette scintigraphie est mal utilisée environ 80 % du temps ! Cette scintigraphie ne doit PAS être utilisée pour « confirmer » qu’un patient est atteint d’une maladie parathyroïdienne (sauf dans de rares circonstances). Ce scanner ne doit PAS être utilisé pour déterminer quel patient parathyroïdien doit être opéré et quel patient ne doit pas l’être. Cela n’a aucun sens de faire cela !
Une façon très simple de regarder ces scanners est la suivante : Le but de la scintigraphie au sestamibi est de détecter les adénomes parathyroïdiens chez les patients atteints d’hyperparathyroïdie primaire sporadique. Le sestamibi est utilisé pour distinguer les maladies parathyroïdiennes à une ou plusieurs glandes. Le Sestamibi aidera le chirurgien à localiser un adénome parathyroïdien dans un cadre tridimensionnel, permettant une approche chirurgicale plus dirigée des parathyroïdes. L’utilisation de la scintigraphie au Sestamibi pour « confirmer » le diagnostic d’hyperparathyroïdie est déconseillée – la sensibilité n’est pas assez élevée pour être utilisée de cette manière (mais la spécificité est proche de 100 %). Nous allons répéter ce concept encore et encore parce que cette scintigraphie est mal utilisée environ 80 % du temps ! Cette scintigraphie ne doit PAS être utilisée pour « confirmer » qu’un patient est atteint d’une maladie parathyroïdienne (sauf dans de rares circonstances). Ce scanner ne doit PAS être utilisé pour déterminer quel patient parathyroïdien doit être opéré et quel patient ne doit pas l’être. Cela n’a aucun sens de faire cela !
La scintigraphie au Sestamibi est une étude de localisation pour trouver la mauvaise glande parathyroïde, PAS une étude diagnostique pour diagnostiquer la maladie parathyroïdienne.
C’est aussi une étude fonctionnelle comme le sont tous les tests de médecine nucléaire. Jusqu’à 10 % de tous les patients atteints d’hyperparathyroïdie primaire ne seront pas localisés par une scintigraphie au sestamibi de TRES BONNE qualité, mais ils ont quand même la maladie ! D’autres ont suggéré qu’un taux de localisation inférieur à 80 % indique que la technique utilisée doit être revue. Nous sommes d’accord ! Notre taux élevé de détection des adénomes parathyroïdiens est le fruit d’une expérience croissante et augmente chaque année. Notre taux de localisation des adénomes est d’environ 94 % de TOUS les patients atteints de maladie parathyroïdienne qui nous sont envoyés, c’est-à-dire presque tous ceux qui présentent des adénomes (notre sensibilité à la détection de tous les adénomes chez les 3 500 derniers patients est de 97,2 %… n’oubliez pas que cette scintigraphie vise à différencier les adénomes parathyroïdiens des non-adénomes). Notez également que 3 à 4 % environ des patients présentent une hyperplasie parathyroïdienne à 4 glandes… qui ne s’allumera jamais et, plus précisément, ne montrera jamais un seul foyer de radioactivité. Soyons très clairs ici encore—-Les glandes parathyroïdes hyperplasiques sont très différentes des adénomes parathyroïdiens. Elles n’absorberont JAMAIS assez de radioactivité pour être détectables par un scanner. JAMAIS. Par conséquent, un patient présentant une hyperplasie des 4 glandes doit toujours avoir un scanner négatif. De même, de nombreux patients présentant des adénomes auront un scanner négatif en raison de mauvaises techniques de scintigraphie. Si vous n’avez pas lu notre première page sur la scintigraphie au sestamibi, vous DEVEZ la lire en premier. Cette page présente des statistiques sur les scanners réalisés aux États-Unis et montre que la plupart des scanners réalisés aux États-Unis (et dans le monde entier) ne servent à rien et sont négatifs en raison des mauvaises techniques utilisées. VOUS DEVEZ D’ABORD LIRE CETTE PAGE… CLIQUEZ ICI.
La scintigraphie au Sestamibi ne montrera JAMAIS une glande parathyroïde normale. La scintigraphie au Sestamibi ne montrera JAMAIS une glande hyperplasique chez un patient atteint d’hyperparathyroïdie primaire. Encore une fois, nous le répétons : la scintigraphie de Sestamibi ne montrera JAMAIS une glande hyperplastique chez un patient atteint d’hyperparathyroïdie primaire.
Ce test n’est pas très bon pour les patients atteints d’hyperparathyroïdie secondaire – qui ont une hyperplasie des 4 glandes par définition – mais il peut être utile. Vous ne devez PAS vous attendre à obtenir les mêmes résultats chez un patient atteint d’hyperplasie secondaire. Les meilleurs scanners du monde ne montreront probablement pas les quatre glandes hyperplasiques, bien qu’ils puissent en montrer 2 ou 3. La véritable utilité de la scintigraphie au sestamibi pour les patients souffrant d’hyperparathyroïdie secondaire (due à une maladie rénale) est de s’assurer qu’il n’y a pas une glande parathyroïde hyperplasique descendue trop bas et située dans la poitrine ou non descendue et située haut dans le cou. Ne vous attendez PAS à voir 4 glandes distinctes chez un patient présentant une hyperplasie due à une maladie rénale.
Une grande partie de ce que nous avons appris sur la scintigraphie au sestamibi provient de notre expérience de la chirurgie radioguidée pour les maladies parathyroïdiennes. Nous avons mesuré la radioactivité de plus de 15 000 glandes parathyroïdes chez des patients qui ont subi une scintigraphie au sestamibi dans l’heure et demie qui a suivi l’opération. Nous avons publié notre première étude à ce sujet en 1999. Il est clair que l’utilisation d’une sonde dans la salle d’opération permet de faire la différence entre une glande parathyroïde normale, une glande parathyroïde hyperplasique et un adénome parathyroïdien MIEUX QUE LE PATHOLOGUE NE LE PEUT, et BEAUCOUP MIEUX QUE L’ASSAISONNEMENT INTRAOPÉRATIF DE LA HORMONE PTH. Les glandes parathyroïdes normales ne deviennent pas radioactives au-delà de celle de la graisse. La sonde affichera une valeur proche de zéro, tout comme pour la mesure de la graisse. Une glande parathyroïde hyperplasique deviendra radioactive, mais JAMAIS plus de 15 % du bruit de fond (habituellement autour de 6-8 % du bruit de fond) (ceci n’est pas valable pour l’hyperparathyroïdie secondaire – une maladie différente). Un adénome parathyroïdien deviendra très radioactif et présentera presque toujours des niveaux de radioactivité supérieurs à 20 % du bruit de fond, généralement entre 30 et 80 %, et entre 17 et 190 %. C’est pourquoi notre publication de 1999 s’intitule « La règle des 20 %… ». Si une parathyroïde est prélevée dans le cou d’un patient et qu’elle présente plus de 20 % de radioactivité de fond, il s’agit OBLIGATOIREMENT d’un adénome et il n’est PAS nécessaire d’effectuer une coupe congelée pour le diagnostiquer. En outre, si vous trouvez une glande normale chez ce patient et qu’elle n’a pas de radioactivité, vous êtes pratiquement assuré que ce patient est guéri (sauf pour les rares adénomes doubles – moins de 1 %). Ainsi, une scintigraphie de très haute qualité et l’utilisation APPROPRIÉE de la sonde et une compréhension de la « radioactivité contenue » permet à un chirurgien expert de la parathyroïde de réaliser LA PLUPART des opérations de la parathyroïde en moins de 15 minutes avec un taux de guérison de 99,8%.
Comment nous faisons nos excellentes scintigraphies au sestamibi–
-les scintigraphies au sestamibi de la plus haute résolution et les plus précises au monde.
Temps de l’examen : Dix minutes à 1 heure (10 à 20 minutes s’il est effectué immédiatement avant une chirurgie minimale de la parathyroïde (la procédure MIRP) en utilisant la cartographie nucléaire peropératoire…voir ci-dessous) (Environ 98% de nos scans sont réalisés en 20 minutes ou moins).
Préparation du patient : Certains examinateurs préfèrent donner du jus de citron dans les 20 minutes précédant l’imagerie initiale (20% de jus/80% d’eau). On pense que cela diminue l’absorption par les glandes salivaires. Nous ne le faisons PAS systématiquement et nous ne l’avons pas trouvé utile.
Équipement et fenêtres énergétiques:
- Caméra : Seimens ZLC 7500 Orbitor (d’autres caméras sont occasionnellement utilisées aussi, pas si importantes)
- Collimateur : Faible énergie, haute résolution. La colimnation par trou d’épingle ne doit JAMAIS être utilisée ! IMPORTANT ! !!
- Fenêtre : 20%
- Crête : Tc99m Auto Peak
- Grossissement : 1,6 sur ordinateur uniquement (les images à fort mag ne doivent JAMAIS être utilisées). Ordinateur : Picker Odyssey 750
Radiopharmaceutique, dose et technique d’administration
- Tc-99m sestamibi
- 20 mCi (740 Mbq) (+/- en fonction des extrêmes de poids corporel)
- Injection IV standard
- L’imagerie par soustraction de deux isotopes ne doit JAMAIS être utilisée. Dans notre récente étude portant sur 6 500 scanners réalisés aux États-Unis entre 1/2003 et 11/2006, seuls 1,8 % des établissements utilisent des techniques à double isotope. Ils sont toujours classés parmi les pires scanners, y compris ceux de la Mayo Clinic (Rochester), de la Cleveland Clinic et de Johns Hopkins. Oui, ils font partie des quelques hôpitaux des États-Unis qui utilisent cette technique et leurs résultats sont parmi les plus mauvais des États-Unis. Une scintigraphie à double isotope ne montrera presque jamais un adénome supérieur (50 % sont des adénomes supérieurs !), et elle est moins précise pour trouver les adénomes inférieurs. Les études à double isotope ne sont positives que dans 28 % des scanners dans notre examen de 6 500 scanners à travers les États-Unis. C’est inacceptable ! L’utilisation des études à double isotope n’est pas une norme de soins. Les résultats ne sont pas assez bons et ne montreront jamais les petites tumeurs supérieures ! !!
Position du patient et champ d’image:
La position du patient est critique si le chirurgien doit utiliser cette information pour guider l’opération.Le patient doit être positionné devant la caméra comme il le serait sur la table d’opération…avec un rouleau sous les épaules et le cou étendu. Le cou est maintenu sur la ligne médiane pour toutes les études. La LAO et la RAO sont obtenues en déplaçant la caméra, PAS la tête du patient. Ce point est extrêmement important pour que tous les scans de chaque patient soient obtenus avec la caméra à la même distance du cou du patient, ce qui permet d’obtenir un grossissement uniforme de chaque vue. De plus, cela permet une uniformité d’un patient à l’autre, ce qui facilite l’interprétation des scans. Étendez le cou aussi loin que possible (pour imiter la position sur la table de la salle d’opération) tout en restant confortable, afin de diminuer les chances de mouvement.
La caméra DOIT être positionnée aussi près du patient que possible. C’EST IMPÉRATIF si vous voulez des images claires et nettes. C’est l’une des plus grandes erreurs commises à travers les États-Unis. Nous devons le répéter – on ne saurait trop insister… la caméra DOIT être aussi proche du patient que possible !
Vues préférées de la scintigraphie au sestamibi :
C’est l’information la plus importante de cette page ! Nous effectuons près de 1400 scintigraphies au sestamibi par an, et notre volume de cas nous oblige à examiner près de 2500 scintigraphies par an qui ont été effectuées dans des établissements extérieurs. Cela signifie que le Dr Norman a vu beaucoup plus de scintigraphies au sestamibi que tout autre médecin… nous savons donc ce qui fonctionne et ce qui ne fonctionne pas. La liste suivante nous tient beaucoup à cœur et nous sommes convaincus que ces simples modifications apporteront des changements spectaculaires à la fois dans la sensibilité et la spécificité de ces scintigraphies.
-
Les vues latérales des scintigraphies au sestamibi n’ont aucune valeur. Nous avons des dizaines d’exemples où une belle scintigraphie AP ne montrera par la suite rien sur les vues latérales, et pourtant un certain nombre d’hôpitaux les obtiennent afin d’avoir une idée de la profondeur. Cela ne fonctionne pas !
Les vues postérieures ne valent rien. Oui, nous voyons cela fait de temps en temps. S’il vous plaît, ne vous embarrassez pas en obtenant des vues postérieures. Ces vues ne montreront pas même la plus grosse tumeur parathyroïdienne.
LAO et RAO sont les vues les plus importantes ! !! C’est ce que beaucoup (la plupart) des techniques manquent. En regardant sous un angle oblique, de nombreuses parathyroïdes qui sont « cachées » derrière un lobe thyroïdien deviennent évidentes. Le cas le plus courant est celui où vous ne pouvez pas déterminer si un point chaud « sur » la thyroïde est un nodule thyroïdien ou une parathyroïde postérieure. En comparant l’OAL et l’ORA à l’AP, la nature du point chaud devient incroyablement évidente. Nous avons eu de nombreux cas où des clichés AP de mauvaise qualité (pas vraiment positifs et pas vraiment négatifs) sont devenus soudainement positifs après l’obtention de clichés LAO et RAO. Ces vues donnent également l’orientation tridimensionnelle souhaitée : les adénomes superficiels semblent « se déplacer » d’un côté du cou à l’autre lorsqu’on compare la LAO et la RAO, tandis que les adénomes profonds (sillon trachéo-œsophagien) resteront près de la ligne médiane tandis que la thyroïde plus antérieure semble se déplacer d’un côté à l’autre. C’est également de cette façon que les adénomes parathyroïdiens intra-thyroïdiens sont détectés. Croyez-moi, c’est une évidence.Ce paragraphe est l’information la plus importante de cette page (autre qu’une dose trop faible utilisée ou que la caméra n’est pas placée assez près).
Notre protocole standard (que nous suivons rarement – mais que nous recommandons vivement aux établissements qui ne réalisent pas des centaines de ces scanners par an) consiste à obtenir 5 vues précoces et 4 vues différées (si le patient ne va pas en salle d’opération) : Ant cou, Ant cou avec marqueur (précoce seulement), Ant médiastin, LAO, et RAO. Chaque image est obtenue à 8 cm ou moins. La caméra DOIT être presque en contact avec le patient ! Les vues précoces sont obtenues environ 5 minutes après l’injection. Les vues différées sont obtenues entre 1,25 et 2,5 heures. La vue médiastinale doit montrer au moins la moitié supérieure du cœur. AUCUNE des autres vues ne doit montrer plus qu’une petite partie du cœur. Si le cœur est trop visible, la qualité de l’examen en sera diminuée ! Sans imagerie médiastinale jusqu’au niveau du cœur, 4 à 5% des adénomes seront manqués. Seule une petite partie du cœur doit être incluse dans les vues LAO et RAO. Si l’examen est effectué immédiatement avant une parathyroïdectomie minimale, le moment est plus critique – voir ci-dessous. Si l’adénome apparaît dans le cou sur la vue précoce (scénario le plus courant), nous n’obtenons pas de vue médiastinale retardée pour gagner du temps et de l’énergie. S’ils sont bons, nous accélérons les choses. C’est mieux pour le service de médecine nucléaire, mieux pour le patient, et mieux pour le chirurgien si le patient va directement au bloc (c’est la situation idéale… le service de médecine nucléaire participe au traitement de cette maladie plutôt que de ne jouer qu’un rôle de diagnostic.
IMPORTANT… près de 98% des scanners qui sont positifs le seront avec les trois premiers clichés (un AP, et un LAO, RAO). C’est tout ce que nous faisons sur TOUS les patients qui vont en salle d’opération. C’est également ce que nous faisons sur environ 90 % de TOUS les patients que nous scannons. Le balayage différé n’est utile que pour environ 2 % des patients. DONC… si un critère de positivité est qu’un point chaud reste sur les images différées alors que la thyroïde est lavée… vous allez rater au moins 20% des scans positifs. Oui, le lavage différentiel pendant l’imagerie différée PEUT être utile… il ne devrait JAMAIS être un critère nécessaire pour qualifier une scintigraphie de positive !!!). Nous voyons au moins 1 scan par semaine qui a été réalisé dans un hôpital extérieur qui est un scan clairement positif mais qui est lu comme négatif parce que la tumeur parathyroïdienne se lave au même rythme que la thyroïde. Ce n’est PAS un critère pour une tumeur parathyroïdienne !!!
Protocole d’acquisition : mise à jour mars ’06
Nous acquérons chaque vue pendant un temps fixe plutôt qu’un nombre fixe de comptes. De cette façon, nous trouvons plus d’uniformité avec toutes les images (précoces et retardées) ce qui rend les comparaisons plus faciles et les découvertes subtiles plus apparentes. On ne peut pas avoir trop de cœur et/ou de foie dans le champ. Cela ferait disparaître la thyroïde/parathyroïde. Vous devriez voir juste un éclat du haut du cœur (ventricules).
Images précoces : Vues antérieure, ant + médiastin, LAO, et RAO à5 minutes, (une antérieure avec marqueurs et une sans). Les marqueurs sont placés sur l’échancrure sternale, et 2 latéralement le long du bord latéral du muscle SCM à 4 cm de distance (guide de distance). Note… puisque nous faisons 8 de ces scanners chaque jour, nous n’effectuons plus de scanners avec marqueurs… SAUF si 1) la tumeur est déplacée de la thyroïde (dans la poitrine ou près des clavicules, par exemple), ou 2) le patient a déjà eu sa thyroïde enlevée et donc la thyroïde n’est pas disponible comme repère anatomique.
Images retardées : Le choix du moment est discuté ci-dessous. Des vues antérieures, ant + médiastin, LAO, et RAO sont obtenues.Les vues obliques latérales sont à 31 degrés avec la tête du patient en ligne médiane. Remarque : souvent, nous réalisons les clichés différés plus tôt (voir ci-dessous) si l’adénome apparaît sur le scanner initial. Pourquoi 31 degrés ? Il s’agit d’une question fréquemment posée. Nous avons constaté qu’en tournant la caméra plus loin que cela, l’épaule du patient se met en travers, ce qui nécessite d’éloigner la caméra du cou du patient. Cela signifie que tous les scans ne seront pas obtenus à la même distance du cou du patient (comme indiqué ci-dessus, nous cherchons à maintenir la même distance pour toutes les vues). Nous en avons fait assez pour savoir que 31 degrés est à peu près le maximum que vous pouvez faire pivoter la caméra sans pousser l’épaule du patient. N’EFFECTUEZ PAS D’IMAGES OBLIQUES EN FAISANT TOURNER LA TÊTE DU PATIENT. VOUS N’OBTIENDREZ PAS LE MÊME RÉSULTAT. EXTRÊMEMENT IMPORTANT !!!
Les vues latérales ne sont JAMAIS nécessaires. L’importance des vues LAO et RAO est qu’elles permettent de localiser l’adénome parathyroïdien en trois dimensions par rapport à la glande thyroïde. Si l’adénome est situé au niveau de la thyroïde (en profondeur par rapport à la peau), il semblera « bouger » dans le cou lorsque l’on compare les vues de droite et de gauche. Si l’adénome est situé en profondeur de la thyroïde, il se trouve presque toujours dans le sillon trachéo-œsophagien. Dans ce cas, la position de l’adénome semblera être la même sur les vues LAO et RAO alors que la thyroïde « tourne » d’un côté à l’autre. Cette localisation tridimensionnelle aidera le chirurgien en donnant une bonne estimation de la profondeur de l’adénome.
Collimation en trou d’épingle.
L’utilisation d’un collimateur en trou d’épingle est absolument la pire chose que vous puissiez faire et c’est le deuxième problème le plus courant que nous voyons dans les scans de tous les États-Unis. NE FAITES PAS CELA ! Cela détruira tous les détails fins que vous pouvez obtenir en plaçant la caméra très près du patient. Faites-nous confiance… et essayez-le. Vous serez étonné de voir comment vous détruisez vos détails avec cette technique !!!!. NE LE FAITES PAS !
Images différées et imagerie TEMP
Il y a très peu d’indications pour des images différées après 2,5 heures. Occasionnellement (rarement), l’activité thyroïdienne peut être un peu chaude et un nouveau balayage à 3 heures peut être utile. Nous ne pensons PAS qu’il s’agisse d’une occurrence courante… en fait, c’est extrêmement rare.
Nous avions (au passé) utilisé l’imagerie SPECT pour tous les patients chez qui il y a un adénome douteux (environ un sur 20). mis à jour Nous avions l’habitude de penser que l’analyse SPECT pouvait augmenter la sensibilité et la spécificité de plusieurs pour cent, et donc, l’utiliser sélectivement. Si les clichés standard suggèrent une maladie d’une seule glande mais ne peuvent pas dire définitivement oui ou non, nous réalisions (dans le passé) une TEMP immédiatement après les clichés différés. Nous sommes convaincus que la TEMP n’ajoute RIEN que les clichés LAO / RAO ne nous donnent déjà. En fait, la SEULE fois où nous effectuons une TEMP est lorsque la tumeur est située profondément dans la poitrine, près du cœur. Dans notre examen de 6 500 scanners à travers les États-Unis, ceux qui ont eu une TEMP ont été généralement classés plus bas que ceux qui ont obtenu des images planaires seulement. Rappelez-vous que même les patients dont le scanner est négatif ont toujours la plus forte probabilité d’avoir un adénome UNIQUE, mais que les chances d’avoir 4 glandes malades ont augmenté de 3 % à environ 7 % (selon la qualité de vos scanners). Certains centres effectuent une TEMP sur tous les patients. Nous pensons que c’est exagéré et inutile dans la plupart des cas, et que ce n’est généralement PAS aussi bon que de faire un simple planar avec des vues LAO / RAO. CELA NE DEVRAIT JAMAIS ÊTRE FAIT ! De plus, si le patient est emmené directement au bloc opératoire, cela fait perdre un temps précieux. Nous ne faisons JAMAIS de scintigraphie SPECT, à moins qu’il ne s’agisse de la poitrine. Pour résumer notre opinion sur la TEMP… 1) Il n’y a aucune raison de ne faire que la TEMP et cela ne devrait JAMAIS être fait. 2) L’utilisation routinière de la TEMP en plus de l’imagerie planaire n’est pas nécessaire et sera toujours inutile si les images planaires sont réalisées comme indiqué sur cette page. La plupart des utilisations de la TEMP entrent dans cette catégorie et cela devrait vraiment cesser. 3) La TEMP peut être utile dans CERTAINES réopérations… mais elle est limitée à celles qui sont déplacées de la thyroïde (comme celles qui sont profondes dans la poitrine), ou lorsqu’une thyroïdectomie antérieure a été effectuée). Nous effectuons environ 1000 opérations parathyroïdiennes par an, et nous utilisons la TEMP environ 15 à 20 fois par an… sur des opérations profondes dans la poitrine. La seule raison de faire la TEMP est que le service de radiologie et le radiologue peuvent facturer 1000 $ de plus. Cela DOIT cesser.
Information sur les sondes utilisées pour la chirurgie radioguidée
RAPPELONS !!! Une bonne sonde parathyroïdienne utilisée en salle d’opération est BEAUCOUP plus efficace pour trouver un point chaud de radioactivité que la caméra. CEPENDANT, l’utilisation d’une sonde conçue pour la chirurgie du sein ou le mélanome ne fournira PAS ce haut degré de sensibilité et de spécificité. La chirurgie radioguidée du sein et du mélanome est TRÈS DIFFÉRENTE… Dans ces cas, la sonde est conçue pour détecter un ganglion radioactif chaud dans un fond froid. Bien sûr, dans la chirurgie de la parathyroïde, la sonde doit détecter une parathyroïde « très chaude » dans un fond « chaud » (ou une glande thyroïde presque aussi chaude). Ainsi, si votre chirurgien tente de réaliser une chirurgie parathyroïdienne radioguidée et qu’il utilise une sonde Neoprobe ou toute autre sonde (C-tract, Navigator, etc.) qui n’est PAS équipée d’une « sonde parathyroïdienne Norman » spécifique, spécifiquement collimatée pour être utilisée pendant une chirurgie parathyroïdienne (chaude ou plus chaude), cela ne fonctionnera pas ! Encore une fois, seules les sondes parathyroïdiennes sont conçues pour distinguer le chaud du plus chaud, et les sondes conçues pour la cartographie des ganglions lymphatiques du sein et du mélanome NE FONCTIONNENT PAS dans certains cas où la parathyroïde se trouve à proximité de la thyroïde. Nous avons vu des procès pour faute professionnelle intentés parce qu’un chirurgien avait utilisé la mauvaise sonde. Ne faites pas cette erreur.
Si vous effectuez une scintigraphie au Sestamibi avant une cartographie nucléaire peropératoire pour une chirurgie minimale de la parathyroïde :
Nous avons constaté que le moment idéal pour opérer la parathyroïde est d’environ 1,0 à 2 heures après l’injection. C’est notre objectif pour chaque patient. Nous avons opéré des patients jusqu’à 4 à 4,5 heures après l’injection et la radioactivité est trop délavée pour être d’une grande utilité.Mise à jour
Mise à jour : 2006. Nous faisons TRÈS RAREMENT de l’imagerie différée le jour de l’opération. Le scanner prend environ 10 à 20 minutes (deux, trois ou quatre vues) et ils partent au bloc opératoire. Environ 25 % des patients ont un si beau scanner en 10 minutes (deux vues) que c’est tout ce qu’ils obtiennent. Environ 55% ont un résultat clairement positif, y compris les estimations de la profondeur de la tumeur dans le cou (obtenues par des vues obliques) après trois vues, et c’est tout ce qu’ils obtiennent. Seuls environ 20% des patients ont une quatrième vue (toujours une AP) qui montrera souvent la tumeur par rapport à la toute première vue (également une AP). Ainsi, pour environ 25% des patients, nous avons simplement une vue AP et une vue oblique. L’oblique fournit des informations sur la profondeur au chirurgien. IMPORTANT… si vous faites les scans correctement, 98% des scans positifs le seront dans les 15 premières minutes… un scan retardé ne vous donnera que 2% de plus ! AGAIN….. Les scanners retardés au-delà des 15 premières minutes ne vous apporteront que des améliorations très progressives de la positivité…. si vous faites les scanners correctement dès le départ. Si vous attendez de voir la thyroïde disparaître complètement pour ne laisser qu’un seul foyer…… alors vous ne comprenez pas la véritable valeur de ce test et vous devez le repenser. CECI N’EST PAS CORRECT !
Rappelez-vous, l’idée est d’être dans la salle d’opération à un moment où il y a un haut degré de radioactivité différentielle entre la thyroïde et la parathyroïde… c’est-à-dire après le lavage de la thyroïde mais avant le lavage de la parathyroïde. Si vous attendez trop longtemps, la sonde n’aidera pas autant qu’elle le pourrait.
Cette page technique sur la scintigraphie au Sestamibi pour la maladie parathyroïdienne a été écrite et ces techniques ont été développées par Hemant Chheda, MD, Brandi Reardon et James Norman, MD qui interprètent plus de 4000 scintigraphies parathyroïdiennes par an.
À PROPOS DE L’AUTEUR : Le Dr Chheda est professeur agrégé de radiologie clinique à l’Université de Floride du Sud et directeur médical de la médecine nucléaire à l’hôpital général de Tampa, où il réalise plus de 350 scintigraphies au sestamibi chaque année depuis 1995 (date à laquelle la chirurgie parathyroïdienne radioguidée a été mise au point avec son aide). En 2006, il supervise en moyenne plus de 2000 scans Sestamibi par an réalisés pour les patients du Dr Norman. Le Dr Chheda est le radiologue nucléaire de la clinique parathyroïdienne de Norman et il reçoit quotidiennement des commentaires écrits du Dr Norman sur les résultats de chaque opération, de sorte qu’en tant qu’équipe, leur précision est extrêmement élevée.
Le technologue en chef est Brandi Reardon qui effectue la grande majorité des scintigraphies au Sestamibi, et est considéré par beaucoup comme l’un des plus grands experts mondiaux sur les aspects techniques de la scintigraphie au Sestamibi pour les maladies parathyroïdiennes. La précision extrêmement élevée des scintigraphies réalisées par la Norman Parathyroid Clinic et le service de médecine nucléaire de l’hôpital général de Tampa est due en grande partie à l’expertise de Brandi et à son souci constant du détail qui permet à nos scintigraphies de s’améliorer d’année en année.
Le Dr James Norman a vu et revu plus de scintigraphies au Sestamibi que quiconque au monde. Il réalise actuellement environ 1800 opérations de la parathyroïde par an et la grande majorité de ces patients viennent avec des scanners réalisés dans un autre hôpital. Environ 85 % des scanners extérieurs sont réalisés avec des techniques inférieures aux normes et environ 75 % d’entre eux sont considérés comme négatifs en raison des mauvaises techniques utilisées. Les mauvaises techniques de scintigraphie au sestamibi sont la norme aux États-Unis, et les grands hôpitaux universitaires ne sont PAS meilleurs que les petits hôpitaux locaux. Tout dépend de la technique. Le Dr Norman a l’occasion d’examiner environ 4 500 scintigraphies au sestamibi par an, provenant de tous les Etats-Unis et de nombreux pays étrangers. Le Dr Norman a vu toutes les scintigraphies parathyroïdiennes possibles et toutes les techniques jamais utilisées. Nos excellentes scintigraphies sont le résultat du dévouement à cette maladie, d’un volume énorme et d’une équipe formidable.
Ce qu’il faut lire ensuite
- Retour aux tests de localisation en général
- Publications sur la chirurgie parathyroïdienne radioguidée (le MIRP)
- Comment… nous décidons quels patients peuvent subir la mini chirurgie parathyroïdienne radioguidée
- Une introduction à la mini chirurgie parathyroïdienne
- Plus sur le Sestamibi pour la chirurgie parathyroïdienne mini-invasive.La plus récente avancée en matière de chirurgie parathyroïdienne. Procédure rapide en ambulatoire.
- Comment devenir notre patient
.