Chemický prvek vodík se řadí mezi nekovy. Kovovým se může stát při velmi vysokých tlacích. Byl objeven v roce 1766 Henrym Cavendishem.

Datová oblast
| Klasifikace | Vodík je nekov. Kovovým se může stát při velmi vysokých tlacích. |
| Barva | bezbarvý |
| Atomová hmotnost | 1.0079 |
| Stav | plyn |
| Teplota tání | -259,14 oC, 14,01 K |
| Teplota varu | -252,87 oC, 20.28 K |
| Elektrony: | 1 |
| Protony: | 1 |
| Neutrony v nejhojnějším izotopu: | 0 |
| Elektronové obaly | 1 |
| Elektronová konfigurace | 1s1 |
| Hustota při 20oC | 0.0000899 g/cm3 |
Zobrazit více, včetně: Teploty, energie, oxidace,
reakce, sloučeniny, poloměry, vodivosti
| Objem atomu | 14.4 cm3/mol |
| Struktura | hcp: hexagonální těsně zabalený (jako pevná látka při nízkých teplotách) |
| Tvrdost | – |
| Měrná tepelná kapacita | 14.304 J g-1 K-1 |
| Tavné teplo | 0,117 kJ mol-1 H2 |
| Teplo atomizace | 218 kJ mol-1 |
| Teplo vypařování | 0.904 kJ mol-1 H2 |
| 1. ionizační energie | 1312 kJ mol-1 |
| 2. ionizační energie | kJ mol-1 |
| 3. ionizační energie | 11815.0 kJ mol-1 |
| Elektronová afinita | 72.7711 kJ mol-1 |
| Minimální oxidační číslo | -1 |
| Min. běžné oxidační číslo | -1 |
| Maximální oxidační číslo | 1 |
| Maximální běžné oxidační číslo. | 1 |
| Elektronegativita (Paulingova stupnice) | 2,18 |
| Polarizační objem | 0.7 Å3 |
| Reakce se vzduchem | prudká, ⇒ H2O |
| Reakce s 15 M HNO3 | žádná |
| Reakce s 6 M HCl | žádná |
| Reakce s 6 M NaOH | žádný |
| Oxid(y) | H2O |
| Hydrid(y) | H2 |
| Chlorid(y) | HCl |
| Atomový poloměr | 25 pm |
| Iontový poloměr (1+ ion) | – |
| Iontový poloměr (2+ ion) | – |
| Iontový poloměr (3+ ion) | – |
| Iontový poloměr (1- ion) | – |
| Iontový poloměr (2- ion) | – |
| Iontový poloměr (3- ion) | – |
| Tepelná vodivost | 0.1805 W m-1 K-1 |
| Elektrická vodivost | – |
| Teplota tuhnutí/topení: | -259,14 oC, 14,01 K |

Obrázek NASA: Obrovské množství vodíku ve vzdálených galaxiích

Theophrastus Paracelsus – První člověk, který vytvořil vodík: „Vzduch vzniká a vyráží jako vítr.“
Objev vodíku
Oblíbeným školním chemickým pokusem je přidání kovu, například hořčíku, do kyseliny. Kov reaguje s kyselinou za vzniku soli a uvolňuje z kyseliny vodík. Plynný vodík z kapaliny vybublává a žáci ho v malém množství sbírají pro další pokusy, jako je například „pop-test“.
První zaznamenaný případ výroby vodíku lidskou činností se odehrál v první polovině roku 1500, a to podobnou metodou, jaká se ve školách používá nyní: Lékař Theophrastus Paracelsus rozpustil železo v kyselině sírové a pozoroval uvolňování plynu. O tomto pokusu údajně řekl: „Vzduch vzniká a uvolňuje se jako vítr“. Neobjevil však žádnou z vlastností vodíku.1)
Turquet De Mayerne zopakoval Paracelsův pokus v roce 1650 a zjistil, že plyn je hořlavý.2) Ani Paracelsus, ani De Mayerne nenavrhli, že by vodík mohl být novým prvkem. Paracelsus se totiž domníval, že existují pouze tři prvky – tria prima – sůl, síra a rtuť – a že všechny ostatní látky jsou tvořeny různými kombinacemi těchto tří prvků. (3) (Chemie měla před sebou ještě dlouhou cestu!)
V roce 1670 přidal anglický vědec Robert Boyle do kyseliny sírové železo. Ukázal, že vzniklý plyn (vodík) hoří pouze za přítomnosti vzduchu a že část vzduchu (dnes bychom jej nazvali kyslíkem) se při hoření spotřebovává.4)
Vodík jako samostatný prvek poprvé rozpoznal v roce 1766 anglický vědec Henry Cavendish, když jej připravil reakcí kyseliny chlorovodíkové se zinkem. Vodík popsal jako „hořlavý vzduch z kovů“ a zjistil, že se jedná o stejný materiál (podle reakcí a hustoty) bez ohledu na to, který kov a kterou kyselinu k jeho výrobě použil.1) Cavendish také pozoroval, že při spalování látky vzniká voda.
Francouzský vědec Antoine Lavoisier později prvek pojmenoval vodík (1783). Název pochází z řeckého „hydro“, což znamená voda, a „genes“, což znamená tvořící – vodík je jedním ze dvou prvků tvořících vodu.
V roce 1806, kdy byl vodík již dobře zaveden jako prvek, protlačil anglický chemik Humphry Davy silný elektrický proud vyčištěnou vodou.
Zjistil, že se tvoří vodík a kyslík. Pokus prokázal, že elektřina dokáže roztrhnout látky na jednotlivé prvky. Davy si uvědomil, že látky jsou spojeny elektrickým jevem; objevil skutečnou podstatu chemické vazby. 5)
Navštivte stránku Chemicool’s Cool Hydrogen Facts Page.

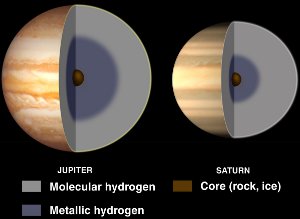
Interiéry Jupiteru a Saturnu s tekutým kovovým vodíkem. Se svolením NASA/JPL-Caltech.

Nasa: Vnější palivová nádrž raketoplánu (oranžová) naplněná kapalným vodíkem a kyslíkem.

Vodíková auta vypouštějí spíše vodu než škodliviny.

Laboratorní elektrolýza vody. Ke štěpení vody se používá elektrická energie. V jedné zkumavce se shromažďuje vodík, v druhé kyslík.
Vzhled a vlastnosti
Škodlivé účinky:
Vodík je vysoce hořlavý a má téměř neviditelný plamen, což může vést k náhodnému popálení.
Vlastnosti:
Vodík je nejjednodušší ze všech prvků a nejlehčí. Je také zdaleka nejrozšířenějším prvkem ve vesmíru. Více než 90 procent atomů ve vesmíru tvoří vodík.
Ve své nejběžnější podobě je atom vodíku tvořen jedním protonem, jedním elektronem a žádnými neutrony. Vodík je jediný prvek, který může existovat bez neutronů.
Vodík je bezbarvý plyn bez zápachu, který při standardní teplotě a tlaku existuje ve formě dvouatomových molekul H2.
Na vzduchu hoří a tvoří výbušné směsi a prudce reaguje s okysličovadly.
Na Zemi je hlavní místo výskytu vodíku ve vodě, H2O. Volného vodíku je na Zemi málo, protože vodík je tak lehký, že ho gravitace planety neudrží. Veškerý vodík, který se vytvoří, nakonec unikne z atmosféry do vesmíru.
Ačkoli je vodík obvykle nekov, stává se tekutým kovem, pokud na něj působí obrovské tlaky.
Takové tlaky se vyskytují uvnitř planet plynných obrů, jako jsou Jupiter a Saturn. Předpokládá se, že vysoké magnetické pole Jupiteru (14krát vyšší než magnetické pole Země) je způsobeno dynamoefektem, který vzniká v důsledku cirkulace elektricky vodivého kovového vodíku při rotaci planety.
Využití vodíku
Velké množství vodíku se používá při Haberově procesu (výroba čpavku), hydrogenaci tuků a olejů, výrobě metanolu, hydrokrakování a hydrodesulfurizaci. Vodík se také používá při rafinaci kovů.
Kapalný vodík se používá jako raketové palivo, například pro pohon raketoplánu Space Shuttle při startu a výstupu na oběžnou dráhu. Kapalný vodík a kyslík jsou uloženy ve velké vnější palivové nádrži raketoplánu. (Viz obrázek vlevo.)
Dva těžší izotopy vodíku (deuterium a tritium) se používají při jaderné fúzi.
Vodíkové hospodářství bylo navrženo jako náhrada naší současné ekonomiky založené na uhlovodících (ropa, plyn a uhlí).
Základem vodíkového hospodářství je, že energie vzniká při spalování vodíku s kyslíkem a jediným vedlejším produktem reakce je voda.
V současné době se však vodík pro automobily na vodíkový pohon vyrábí z uhlovodíků. Teprve až bude možné komerčně využívat například sluneční nebo větrnou energii ke štěpení vody na vodík a kyslík, bude možné vytvořit skutečné vodíkové hospodářství.
Obsah a izotopy
Obsah zemské kůry: 1400 hmotnostních dílů na milion (0,14 %), 2,9 % molů
Obsah sluneční soustavy: 75 % hmotnostních, 93 % molů
Cena, čistý: 12 dolarů za 100 g
Cena, volně ložený: 1 dolar za 100 g
Zdroj: Vodík se komerčně připravuje reakcí přehřáté páry s metanem nebo uhlíkem. V laboratoři lze vodík vyrábět působením kyselin na kovy, jako je zinek nebo hořčík, nebo elektrolýzou vody (na obrázku vlevo).
Izotopy: Vodík má tři izotopy: 1H (protium), 2H (deuterium) a 3H (tritium). Jeho dva těžší izotopy (deuterium a tritium) se používají při jaderné fúzi. Nejrozšířenějším izotopem je procium a nejméně rozšířeným tritium. Tritium je nestabilní s poločasem rozpadu přibližně 12 let a 4 měsíce. Přirozeně se vyskytující vodík je směsí dvou izotopů 1H a 2H s přirozeným výskytem 99,99 % a 0,01 %.

- Peter Hoffmann, Energie zítřka: Vodík, palivové články a vyhlídky na čistší planetu, (2001) str. 22. MIT Press, Cambridge, MA.
- P. Litherland Teed, The Chemistry and Manufacture of Hydrogen., (2008) s2. Dabney Press.
- John S. Davidson, Annotations to Boyle’s „The Sceptical Chymist“.
- Andreas Züttel, Andreas Borgschulte, Louis Schlapbach, Hydrogen as a future energy carrier., (2008) s8. Wiley-VCH, Weinheim.
- Kendall Haven, 100 největších vědeckých objevů všech dob, (2007) s. 62. Libraries Unlimited.
Citujte tuto stránku
Pro online odkazování zkopírujte a vložte jednu z následujících možností:
<a href="https://www.chemicool.com/elements/hydrogen.html">Hydrogen</a>
nebo
<a href="https://www.chemicool.com/elements/hydrogen.html">Hydrogen Element Facts</a>
Chcete-li tuto stránku citovat v akademickém dokumentu, použijte následující citaci v souladu s MLA:
"Hydrogen." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/hydrogen.html>.
.