Det kemiska grundämnet väte klassas som en icke-metall. Det kan bli metalliskt vid mycket höga tryck. Det upptäcktes 1766 av Henry Cavendish.

Data Zone
| Klassificering | Väte är en icke-metall. Den kan bli metallisk vid mycket höga tryck. |
| Färg | färglös |
| Atomvikt | 1.0079 |
| State | Gas |
| Smältpunkt | -259,14 oC, 14,01 K |
| Skokpunkt | -252,87 oC, 20.28 K |
| Elektroner: | 1 |
| Protoner: | 1 |
| Neutroner i den vanligaste isotopen: | 0 |
| Elektronskal | 1 |
| Elektronkonfiguration | 1s1 |
| Täthet @ 20oC | 0.0000899 g/cm3 |
Visa mer, inklusive: Värme, energi, oxidation,
reaktioner, föreningar, radier, ledningsförmåga
| Atomvolym | 14.4 cm3/mol |
| Struktur | hcp: hexagonalt tätt packat (som fast ämne vid låga temperaturer) |
| Hårdhet | – |
| Specifik värmekapacitet | 14.304 J g-1 K-1 |
| Fusionsvärme | 0,117 kJ mol-1 av H2 |
| Förbränningsvärme | 218 kJ mol-1 |
| Förångningsvärme | 0.904 kJ mol-1 av H2 |
| 1:a joniseringsenergi | 1312 kJ mol-1 |
| 2:a joniseringsenergi | kJ mol-1 |
| 3:a joniseringsenergi | 11815.0 kJ mol-1 |
| Elektronaffinitet | 72.7711 kJ mol-1 |
| Minsta oxidationsnummer | -1 |
| Minsta gemensamma oxidationsnummer | -1 |
| Maxsta oxidationsnummer | 1 |
| Maxsta gemensamma oxidationsnummer. | 1 |
| Elektronegativitet (Paulingskala) | 2,18 |
| Volym för polariserbarhet | 0.7 Å3 |
| Reaktion med luft | kraftig, ⇒ H2O |
| Reaktion med 15 M HNO3 | ingen |
| Reaktion med 6 M HCl | ingen |
| Reaktion med 6 M NaOH | ingen |
| Oxid(er) | H2O |
| Hydrid(er) | H2 |
| Klorid(er) | HCl |
| Atomradie | 25 pm |
| Ionisk radie (1+ jon) | – |
| Ionisk radie (2+ jon) | – |
| Ionisk radie (3+ jon) | – |
| Jonisk radie (1- jon) | – |
| Jonisk radie (2-jon) | – |
| Jonisk radie (3-jon) | – |
| Värmeledningsförmåga | 0.1805 W m-1 K-1 |
| Elektrisk ledningsförmåga | – |
| Frys-/Smältpunkt: | -259,14 oC, 14,01 K |

Nasa bild: Stora mängder väte i avlägsna galaxer.

Theophrastus Paracelsus – Den förste som genererade väte: ”Luft uppstår och bryter ut som en vind.”
Upptäckten av vätgas
Ett favoritkemiexperiment i skolan är att tillsätta en metall, till exempel magnesium, till en syra. Metallen reagerar med syran, bildar ett salt och frigör väte från syran. Vätgasen bubblar upp från vätskan och eleverna samlar in den i små mängder för ytterligare experiment, till exempel ”pop-testet”.
Det första dokumenterade exemplet av väte som tillverkats av människan var under första hälften av 1500-talet, med en metod som liknar den som används i skolorna nu.Theophrastus Paracelsus, en läkare, löste upp järn i svavelsyra och observerade att en gas frigjordes. Han rapporteras ha sagt följande om experimentet: ”Luft uppstår och bryter ut som en vind”. Han upptäckte dock inte några av vätgasens egenskaper.(1)
Turquet De Mayerne upprepade Paracelsus experiment 1650 och fann att gasen var brandfarlig.(2) Varken Paracelsus eller De Mayerne föreslog att vätgas skulle kunna vara ett nytt grundämne. Paracelsus trodde nämligen att det bara fanns tre grundämnen – tria prima – salt, svavel och kvicksilver – och att alla andra ämnen bestod av olika kombinationer av dessa tre. (3) (Kemin hade fortfarande en lång väg att gå!)
År 1670 tillsatte den engelske vetenskapsmannen Robert Boyle järn till svavelsyra. Han visade att den resulterande (väte)gasen bara brann om det fanns luft närvarande och att en bråkdel av luften (vi skulle nu kalla den för syre) förbrukades vid förbränningen. 4)
Vätgas erkändes för första gången som ett distinkt grundämne 1766 av den engelske vetenskapsmannen Henry Cavendish, när han framställde det genom att låta saltsyra reagera med zink. Han beskrev väte som ”brännbar luft från metaller” och konstaterade att det var samma material (genom sina reaktioner och sin densitet) oavsett vilken metall och vilken syra han använde för att framställa det.(1) Cavendish observerade också att när ämnet förbrändes producerades vatten.
Den franske vetenskapsmannen Antoine Lavoisier namngav senare grundämnet väte (1783). Namnet kommer från grekiskans ”hydro” som betyder vatten och ”genes” som betyder bildande – väte är ett av de två vattenbildande grundämnena.
In 1806, när väte var väletablerat som grundämne, tryckte den engelske kemisten Humphry Davy en stark elektrisk ström genom renat vatten.
Han fann att väte och syre bildades. Experimentet visade att elektricitet kunde dra isär ämnen till deras beståndsdelar. Davy insåg att ämnen var bundna till varandra genom ett elektriskt fenomen; han hade upptäckt den kemiska bindningens sanna natur.(5)
Visit Chemicool’s Cool Hydrogen Facts Page.

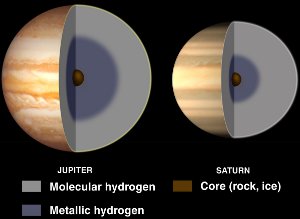
Interiörer av Jupiter och Saturnus, med flytande metalliskt väte. Med tillstånd av NASA/JPL-Caltech.

Nasa: Rymdfärjans externa bränsletank (orange) fylld med flytande väte och syre.

Vätgasbilar släpper ut vatten istället för föroreningar.

Laboratorieelektrolys av vatten. Elektrisk energi används för att dela upp vatten. Vätgas samlas i ett provrör och syre i det andra.
Utseende och egenskaper
Skadliga effekter:
Vätgas är lättantändligt och har en nästan osynlig låga, vilket kan leda till oavsiktliga brännskador.
Egenskaper:
Vätgas är det enklaste grundämnet av alla och det lättaste. Det är också det överlägset vanligaste grundämnet i universum. Över 90 procent av atomerna i universum är väte.
I sin vanligaste form består väteatomen av en proton, en elektron och inga neutroner. Vätgas är det enda grundämne som kan existera utan neutroner.
Vätgas är en färglös, luktfri gas som vid standardtemperatur och standardtryck existerar som tvåatomiga molekyler, H2.
Den brinner och bildar explosiva blandningar i luft och reagerar våldsamt med oxidationsmedel.
På jorden finns vätgas främst i vatten, H2O. Det finns lite fritt vätgas på jorden eftersom vätgas är så lätt att det inte hålls kvar av planetens gravitation. Allt vätgas som bildas undslipper så småningom från atmosfären ut i rymden.
Även om väte vanligtvis är en icke-metall blir det en flytande metall när det utsätts för enorma tryck.
Sådana tryck finns inom gasjätteplaneter som Jupiter och Saturnus. Jupiters höga magnetfält (14 gånger jordens) tros orsakas av en dynamoeffekt till följd av elektriskt ledande metalliskt väte som cirkulerar när planeten roterar.
Användning av vätgas
Stora mängder vätgas används i Haber-processen (framställning av ammoniak), hydrering av fetter och oljor, metanolframställning, hydrokrackning och hydrodesulfurering. Vätgas används också vid metallraffinering.
Flytande vätgas används som raketbränsle, till exempel för att driva rymdfärjans start och uppstigning i omloppsbana. Flytande väte och syre förvaras i rymdfärjans stora externa bränsletank. (Se bilden till vänster.)
Vätgasens två tyngre isotoper (deuterium och tritium) används vid kärnfusion.
Vätgasekonomin har föreslagits som en ersättning för vår nuvarande kolvätebaserade ekonomi (olja, gas och kol).
Grunden för vätgasekonomin är att energi produceras när väte förbränns med syre och den enda biprodukten från reaktionen är vatten.
För närvarande produceras dock vätgasen för vätgasdrivna bilar från kolväten. Först när exempelvis sol- eller vindenergi kan användas kommersiellt för att dela upp vatten till väte och syre kommer en verklig vätgasekonomi att vara möjlig.
Förråd och isotoper
Förråd jordskorpan: 1400 viktdelar per miljon (0,14 %), 2,9 % i mol
Förråd solsystemet: 75 % i vikt, 93 % i mol
Kostnad, ren: 12 dollar per 100 g
Kostnad, bulk: 12 dollar per 100 g
Källa: Vätgas framställs kommersiellt genom att överhettad ånga reagerar med metan eller kol. I laboratoriet kan vätgas framställas genom syrors inverkan på metaller som zink eller magnesium, eller genom elektrolys av vatten (visas till vänster).
Isotoper: Vätgas har tre isotoper, 1H (protium), 2H (deuterium) och 3H (tritium). Dess två tyngre isotoper (deuterium och tritium) används vid kärnfusion. Protium är den vanligaste isotopen och tritium den minst vanliga. Tritium är instabilt med en halveringstid på cirka 12 år och 4 månader. Naturligt förekommande väte är en blandning av de två isotoperna 1H och 2H med naturliga förekomster på 99,99 % respektive 0,01 %.

- Peter Hoffmann, Tomorrow’s Energy: Hydrogen, Fuel Cells, and the Prospects for a Cleaner Planet, (2001) s22. MIT Press, Cambridge, MA.
- P. Litherland Teed, The Chemistry and Manufacture of Hydrogen, (2008) s2. Dabney Press.
- John S. Davidson, Annotations to Boyle’s ”The Sceptical Chymist”.
- Andreas Züttel, Andreas Borgschulte, Louis Schlapbach, Hydrogen as a future energy carrier., (2008) s8. Wiley-VCH, Weinheim.
- Kendall Haven, 100 Greatest Science Discoveries of All Time, (2007) s62. Libraries Unlimited.
Citera denna sida
För att länka online, vänligen kopiera och klistra in något av följande:
<a href="https://www.chemicool.com/elements/hydrogen.html">Hydrogen</a>
eller
<a href="https://www.chemicool.com/elements/hydrogen.html">Hydrogen Element Facts</a>
För att citera denna sida i ett akademiskt dokument, vänligen använd följande MLA-kompatibla citat:
"Hydrogen." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/hydrogen.html>.