Structure, Dynamics, and Function of Aquaporins
 2004 Winner of Visualization Challenge in Science and Engineering,
2004 Winner of Visualization Challenge in Science and Engineering, Organiserad av National Science Foundation och Science Magazine. (Se den relaterade Science-artikeln.)
Vår film om vattenpermeation och 2003 års Nobelpris i kemi
Konsten att transportera vatten i akvaporiner
Akvaporiner är vattenkanaler i membranen som spelar en kritisk roll när det gäller att kontrollera cellernas vatteninnehåll. Dessa kanaler är vitt spridda i alla livets riken, inklusive bakterier, växter och däggdjur. Mer än tio olika akvaporiner har hittats i människokroppen, och flera sjukdomar, t.ex. medfödd grå starr och nefrogen diabetes insipidus, är kopplade till den nedsatta funktionen hos dessa kanaler. De bildar tetramerer i cellmembranet och underlättar transporten av vatten och, i vissa fall, andra små lösningsmedel genom membranen. Vattenporerna är dock helt ogenomträngliga för laddade arter, t.ex. protoner, en anmärkningsvärd egenskap som är avgörande för bevarandet av membranens elektrokemiska potential, men som samtidigt är paradoxal, eftersom protoner vanligtvis lätt kan överföras genom vattenmolekyler. Resultaten av våra simuleringar har nu gett nya insikter i den mekanism som ligger till grund för denna fascinerande egenskap. Vattenmolekyler som passerar kanalen tvingas av proteinets elektrostatiska krafter att vända sig om i mitten av kanalen (se animationen), vilket bryter det alternativa givar- och mottagararrangemanget som är nödvändigt för protonöverföringen (läs hela historien i vår vetenskapliga artikel).

Funktionell betydelse av en märklig proteinarkitektur
År 2000 lyckades Strouds labb vid UCSF lösa den första högupplösta strukturen av en akvaporin genom röntgenkristallografi. Den studerade strukturen var den för E. coliglycerol uptake facilitator (GlpF), som är en akvaglyceroporin, dvs. kanalen är också genomsläpplig för små linjära sockermolekyler, t.ex. glycerol. Nanosekund MD-simuleringar av tetramerisk GlpF i en hydratiserad fläck av POPE-lipiddubbelskiktet karakteriserade den fullständiga vägen för substratledning i kanalen. Analys av substratets vätebindningsinteraktioner med kanalens inre förklarade också för första gången varför dessa kanaler har två karakteristiska slingor i sin arkitektur, inklusive energimässigt ogynnsamma sekundärstrukturelement, som är bevarade i hela akvaporinfamiljen (Jensenet al, Structure, 2001).
Energetics of Sugar Permeation
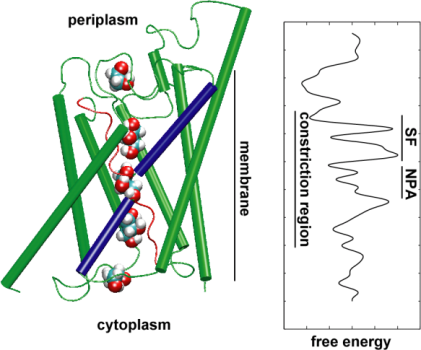
Sedan utforskade vi transporteventets energetik för att förstå vilka barriärer ett substrat måste övervinna under sin passage genom kanalen. För att beskriva den fria energiprofilen beräknade vi potentialen för medelkraft för den fullständiga ledningshändelsen från de banor där glycerolens rörelse genom kanalen påskyndades genom att yttre krafter tillämpades. Denna teknik, som kallas styrd molekyldynamik (SMD), gör det möjligt att observera långsamma händelser inom den tillgängliga tidsskalan för MD-simuleringar. På grund av banornas icke-jämviktskaraktär ställs man dock vid analysen av resultaten inför problemet med irreversibelt arbete som måste räknas in. Med hjälp av Jarzinskys identitet, jämlikheten mellan den fria energin och arbetet i system som inte är i jämvikt, kunde vi fullständigt beskriva energin i glyceroltransporten genom kanalen. Den beräknade potentialen för medelkraft fångar de viktigaste bindningsställena och barriärerna i kanalen i nära överensstämmelse med resultaten av MD-simuleringar vid jämvikt och kristallstrukturen. Dessutom uppvisar den en uttalad asymmetri i sin form, vilket tyder på att proteinets asymmetriska struktur kan vara funktionellt viktig för ett effektivt upptag av näringsmolekyler från omgivningen. (Jensen, etal., PNAS, 2002).
Vad gör en akvaporin till en glycerolkanal
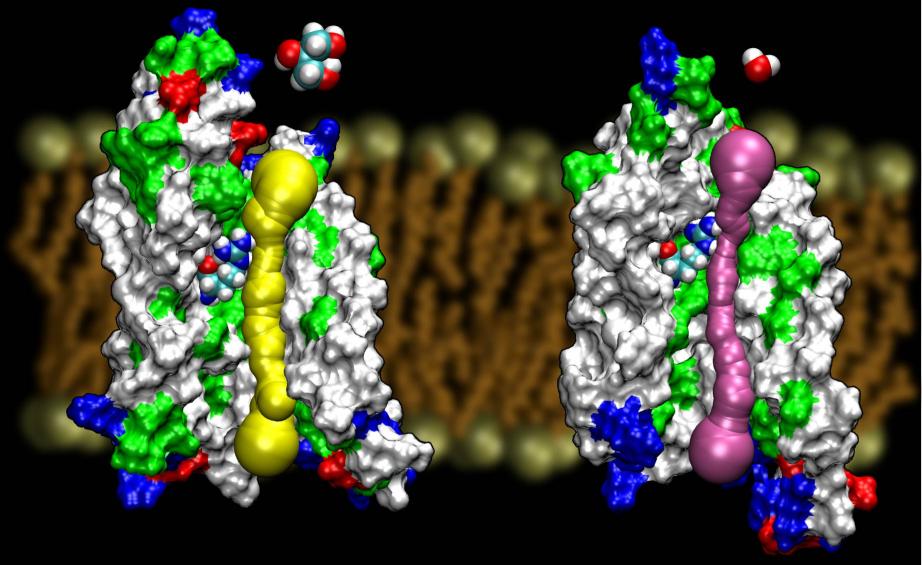
Akvaporiner är en mycket lyckosam familj av membranproteiner, som är notoriskt motståndskraftiga mot strukturbestämning. Vi har nu fått högupplösta strukturer av flera AQP:er: GlpF, AQP1, AQP0 och AqpZ. Fler strukturer väntas snart dyka upp. Tillgången till strukturen av två AQP från E. coli, varav den ena är en ren vattenkanal (AqpZ) och den andra en glycerolkanal (GlpF), gav oss en unik möjlighet att förstå de selektivitetsprinciper som naturen använder sig av när den använder två genetiskt och strukturellt mycket homologa kanaler för membrantrafik av olika material.En jämförelse av de beräknade barriärerna för ledning av glycerol i de två kanalerna visade att AqpZ drar nytta av steriska barriärer för att försvåra för glycerol att gå igenom. Porten är faktiskt totalt sett smalare än GlpF (se figuren nedan). Det verkar som om naturen har använt sig av en mycket grundläggande mekanism, nämligen att ställa in kanalens porstorlek, för att få två proteiner från samma familj att uppvisa olika ledningsegenskaper. Läs hela artikeln i Wang, etal., STRUCTURE, 2005.
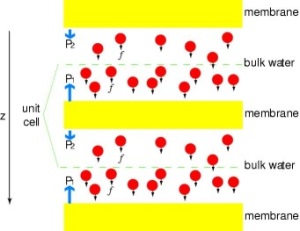
Putting Channels Under Pressure
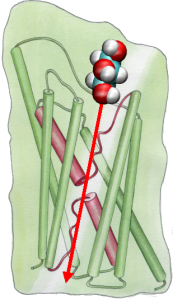
För att direkt jämföra resultaten av MD-simuleringar med biokemiska mätningar av ledningsförmågan hos vattenkanaler i membraner, där osmotiska tryckgradienter används för att framkalla flödet av vatten genom membranen, har vi utvecklat en ny metodik för MD-simuleringar. Genom att applicera små krafter på vattenmolekyler i bulkregionen (se figur) genereras en hydrostatisk tryckgradient över membranet. Tryckgradienten inducerar ledningshastigheter som kan studeras med MD-simuleringar, som vanligtvis är begränsade till några nanosekunder. Metoden har tillämpats vid simulering av vattenpermeation genom GlpF och har resulterat i en linjär korrelation mellan det applicerade trycket och flödet (Zhu et al., Biophys. J., 2002).
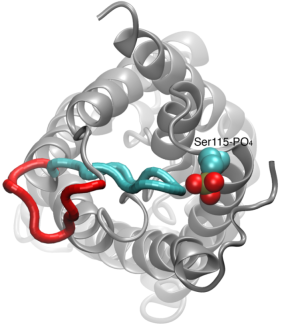
Gating of Water Channels
Vattenpermeation genom akvaporiner är en passiv process som följer riktningen av det osmotiska trycket över membranet. Även om många akvaporiner fungerar som alltid öppna kanaler har en undergrupp av akvaporiner, särskilt i växter, utvecklat en sofistikerad molekylär mekanism genom vilken kanalen kan stängas som svar på hårda miljöförhållanden, under vilka vattenutbyte kan vara skadligt för organismen. Exempel på sådana förhållanden är torkstress och översvämning, som utlöser vissa cellulära signaler (defosforylering och pH-ändring) som leder till att kanalen stängs. En nyligen löst struktur av en akvaporin från spenat simulerades under olika förhållanden för att undersöka den molekylära mekanismen för gating i dessa membrankanaler. Det visade sig att en lång cytoplasmatisk slinga i de akvaporiner som är kapabla att öppna porerna fysiskt blockerar vattenporens ingång i den stängda kanalen och hindrar vattenmolekylerna från att komma in i porerna. Om denna slinga förskjuts som svar på fosforylering, vilket observerades i simuleringar, avlägsnas slingan från porens cytoplasmatiska ingång. Dessutom kommer en hydrofob aminosyra som konformationellt är nära kopplad till denna slinga att dras tillbaka från kanalen till följd av slingans förflyttning. Tillsammans resulterar dessa molekylära händelser i en öppen kanal som är genomtränglig för vattenmolekyler. Studien publicerades i Nature2006.

Gating and Ion Conductivity of the Tetrameric Pore
AQPs är allmänt kända för sin höga permeabilitet för vatten. Det har dock föreslagits att de är inblandade i andra cellulära funktioner, inklusive permeation av små molekyler som inte är vatten och kommunikation mellan celler. Tetramerisering är en vanlig strukturell egenskap hos AQP. Det faktum att de fyra monomererna var och en bildar en funktionellt oberoende vattenpore, men att de kräver en tetramerisk organisation för att fungera, tyder på en synergistisk fördel av oligomerisering och tvingar därmed till ytterligare analys av den centrala porens potentiella roll i AQP. Ett intressant förslag är den centrala porens eventuella inblandning i jonledning vid cGMP-aktivering. Med hjälp av MD-simuleringar av membraninbäddade modeller av AQP1 har vi undersökt denna egenskap hos AQP1 för att fastställa hur, och under vilka konformationella och hydreringsförhållanden, den centrala poran kan leda och hur ledningsförmågan regleras. En av de cytoplasmatiska slingorna, nämligen den argininrika slingan D, föreslogs av våra simuleringar spela en nyckelroll i cGMP-medierad aktivering av den centrala poran. Den föreslagna rollen för slinga D verifierades experimentellt genom en designad mutant av slinga D som visade en fullständig förlust av jonledningsförmåga ( Yu et al., Structure, 2006 ).
Gasmolekyler pendlar in i cellen
Varje morgon åker många människor med bil till jobbet, medan andra cyklar, tar bussen eller tunnelbanan.På samma sätt når olika biomolekyler i människokroppen sina destinationer på olika sätt. För att passera cellmembranet diffunderar till exempel små hydrofoba gasmolekyler genom lipidskiktet, medan vattenmolekyler passerar genom akvaporiner (AQP).Intressant nog har man nyligen upptäckt att vissa gasmolekyler, precis som man kan ta sig till jobbet både med buss och med bil, har mer än ett sätt att passera membranet, dvs, Förutom diffusion genom lipider kan syre och koldioxid också passera genom AQP:s. De vägar som dessa gasmolekyler tar har dock förblivit svårfångade.Med hjälp av molekyldynamik utförd med NAMD har vi undersökt gaspermeabiliteten hos AQP1 med två kompletterande metoder (explicit gasdiffusionssimulering och implicit ligandsampling). Simuleringsresultaten tyder på att AQP1:s fyramonomera porer fungerar som vattenkanaler, men att AQP1:s centrala por kan fungera som en väg för gasmolekyler att korsa membranet (Wang et al., Journal of Structural Biology, 2007 ).
Molekylär hinderbana
Biologiska celler skyddar sitt inre med hjälp av sina cellmembran, men är ändå beroende av import av näringsämnen. De har för denna import utvecklat snabba ledningskanaler som innehåller tillförlitliga kontrollpunkter som skiljer mellan önskvärda och oönskade föreningar. En kontrollpunkt utgör en veritabel hinderbana som endast rätt föreningar kan passera snabbt. Det är svårt att förstå kanalens utformning eftersom det saknas detaljerade experimentella data om näringsämnenas dynamik. För närvarande kommer den mest detaljerade informationen från en beräkning av kanaldynamiken med utgångspunkt i statiska kristallografiska strukturer. I en nyligen genomförd studie undersöktes hur glyceroler, små näringsmolekyler som vissa bakterier behöver, passerar genom kontrollpunkter som realiseras genom glycerolkanalen GlpF. GlpF har fyra parallella kanaler som övervakades med hjälp av NAMD och en ny algoritm som utforskar kanalens energetik tillräckligt snabbt för att vara metodologiskt genomförbar på dagens datorer. Resultaten visar hur glycerolens fysiska egenskaper, deras förmåga att bilda så kallade vätebindningar, deras elektriska dipolmoment, deras diffusionsrörlighet och deras inneboende flexibilitet undersöks längs kanalen (Henin et al, Biophysical Journal, in press ).
Vår akvaporinforskning i nyheterna
|
Aquaporin Team
|
Publikationer
-//W3C//DTD XHTML 1.0 Transitional//EN” ”http://www.w3.org/TR/xhtml1/DTD/xhtml1-transitional.dtd”>Publications Databas Diffusion av glycerol genom Escherichia coli aquaglyceroporin GlpF.Jerome Henin, Emad Tajkhorshid, Klaus Schulten och Christophe Chipot. Biophysical Journal, 94:832-839, 2008. Utforskning av gaspermeabilitet hos cellmembran och membrankanaler med molekyldynamik Yi Wang, Jordi Cohen, Walter F. Boron, Klaus Schulten och Emad Tajkhorshid. Journal of Structural Biology, 157:534-544, 2007. Mekanism för gating och jonledningsförmåga hos en möjlig tetramerisk por i Aquaporin-1.Jin Yu, Andrea J. Yool, Klaus Schulten och Emad Tajkhorshid. Structure, 14:1411-1423, 2006. Structural mechanism of plant aquaporin gating.S. Törnroth-Horsefield, Y. Wang, K. Hedfalk, U. Johanson, M. Karlsson, E. Tajkhorshid, R. Neutze och P. Kjellbom. Nature, 439:688-694, 2006. Vad gör en akvaporin till en glycerolkanal: En jämförande studie av AqpZ och GlpF.Yi Wang, Klaus Schulten och Emad Tajkhorshid. Structure, 13:1107-1118, 2005. Kinetisk teori och simulering av vattentransport i en enda kanal Emad Tajkhorshid, Fangqiang Zhu och Klaus Schulten. I S. Yip, redaktör, Handbook of Materials Modeling, Vol. I: Methods and Models, s. 1797-1822. Springer, Nederländerna, 2005. Emad Tajkhorshid, Jordi Cohen, Aleksij Aksimentiev, Marcos Sotomayor och Klaus Schulten. I Boris Martinac och Andrzej Kubalski, redaktörer, Bacterial ion channels and their eukaryotic homologues, s. 153-190. ASM Press, Washington, DC, 2005. Kollektiv diffusionsmodell för vattenpermeation genom mikroskopiska kanaler Fangqiang Zhu, Emad Tajkhorshid och Klaus Schulten. Physical Review Letters, 93:224501, 2004. (4 sidor). Beräkningsstudier av membrankanaler.Benoit Roux och Klaus Schulten. Structure, 12:1343-1351, 2004.