Över 200 000 personer har genomgått transkateter aortaklaffbyte (TAVR), och varje år får cirka 140 000 patienter en kirurgisk bioprotesklaff.1,2 Trots denna ökande volym är den optimala postoperativa antikoagulationsstrategin ofta oklar. Särskilt två frågor understryker svårigheten i beslutsfattandet för dessa vanliga kliniska scenarier:
- Under de första månaderna efter bioprotesklaffbyte, vilka komplikationer försöker vi minska med antikoagulation?
- Bör antikoagulation ges till alla patienter för att minska dessa komplikationer? Eller bör vi ha ett mer selektivt tillvägagångssätt baserat på riskfaktorer?
Trombotiska risker efter bioprotesklaffbyte
Traditionsenligt har resonemanget om antikoagulation under de första månaderna efter kirurgiskt klaffbyte varit att mildra trombotiska komplikationer, som förmodligen är relaterade till suturmaterial och en syring som ännu inte är täckt av biofilm och endoteliserat.3,4 De möjliga efterföljande trombotiska komplikationerna är trefaldiga: tromboemboliska händelser, öppen trombos i klaffen och subklinisk organiserad trombos som kan försämra klaffens funktion på lång sikt. Trots frekvensen av bioprotesklaffbyte är data relaterade till dessa komplikationer begränsade, delvis på grund av att dessa händelser till synes är sällsynta.
En nyligen genomförd metaanalys belyste den låga händelsefrekvensen efter bioprotesklaffbyte. I denna analys av 31 740 patienter, främst med kirurgiskt aortaklaffbyte, inträffade tidiga tromboemboliska händelser hos 145 patienter (1 %) som tog vitamin K-antagonister och 262 patienter (1,5 %) som inte tog vitamin K-antagonister (odds ratio 0,96; 95 % konfidensintervall, 0,60-1,52).5 Om vi antar att det faktiskt finns en 0,5 % ökning av tromboemboliska komplikationer under de första månaderna efter kirurgiskt aortaklaffbyte hos patienter som inte tar vitamin K-antagonister, skulle en randomiserad kontrollerad studie med lämplig effekt kräva cirka 15 500 patienter.6 Hittills har två randomiserade prövningar genomförts med sammanlagt 268 patienter.7,8 Med tanke på det lilla antalet patienter är avsaknaden av en statistiskt påvisbar skillnad mellan de två grupperna inte förvånande.
I avsaknad av stora randomiserade kontrollerade studier måste kliniker vända sig till observationsstudier för att få insikt, såsom analysen från det danska nationella patientregistret.9 I denna studie av 4 075 patienter med bioprotesiska aortaklaffbyten var avbrytande av warfarin förknippat med ökade tromboemboliska händelser och kardiovaskulära dödsfall 1-6 månader efter operationen. Intressant nog, även om strokefrekvensen ökade under de första 3 månaderna i behandlingsgruppen, var antalet strokes mellan 3 och 6 månader inte annorlunda mellan patienter som fortsatte eller avbröt warfarin, även om det bara var 21 händelser under denna period. Dessutom fanns det ingen skillnad i blödningshändelser mellan 3 månader och 1 år. Denna observation går stick i stäv med tidigare rapporter och klinisk erfarenhet om att patienter på warfarin löper större risk att läggas in på sjukhus på grund av blödning.5 Därför kan författarnas slutsatser om kardiovaskulär dödlighet och tromboemboliska händelser ha varit relaterade till kvarvarande förväxling. Specifikt kan det inte ha funnits någon skillnad i blödningshändelser eftersom kliniker var mindre benägna att påbörja eller fortsätta antikoagulation hos högriskpatienterna.
Tyvärr ger publicerade data, jämfört med tromboemboliska händelser, ännu sämre insikt i inferentiella associationer för trombos i bioprotesklaffar. Få händelser har rapporterats och det mesta av litteraturen är begränsat till fallserier och erfarenheter från ett enda center.10 Följaktligen är incidensen av trombos i bioprotesklaffar inte väldefinierad, även om i en studie endast 8 av 4 568 patienter med bioprotesiska aortaklaffar krävde reoperation för aortastenos relaterad till trombos.11 På samma sätt är betydelsen av kliniskt tyst trombos och eventuell accelererad degeneration av bioprotesklaffen i stort sett okänd.
Selektiv antikoagulering efter byte av bioprotesisk klaff
Baserat på en oklar storleksordning av nyttan och en väl accepterad blödningsrisk är universell antikoagulering efter byte av bioprotesisk aortaklaff svårt att rättfärdiga; denna osäkerhet återspeglas i rekommendationen av klass IIb i 2014 års riktlinjer för hjärtklaffarsjukdomar från American College of Cardiology och American Heart Association (ACC/AHA).12 Det kan dock uppstå specifika kliniska situationer där antikoagulation bör övervägas i högre grad. I en nyligen genomförd fall-kontrollstudie som omfattade 46 patienter med reoperation för trombos i bioprotesisk aortaklaff, var till exempel en ökning >50 % av de genomsnittliga Dopplergradienterna på ekokardiografi från baslinjen, ökad kuddtjocklek och onormal rörlighet hos kuddarna alla förknippade med klafftrombotisering.13 Därför kan en prövning av antikoagulering och uppföljande ekokardiografi för att bedöma Dopplergradienterna övervägas hos dessa patienter,14 även om det är oklart i vilken utsträckning klaffens kort- och långtidsverksamhet modifieras av antikoagulationen.
Det verkar dessutom som om patienter med en bioprotesisk mitralisklaff har högre risk för tromboemboliska händelser och klafftrombos (se det illustrativa fallet med figur 1-2 och video 1-2 nedan). Eftersom byte av bioprotesisk mitralisklaff är mycket mindre vanligt än byte av aortaklaff är uppgifterna ännu mer begränsade. I en singelcenterstudie av 216 patienter med bioprotesisk mitralisk ventilersättning fick dock 10 (5 %) en ischemisk stroke inom 6 månader.15 I en annan studie av 149 konsekutiva patienter utvecklade dessutom 9 (6 %) bioprotesisk mitralisk ventiltrombotisering.16 Därför verkar patienter med bioprotesisk mitralisklaffersättning ha en högre risk, och rutinmässig antikoagulation bör övervägas under 3-6 månader, vilket återigen återspeglas av rekommendationen klass IIa i ACC/AHA:s riktlinjer för valvulära hjärtsjukdomar från 2014.12
Illustrativt fall: Bioprotesisk mitralisklaffartrombos
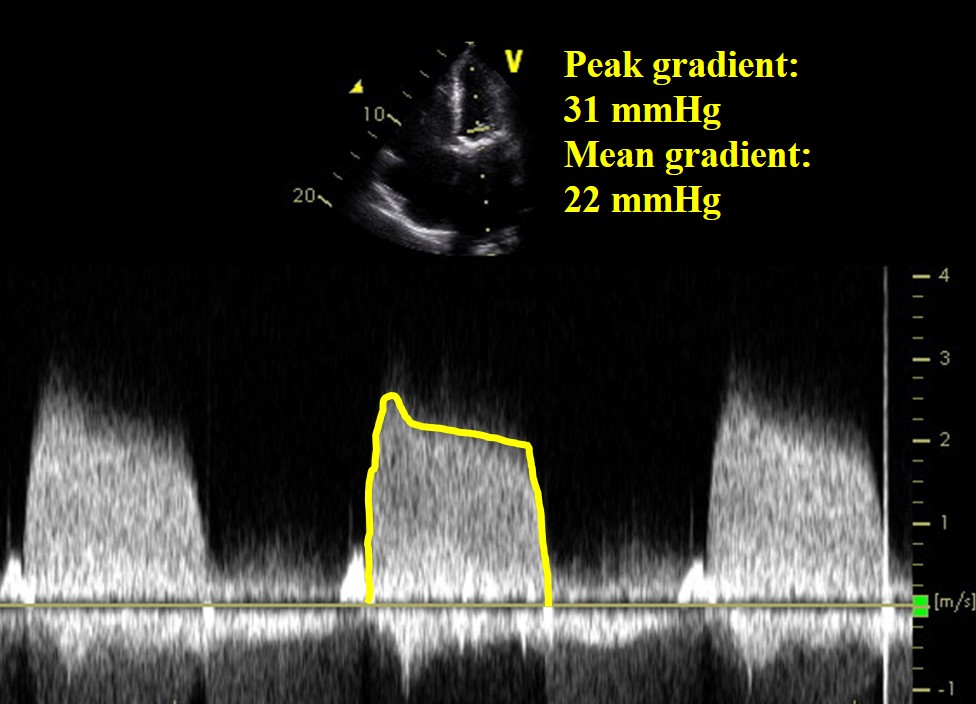
En 71-årig kvinna presenterade sig med hjärtsvikt 8 månader efter bioprotesisk mitralisklaffersättning för reumatisk mitralisk stenos. Postoperativt hade hon behandlats med coumadin i 3 månader och fortsatte med aspirin. Hon hade ingen anamnes på förmaksflimmer och hade varit afebril, och blododlingar var negativa.
Video 1
Figur 1
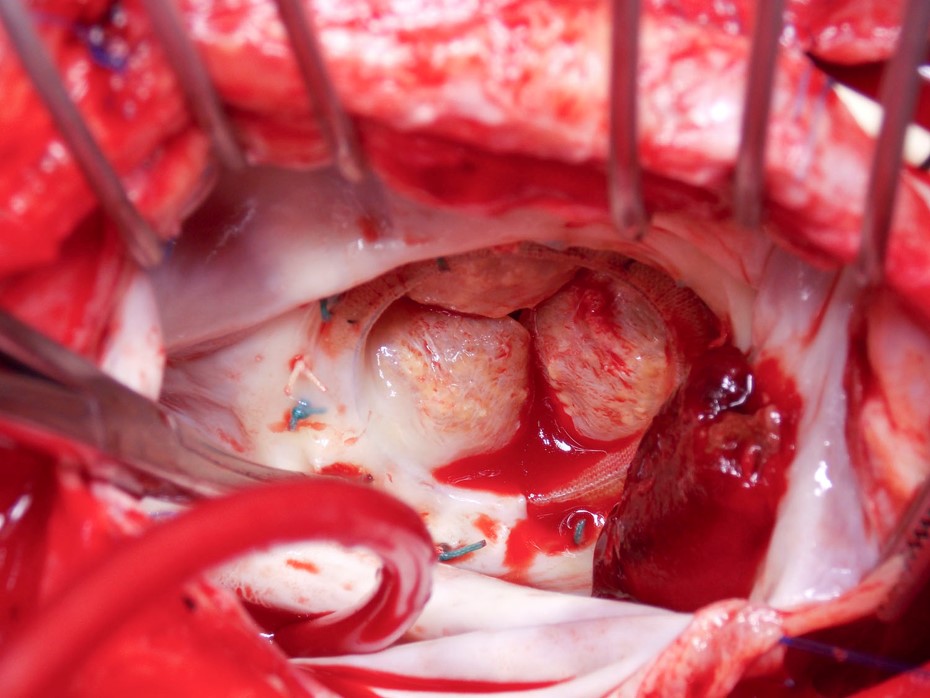
Video 2
Figur 2
Finalt, och kanske mest omtvistat, är huruvida vårt tillvägagångssätt när det gäller antikoagulation bör skilja sig åt för patienter som har fått TAVR. Den ursprungliga standardinställningen har varit att behandla dessa patienter med aspirin och klopidogrel eftersom detta var den metod som tillämpades i de randomiserade studierna. På senare tid har man med hjälp av elektrokardiografiskt styrd fyrdimensionell datortomografiangiografi (CTA) beskrivit minskad rörlighet av bioprotesens aortaklaffblad och hypoattenuerad bladförtjockning, vilket tyder på klafftrombotisering.17,18 Ofta är dessa patienter symtomfria och har normala Dopplergradienter vid ekokardiografi, vilket tyder på att dessa fynd kan vara subkliniska. Det är viktigt att dessa CTA-avvikelser kan försvinna med warfarin, och avsaknad av initial antikoagulation framstår som en möjlig riskfaktor.19 För närvarande är dock dessa bilddiagnostiska fynd av oklar klinisk betydelse.20 Lyckligtvis pågår en randomiserad studie, GALILEO (Global Study Comparing a Rivaroxaban-Based Antithrombotic Strategy to an Antiplatelet-Based Strategy After Transcatheter Aortic Valve Replacement to Optimize Clinical Outcomes), där rivaroxaban jämförs med trombocytaggregationsdämpande behandling efter TAVR, och den bör ge värdefulla insikter.21 Trots att det uppskattas att 1 520 patienter kommer att delta i studien är det möjligt att studien inte är tillräckligt kraftfull för kliniska händelser.
Slutsatser
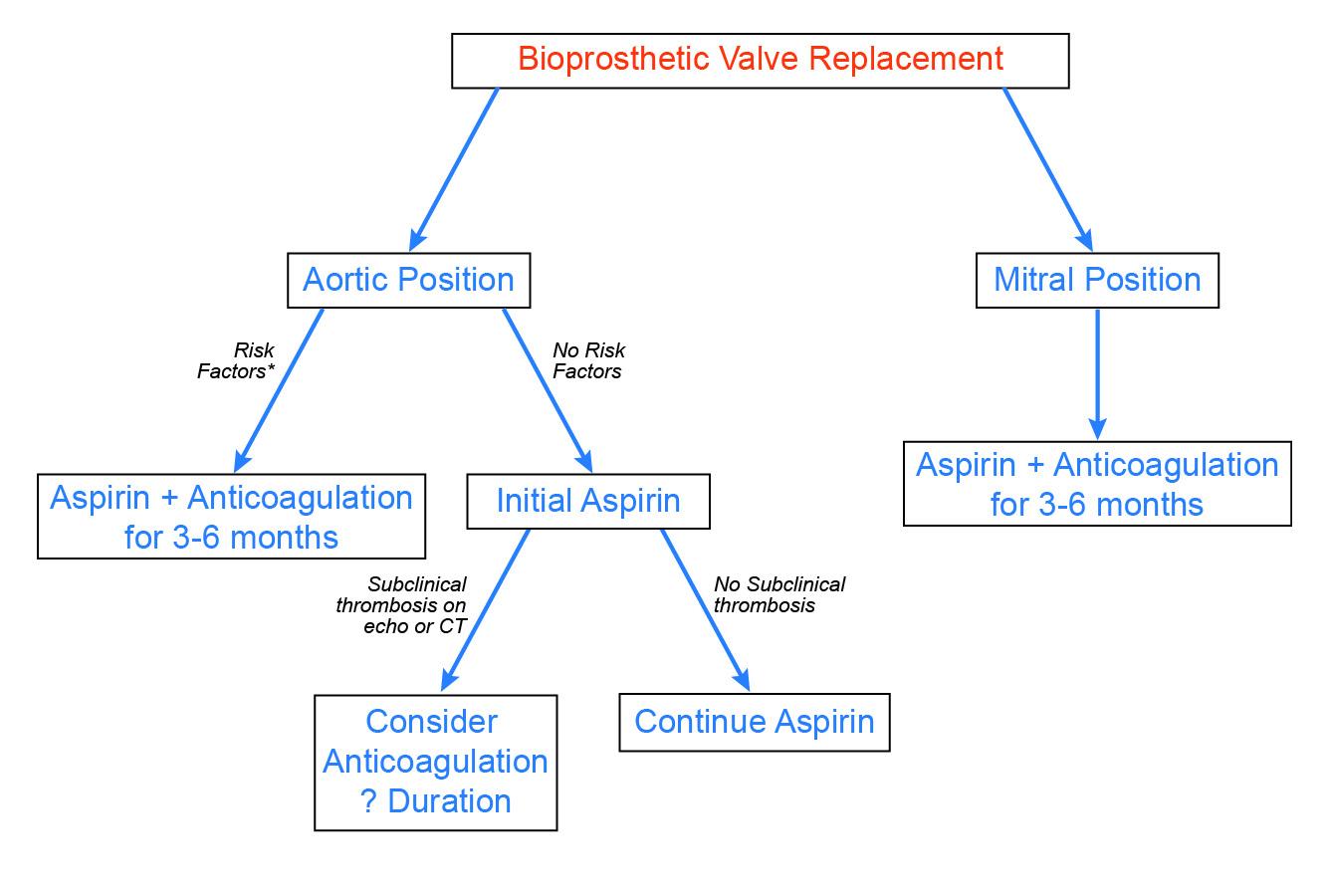
Samt sett är tidiga icke-procedurella tromboemboliska händelser ovanliga hos patienter med bioprotesklaffar. Dessutom är förekomsten av öppen klafftrombos sannolikt låg, och effekten av subakut klafftrombos på klaffens hållbarhet håller fortfarande på att definieras. Med tanke på dessa observationer, tillsammans med den ökade blödningsrisken med warfarin, förespråkar vi ett selektivt tillvägagångssätt för postoperativ antikoagulation (figur 3). För patienter med bioprotesiska aortaklaffar är antikoagulation i 3-6 månader indicerad hos patienter med etablerade riskfaktorer, t.ex. förmaksflimmer. På grundval av nya bevis bör antikoagulation och noggrann uppföljning övervägas hos patienter med onormala ekokardiografiska eller CTA-fynd, t.ex. en oförklarlig ökning av Doppler-gradienterna i klaffen eller en hypoattenuerad förtjockning av klaffbladet. Slutligen verkar patienter med bioprotesiska mitralisklaffar ha en högre risk för trombotiska komplikationer, även om det finns färre uppgifter tillgängliga, och rutinmässig antikoagulation i 3-6 månader rekommenderas.
Figur 3: Förslag till tillvägagångssätt för antikoagulering efter bioprotesisk klaffersättning
Denna artikel innehåller utbildningsmaterial avsett för legitimerad hälso- och sjukvårdspersonal och är avsedd att användas enbart i utbildnings- och informationssyfte. Även om innehållet kan handla om specifika medicinska och hälsovårdsrelaterade frågor är det inte en ersättning för eller ett substitut för personlig medicinsk rådgivning och är inte avsett att användas som enda grund för att fatta individualiserade medicinska eller hälsorelaterade beslut. De åsikter och åsikter som uttrycks är de bidragande författarnas och redaktörernas och representerar inte nödvändigtvis ACC:s åsikter. Materialet är inte avsett att presentera de enda, eller nödvändigtvis bästa, metoderna eller förfarandena för de medicinska situationer som tas upp, utan är snarare avsett att representera ett tillvägagångssätt, en åsikt, ett uttalande eller en åsikt.
- Pibarot P, Dumesnil JG. Hjärtklaffproteser: val av optimal protes och långtidsbehandling. Circulation 2009;119:1034-48.
- Mack MJ, Douglas PS, Holmes DR. Shedding More Light on Valve Thrombosis After Transcatheter Aortic Valve Replacement. J Am Coll Cardiol 2016;67:656-8.
- Heras M, Chesebro JH, Fuster V, et al. High risk of thromboemboli early after bioprosthetic cardiac valve replacement. J Am Coll Caridol 1995;25:1111-9.
- Roudaut R, Serri K, Lafitte S. Trombos av protesiska hjärtklaffar: diagnos och terapeutiska överväganden. Heart 2007;93:137-42.
- Masri A, Gillinov AM, Johnston DM, et al. Antikoagulation kontra trombocythämmande behandling eller ingen behandling hos patienter som genomgår implantation av bioprotesklaffar: en systematisk genomgång och metaanalys. Heart 2017;103:40-80.
- R Core Team (2015). R: Ett språk och en miljö för statistiska beräkningar. R Foundation for Statistical Computing; Wien, Österrike. Tillgänglig på: https://www.R-project.org/. (Användning av funktionen power.prop.test α = 0,05 och β = 0,8)
- Aramendi JI, Mestres CA, Martinez-León J, Campos V, Muñoz G, Navas C. Triflusal versus oral antikoagulering för primärprevention av tromboembolism efter byte av bioprotesklaffar (trac): prospektiv, randomiserad, kooperativ studie. Eur J Cardiothorac Surg 2005;27:854-60.
- Colli A, Mestres CA, Castella M, Gherli T. Comparing warfarin to aspirin (WoA) after aortic valve replacement with the St. Jude Medical Epic heart valve bioprosthesis: results of the WoA Epic pilot trial. J Heart Valve Dis 2007;16:667-71.
- Mérie C, Køber L, Skov Olsen P, et al. Association of warfarin therapy duration after bioprosthetic aortic valve replacement with risk of mortality, thromboembolic complications, and bleeding. JAMA 2012;308:2118-25.
- Cremer PC, Rodriguez LL, Griffin BP, et al. Early Bioprosthetic Valve Failure: Mechanistic Insights via Correlation between Echocardiographic and Operative Findings. J Am Soc Echocardiogr 2015;28:1131-48.
- Brown ML, Park SJ, Sundt TM, Schaff HV. Tidig trombosrisk hos patienter med biologiska klaffar i aortaposition. J Thorac Cardiovasc Surg 2012;144:108-11.
- Nishimura RA, Otto CM, Bonow RO, et al. 2014 AHA/ACC guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2014;63:e57-185.
- Egbe AC, Pislaru SV, Pellikka PA, et al. Bioprosthetic Valve Thrombosis Versus Structural Failure: Kliniska och ekokardiografiska prediktorer. J Am Coll Cardiol 2015;66:2285-94.
- Stewart WJ. Trombotisering av bioprotesklaffar: Can We Afford to Ignore It? J Am Coll Cardiol 2015;66:2295-7.
- Russo A, Grigioni F, Avierinos JF, et al. Tromboemboliska komplikationer efter kirurgisk korrigering av mitralregurgitation incidens, prediktorer och kliniska konsekvenser. J Am Coll Cardiol 2008;51:1203-11.
- Butnaru A, Shaheen J, Tzivoni D, Tauber R, Bitran D, Silberman S. Diagnostisering och behandling av tidig bioprotesisk funktionsstörning i mitralisklaffen på grund av trombusbildning. Am J Cardiol 2013;112:1439-44.
- Makkar RR, Fontana G, Jilaihawi H, et al. Possible Subclinical Leaflet Thrombosis in Bioprosthetic Aortic Valves. N Engj J Med 2015;373:2015-24.
- Pache G, Schoechlin S, Blanke P, et al. Early hypo-attenuated leaflet thickening in balloon-expandable transcatheter aortic heart valves. Eur Heart J 2016;37:2263-71.
- Hansson NC, Grove EL, Andersen HR, et al. Transcatheter Aortic Valve Thrombosis: Incidence, Predisposing Factors, and Clinical Implications. J Am Coll Cardiol 2016;68:2059-69.
- Laschinger JC, Wu C, Ibrahim NG, Shuren JE. Minskad bladrörelse i bioprotesiska aortaklaffar – FDA:s perspektiv. N Engj J Med 2015;373:1996-8.
- Global studie som jämför en rivAroxaban-baserad antitrombotisk strategi med en antipLatelet-baserad strategi efter transkateter aortIc vaLve rEplacement to Optimize Clinical Outcomes (GALILEO) (webbplatsen ClinicalTrails.gov). 2016. Tillgänglig på: https://clinicaltrials.gov/ct2/show/NCT02556203. Tillgänglig 2016-11-29.
Kliniska ämnen: Antikoagulationshantering, Arytmier och klinisk EP, Hjärtkirurgi, Hjärtsvikt och kardiomyopatier, Invasiv kardiovaskulär angiografi och intervention, Icke-invasiv avbildning, Valvulär hjärtsjukdom, Antikoagulationshantering och förmaksflimmer, Förmaksflimmer/upraventrikulära arytmier, Aortakirurgi, Hjärtkirurgi och arytmier, Hjärtkirurgi och hjärtsvikt, Hjärtkirurgi och VHD, Akut hjärtsvikt, Interventioner och bildbehandling, Interventioner och strukturell hjärtsjukdom, Angiografi, ekokardiografi/ultraljud, nukleär avbildning
Nyckelord: Aortaklaff, Aortaklaffstenos, Förmaksflimmer, Aspirin, Bioprotes, Fall-kontrollstudier, Angiografi, Förträngning, patologisk, Ekokardiografi, transesofageal, Elektrokardiografi, Hjärtsvikt, Hjärtklaffssjukdomar, Hjärtklaffproteser, mitralklaff, mitralklaffstenos, reoperation, riskfaktorer, stroke, suturer, trombos, ticlopidin, transkateter aortaklaffbyte, K-vitamin, warfarin
< Tillbaka till listorna