Huvudskillnaden – sterisk vs. torsionell spänning
Spänning är avstötningen mellan bindningselektroner i en molekyl. En molekyls arrangemang beror på strain eftersom bindningselektronpar arrangeras på ett sätt som minimerar strain. Det finns tre huvudtyper av spänningar som kan finnas i en molekyl. De är vinkelspänning, vridspänning och sterisk spänning. Vinkelspänningen uppstår när bindningsvinklarna i verkliga molekyler skiljer sig från de ideala molekylernas. Torsionsspänningen uppstår när en molekyl roteras runt en bindning. Sterisk spänning bildas när två eller flera skrymmande grupper kommer nära varandra. Den största skillnaden mellan sterisk och torsionell spänning är att sterisk spänning inte kan minskas genom att rotera molekylen runt en bindning medan torsionell spänning kan minskas genom att rotera molekylen runt en bindning.
Nyckelområden som täcks
1. Vad är sterisk spänning
– Definition, förklaring med exempel
2. Vad är torsionsspänning
– Definition, förklaring med exempel
3. Vad är skillnaden mellan sterisk och torsionsspänning
– Jämförelse av de viktigaste skillnaderna
Nyckelbegrepp: Vinkelspänning, bindningselektronpar, sterisk spänning, torsionsspänning

Vad är sterisk spänning
Den steriska spänningen är avstötningen mellan två atomer eller grupper av atomer när avståndet mellan dem minskas. Detta kallas också för steriskt hinder. Den steriska spänningen är mycket viktig när det gäller att bestämma en molekyls arrangemang eftersom varje molekyl är arrangerad på ett sådant sätt att den steriska spänningen minimeras. När det steriska hindret är minimerat minskar molekylens potentiella energi. Eftersom materia är stabil när den har en lägre energinivå gör en molekyls lägre energinivå den till en stabil molekyl.
Begreppet sterisk spänning är mycket viktigt när det gäller att förutsäga produkterna av en kemisk reaktion. Detta beror på att grupper av atomer är knutna till en kolatom på ett sådant sätt att det steriska hindret minimeras. Därför kommer en kemisk reaktion att ge en blandning av molekyler där stabila produkter och instabila produkter ingår. Men huvudbeståndsdelen i denna blandning kommer alltid att vara den stabila produkten med ett minimerat steriskt hinder.

Figur 1: Sterisk belastning i organiska föreningar
Som framgår av bilden ovan ökar den potentiella energin hos en molekyl beroende på hur stor sterisk belastning de har. När avståndet mellan två metylgrupper minskar ökar den potentiella energin.
Figur 2: Den steriska spänningen ökar när skrymmande grupper är närvarande
Ovanstående bild visar att den steriska spänningen ökar när skrymmande grupper är närvarande. Mer steriskt hindrade molekyler har en högre potentiell energi jämfört med mindre steriskt hindrade molekyler. Därför är mindre steriskt hindrade molekyler mer stabila.
Vad är torsionsspänning
Torsionsspänning är den avstötning som uppstår mellan atomer eller grupper av atomer när en molekyl roteras runt en sigma-bindning. Detta är den repulsion som kan observeras när bindningselektroner passerar förbi varandra. Denna typ av spänning är viktig för att bestämma stabila konformationer hos organiska föreningar. Dessa konformationer kan representeras av Newman-projektioner. Newmanprojektionen av en molekyl är molekylens konformation när man tittar genom C-C-bindningen från fram- och bakåtriktningen.
Torsionsspänningen uppstår när de skrymmande gruppernas dihedralvinkel är låg. Dihedralvinkeln är vinkeln mellan två bindningar av två olika kolatomer i en Newmanprojektion. Om dihedralvinkeln är hög är torsionsspänningen låg.
Newmanprojektioner finns i två typer som staggered konformation och eclipsed konformation. Den eclipsed konformationen visar en hög torsionsspänning än den för staggered konformation.
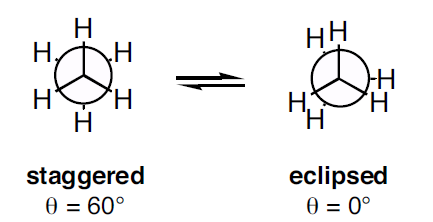
Figur 3: Två typer av Newmanprojektion
Som framgår av bilden ovan visar staggered konformationen en dihedralvinkel på 60o och eclipsed konformationen visar en dihedralvinkel på 0o. Men när molekylen roteras ändras konformationen. Torsionsspänningen i den förskjutna konformationen är lägre än i den förskjutna konformationen. När molekylen roteras kan eclipsed-konformationen bli staggered-konformationen; därmed minskar torsionsspänningen.
Skillnaden mellan sterisk och torsionsspänning
Definition
Sterisk spänning: Sterisk spänning: Sterisk spänning är avstötningen mellan två atomer eller grupper av atomer när avståndet mellan dem minskar.
Torsionsspänning: Sterisk spänning är den avstötning som uppstår mellan två atomer eller grupper av atomer när avståndet mellan dem minskar:
Molekylens rotation
Sterisk spänning: Den steriska spänningen är den avstötning som uppstår mellan atomer eller grupper av atomer när en molekyl roteras runt en sigma-bindning: Sterisk spänning: Sterisk spänning kan inte minskas genom att rotera molekylen runt en sigma-bindning.
Torsionsspänning: Den steriska spänningen kan inte minskas genom att rotera molekylen runt en sigma-bindning: Torsionsbelastning kan minskas genom att rotera molekylen runt en sigma-bindning.
Bakgrund för belastningen
Sterisk belastning: Den steriska belastningen kan inte minskas genom att rotera molekylen runt en sigma-bindning:
Sterisk spänning: Sterisk spänning uppstår när avståndet mellan skrymmande grupper i en molekyl minskar.
Torsionsspänning: Sterisk spänning uppstår när avståndet mellan skrymmande grupper i en molekyl minskar:
Slutsats
Den strain som uppstår i en molekyl är avstötningen mellan bindningselektroner eller ensamelektronpar som finns i molekylen. Denna repulsion gör att molekylens potentiella energi ökar. Därefter gör den molekylen instabil. En molekyls steriska spänning bestäms av de skrymmande grupper som finns i en molekyl och avståndet mellan dessa skrymmande grupper. Newmanprojektion är en enkel struktur som visar hur atomer eller grupper av atomer är ordnade i en organisk molekyl. Den kan användas för att bestämma en molekyls torsionsbelastning. Den huvudsakliga skillnaden mellan sterisk och torsionsbelastning är att sterisk belastning inte kan minskas genom att rotera molekylen runt en bindning medan torsionsbelastning kan minskas genom att rotera molekylen runt en bindning.
1. ”Torsionsbelastning”. OChemPal, tillgänglig här. Tillgänglig 28 augusti 2017.
2. ”Strain (Chemistry).” Wikipedia, Wikimedia Foundation, 25 juli 2017, tillgänglig här. Tillgänglig 28 augusti 2017.
3. ”Dihedral Angle”. OChemPal, tillgänglig här. Accessed 28 Aug. 2017.
Image Courtesy:
1. ”Napthalene phenanthraene methyl-methyl strai” By DMacks – Own work (Public Domain) via Commons Wikimedia
2. ”Steric hindrance disp” By Mwolf37 – Own work (CC BY-SA 3.0) via Commons Wikimedia
3. ”Escalonada e eclipsada” By Pauloquimico – Own work (CC BY-SA 3.0) via Commons Wikimedia
![]()