14.1 Introduktion till neuropeptider och kväveoxid
Klassiska neurotransmittorer (t.ex. glutamat och ACh) fungerar genom riktningsöverföring av information mellan presynaptiska frisättningsställen och postsynaptiska kluster av receptorer. Processen är i allmänhet väl organiserad rumsligt med en viss, men mycket begränsad, ”spillover” av transmittor mellan angränsande synapser. Situationen är helt annorlunda när det gäller överföring som förmedlas av neuropeptider och kväveoxid (NO). Dessa molekyler ignorerar informationsflödets riktning och påverkar i stället ett område från den plats där de släpps ut. Denna egenskap motsvarar i stort sett frisättningen av peptidhormoner i blodomloppet, som kan transporteras till avlägsna platser för att åstadkomma sina effekter. NO kan till exempel produceras i en postsynaptisk neuron och diffundera tillbaka till den presynaptiska neuronen eller till andra angränsande neuroner som påverkar den efterföljande frisättningen av transmittor. Denna egenskap kallas retrograd överföring, eftersom signalen färdas i motsatt riktning (post- till pre-) jämfört med den klassiska riktningen för neurotransmission.
14.2 Neuropeptider
Många neuropeptider beskrevs ursprungligen som hormoner (t.ex. somatostatin och cholecystokinin), även om de, när de väl karakteriserats, senare också hittades i neuroner inom CNS. Neuropeptider ger vanligen upphov till neuronala reaktioner med långsam start och lång varaktighet (figur 14.1), och varje karakteriserad neuropeptidreceptor hör till klassen GPCR (G-proteinkopplad receptor). Som jämförelse visar figur 14.1 typiska reaktioner som framkallas av en klassisk neurotransmittor (glutamat) som verkar på en jonotropisk receptor och en neuropeptid. En aktionspotential som utlöses i neuron 1 (i grönt), ett glutamatfrisättande neuron, ger upphov till den snabba (5 msek) EPSP som är typisk för glutamatmedierad synaptisk överföring. Däremot ger en aktionspotential i neuron 2 (lila), som frisätter neuropeptid, ett långsamt (5 sek. till topp) och långvarigt (10 sek.) EPSP. Dessa långsamma EPSP:er är typiska för neuropeptidverkan eftersom alla neuropeptidreceptorer är G-proteinkopplade.
Figur 14.1
För övrigt ger många neuropeptider inte upphov till någon uppenbar elektrofysiologisk förändring i den postsynaptiska neuronen. Till exempel ger en aktionspotential i neuron 3 (figur 14.1; rosa) inget svar i den postsynaptiska neuronen även om man på andra sätt kan bekräfta att neuropeptider frigjorts. Det har dock skett förändringar i den postsynaptiska neuronen, vilket avslöjas i exemplet som visas i panelerna med beteckningen ”C”. Om man först mäter glutamatsvaret (C1) genom att stimulera neuron 1, ser man ett typiskt svar. Stimulering av neuron 3 ger inget svar (C2) som tidigare. Om neuron 1 stimuleras igen efter stimulering av neuron 3 ökar dock den EPSP som mäts i den postsynaptiska neuronen (C3) (den ursprungliga EPSP är den heldragna linjen och EPSP efter stimulering av neuron 3 är den streckade linjen). Den neuropeptid som frigjordes från neuron 3 förändrade alltså den postsynaptiska neuronens svar på en annan neurotransmittor. Dessa neuropeptider sägs vara neuromodulatorer eftersom deras effekter är att förstärka eller dämpa effekterna av en andra sändare. Andra exempel på sådan heterosynaptisk plasticitet beskrivs i kapitel 7, del 2.
14.3 Klassificering av peptider i familjer
Neuropeptider kan grupperas i familjer baserat på likheter i deras aminosyrasekvenser (tabellerna I och II).
Tabell I
Neuropeptidfamiljer
Takykininer: substans P, bombesin, substans
Insuliner: insulin, insulinliknande tillväxtfaktorer
Somatostatiner: somatostatin, pankreatisk polypeptid
Gastriner: Opioider: opiocortiner, enkefaliner, dynorfin
Opioider: opiocortiner, enkefaliner, dynorfin
Opiater grupperas till exempel som en familj på grund av den identiska aminosyresekvensen Tyr-Gly-Gly-Phe– (tabell II) som finns vid N-terminen av varje opiat.
| Tabell II Opiatfamiljens sekvensidentitet i kursiv stil |
|
| Namn | Aminosyrasekvens |
| Leu-enkefalin | Tyr-Gly-Gly-Phe-Leu-OH |
| Met-enkefalin | Tyr-Gly-Gly-Phe-Met-OH |
| Beta-endorphin | Tyr-Gly-Gly-Phe-Met-Thr-Ser-Glu-Lys- Ser-Gln-Thr-Pro-Leu-Val-Thr-Leu- Phe-Lys-Asn-Ala-Ile-Val-Lys-Asn-Ala- His-Lys-Gly-Gln-His-OH |
| Dynorphin | Tyr-Gly-Gly-Phe-Leu-Arg-Arg-Ile-Arg- Pro-Lys-Leu-Lys-Lys-Trp-Asp-Asn-Gln-OH |
14.4 Biosyntes och reglering
Figur 14.2
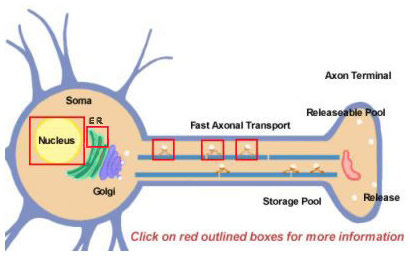
Neuropeptider härleds från större prekursorer genom proteolytisk bearbetning. De syntetiseras alla initialt i soman (figur 14.2). Prekursorer bildas initialt genom translation på polyribosomer som är fästa vid det endoplasmatiska retikulumet nära cellkroppen. Därifrån går de vidare genom Golgiapparaten där ytterligare modifieringar sker, bland annat glykosylering. De paketeras sedan i sekretoriska granuler som transporteras till terminaler genom snabb axonal transport. Snabb är dock en relativ term och beror på de relativt långa sträckor som vissa neuropeptider måste färdas. Det kan krävas många timmar för att fylla på poolen av frisättbara neuropeptider. Under transporten till nervterminalen börjar proteaser som är förpackade i vesikeln att klyva neuropeptidprekursorn till dess slutliga mogna form. Denna bearbetning är nödvändig för aktiveringen av neuropeptiderna eftersom prekursorerna är biologiskt inaktiva. Minst tre typer av bearbetning sker i vesiklarna (figur 14.2; klicka på rutorna för mer information). Först klyver ett endopeptidas prekursorn för att generera två nya produkter (första rutan i axon). För många prekursorer sker denna klyvning efter basiska rester (som Lys och Arg) och utförs av trypsinliknande proteaser. Därefter, men inte för alla neuropeptider, klyver ett karboxypeptidas de basiska resterna från C-terminus av den nya peptiden (andra rutan i axonet). Slutligen omvandlar ett tredje enzym COOH-gruppen (carboxy) i en Gly-resurs, som finns vid C-terminalen i många neuropeptider, till en NH2-grupp (amid) för att producera den mogna, aktiva formen av neuropeptiden.
14.5 Flera mekanismer används för att producera mångfalden av neuropeptider
De flesta proteiner produceras från mRNA-molekyler som splicas från prekursor-RNA till sina slutliga former i kärnan. Differentiell splicing är ett sätt som en neuron använder för att diversifiera produktionen av olika typer av neuropeptider. Ett välkänt exempel är substans P-mRNA som normalt också innehåller mRNA som kodar för substans K. Substans K-delen av mRNA:t kan splicas differentiellt så att det resulterande mRNA:t endast kan producera substans P (klicka på rutan över kärnan i figur 14.2)
Figur 14.3
Neuropeptider produceras från ett längre prekursorprotein genom proteolytisk bearbetning. Ett utmärkt exempel är opioidfamiljen av peptider (t.ex. bearbetningen av proopiomelanocorticotropin, POMC och Enkephalin; se figur 14.3). Som nämnts sker den proteolytiska bearbetningen inom transportvesiklarna och sker oftast genom att prekursorn klyvs på den N-terminala sidan av basiska rester (arginin och lysin), även om andra klyvningsställen också har identifierats. I vissa fall, t.ex. i Enkephalin-prekursorproteinet, finns det flera kopior av samma slutliga bioaktiva peptid. Den ena prekursormolekyl som visas högst upp i figur 14.3 innehåller sex kopior av Met-enkefalin (ME) och en kopia av Leu-enkefalin (LE).
Diversitet kan alltså skapas genom att ändra sekvensen av klyvningsställena genom differentiell splicing, genom att producera och/eller paketera olika proteaser (som känner igen olika sekvenser för klyvning) i transportvesiklarna, eller genom att dölja en proteolytisk plats genom posttranslationella modifieringar. Ett exempel på det sistnämnda är att en specifik klyvningsplats kan döljas genom tillägg av en kolhydratsidokedja som steriskt blockerar proteaset från att få tillgång till den platsen. Ett annat vanligt resultat är att en enda prekursormolekyl innehåller flera olika neuropeptider (se figur 14.3) och att det därför är den typ av bearbetning som sker som i slutändan avgör vilken neuropeptid som frisätts av neuronen. POMC-prekursorproteinet kan klyvas för att bilda ACTH (orange) och β-lipoprotein (ljusblått) som var och en kan klyvas ytterligare för att generera ytterligare bioaktiva neuropeptider (figur 14.3). Till exempel kan β-lipoproteinet (ljusblått) klyvas ytterligare till både γ-lipoprotein (gröna ränder) och β-endorfin (mörkblått). Återigen, beroende på vilken bearbetning som sker, kan samma prekursorprotein modifieras för att producera neuropeptider med dramatiskt olika biologiska reaktioner.
14.6 Frisättning
Figur 14.4
Peptider frisätts genom kalciumberoende exocytos med några viktiga skillnader från frisättningen av klassiska neurotransmittorer. Typiskt sett är vesiklar som frigör neuropeptider mycket större än vesiklar som innehåller små molekylära neurotransmittorer (t.ex. glutamat) och kräver ingen presynaptisk specialisering för frisättning (se elektronmikrografen i figur 14.4). Till skillnad från de små vesiklarna som innehåller glutamat verkar de stora vesiklarna inte dockade vid membranet. Denna observation stämmer överens med idén att små molekylära neurotransmittorer ger korta, lokala effekter (vid synaptiska kopplingar), medan neuropeptider ger långsamma, långvariga effekter som ofta omfattar ett betydande område kring platsen för frisättning. Man bör också komma ihåg att eftersom neuropeptider syntetiseras i cellens soma och inte lokalt vid synapsen, kan det ta flera timmar att fylla på de frigörbara poolerna om deras förråd är uttömt efter en långvarig frisättning. Till exempel har en motorneuron, vars cellkropp finns i ryggmärgen och synapsen i foten, en axon som är så lång som en meter. Med snabb axonal transport skulle det kunna ta mer än en dag för en nysyntetiserad neuropeptid att nå synapsen från soman. Det borde också vara uppenbart att endogena smärtdödande neuropeptider, som beta-endorfin, skulle kunna ”förbrukas” vid ihållande stimulering, vilket leder till situationer där smärtan inte längre kan kontrolleras av endogena mekanismer.
En typisk mogen neuron frisätter ofta en småmolekylär neurotransmittor och en eller flera neuropeptider (som i exemplet i figur 14.4). Om mer än en neuropeptid frisätts kommer de oftast från samma enskilda prekursormolekyl. Ett exempel är den samtidiga frisättningen av både ACh och calcitonin genrelaterad peptid från spinala motorneuroner. CGRP aktiverar adenylatcyklas, ökar cAMP-nivåerna och förstärker den kontraktionskraft som produceras av ACh-aktivering av den nikotiniska ACh-receptorn. I detta fall är neuropeptiden modulerande enligt beskrivningen i figur 14.1. I det här fallet potentierar dock effekten muskelkontraktionen i stället för att öka storleken på EPSP:n. I båda exemplen beror det potentierade svaret på ökad känslighet hos systemet för en konstant mängd frisatt neurotransmittor.
14.6 Upphörande av verkan
Neuropeptider avlägsnas långsamt från det extracellulära rummet; en egenskap som också bidrar till deras relativt långvariga effekter. Inaktivering sker både genom diffusion och nedbrytning av extracellulära proteaser. Inga bevis har hittats för att peptidåterupptag skulle vara ett sätt att avsluta deras verkan.
14.7 Receptorer är alla G-proteinbundna
Alla kända neuropeptidreceptorer producerar sina effekter genom att ändra nivåerna av intracellulära andra budbärare. Dessa receptorer är sju transmembransträckta proteiner som är kopplade via G-proteiner (GPCR) för att ändra aktiveringen av andra cellulära enzymer. Denna egenskap är förenlig med att neuropeptiderna framkallar en långsammare reaktion och är väl lämpad för en reglerande roll. En viktig skillnad mellan små och neuropeptidmolekylära transmittorer är att neuropeptidreceptorer har en hög affinitet för bindning (nanomolär) i motsats till den mikro- eller millimolära affinitet som uppmäts för små molekylära neurotransmittorer (som glutamat). Eftersom neuropeptiderna inte släpps ut riktat i synapsens begränsade volym når deras koncentrationer inte mycket höga nivåer och receptorerna måste då ha hög affinitet för att reagera på dessa små koncentrationer. Denna höga affinitet gör att neuropeptiden långsammare avskiljs från sin receptor och bidrar också till de långvariga effekterna av dessa molekyler.
14.8 Kväveoxid (NO)
Kväveoxid har fått stor uppmärksamhet som grundare av en ny klass av gasformiga budbärarmolekyler. NO är den aktiva molekyl som sublingualt nitroglycerin producerar för att öka vasodilatationen vid lindring av angina pectoris. Andra viktiga biologiska effekter av NO är nu kända. I nervsystemet är NO till exempel viktigt för regleringen av det cerebrala blodflödet, för moduleringen av neurotransmissionen och för toxicitet i samband med olika patologiska tillstånd.
14.9 Egenskaper hos NO
Sammanfattning av NO:s egenskaper
- Gas som diffunderar fritt genom membraner
- Kortlivad med en halverad livslängd.livslängd mätt i sekunder
- Hög reaktiv fri radikal
- Toxisk vid höga koncentrationer
NO är en kortlivad gas som inte ska förväxlas med den relativt stabila bedövningsgasen lustgas (skrattgas). NO är egentligen en fri radikal och är därför en mycket reaktiv förening. En del av dess toxiska effekter beror sannolikt på att NO reagerar med superoxid för att producera den destruktiva radikalen peroxynitrat. NO anses vara en okonventionell neurotransmittor eftersom den inte frigörs genom exocytos och dess verkan inte sker genom konventionella receptormolekyler.
Som tidigare nämnts anser den typiska beskrivningen av neuronal kommunikation att överföringen är enkelriktad. En presynaptisk neurotransmittor frisätts som ger upphov till förändringar i den postsynaptiska neuronen. Flera ämnen (som neuropeptider och NO) som produceras i postsynaptiska neuroner sprids i den lokala miljön och påverkar de omgivande cellerna. Eftersom NO är en fritt diffusibel gas har den potential att snabbt färdas i vilken riktning som helst från produktionsplatsen. Om NO till exempel produceras i en postsynaptisk cell på grund av stimulering av en glutamatreceptor kan det frigöras i den lokala miljön och sända en signal tillbaka till den presynaptiska neuronen (figur 14.5). Denna typ av aktivitet kallas retrograd signalering eftersom signalen färdas i retrograd riktning från den postsynaptiska till den presynaptiska neuronen.
Figur 14.5
Figur 14.6
Figurerna 14.5, 14.6 och 14.7 sammanfattar de viktigaste aspekterna av NO-syntesen. I detta exempel frigörs glutamat från den presynaptiska terminalen som binder till NMDA-receptorer på det postsynaptiska membranet, vilket gör att de öppnas och tillåter Ca2+-inflöde. Ca2+ aktiverar calmodulin som binder till och aktiverar enzymet kväveoxidsyntas (NOS). Med arginin som substrat producerar NOS NO och en andra reaktionsprodukt, citrullin. NO kan sedan fritt diffundera ut i omgivningen och interagera med den presynaptiska terminal som ursprungligen släppte ut glutamatet eller någon annan cell i den lokala miljön. Inse att varje process som höjer det intracellulära Ca2+ potentiellt kommer att aktivera NOS. Glutamataktivering av NMDA-receptorer är bara ett väldokumenterat exempel.
Figur 14.7
14.10 Syntes av kväveoxidsyntas (NOS) och frisättning
NO produceras av enzymet kväveoxidsyntas (NOS). Detta enzym finns i en subpopulation av neuroner (1-2 % av neuronerna i cortex) och finns i de flesta endotelceller. Minst en form av NOS i dessa celler är beroende av kalcium och kalmodulin för aktivering, vilket framgår av figurerna 14.5, 14.6 och 14.7. Den innehåller också kofaktorer som liknar cytokrom P-450. Dessa kofaktorer är NADPH (nikotinamidadenin-dinukleotidfosfat, FAD (flavinadeninmononukleotid) och FMN (flavinmononukleotid). Dessa kofaktorer är nödvändiga för den överföring av elektroner som ger upphov till den instabila och kortlivade produkten NO. Substratet i denna reaktion är den vanliga aminosyran arginin och produkterna är citrullin och NO (figur 14.5). På grund av NO:s korta livslängd är den utomordentligt svår att mäta direkt. I experimentella preparat finns det dock en utmärkt korrelation mellan applicering av NMDA, som ökar intraneuronalt Ca2+ och aktiverar NOS, och produktionen av tilläggsprodukten från NOS:s enzymatiska aktivitet, citrullin (se figur 14.8). Citrullinproduktionen är en tillförlitlig indikator på NO-produktionen. Det är också möjligt att blockera produktionen av citrullin (och NO) genom att ge cellerna det icke-metaboliserbara substratet för NOS som benämns metylarginin (figur 14.9), och sådana föreningar har använts för att minska produktionen av NO och avsluta dess biologiska effekter.
|
Figur 14.8 |
Figur 14.9 |
14.11 ”Receptorer” för NO
Figur 14.10
Ett av de viktigaste målen för NO verkar vara enzymet guanylylcyklas. Denna upptäckt gjordes indirekt genom att övervaka ackumuleringen av NOS-produkten citrullin samtidigt som man övervakade produktionen av cGMP, en produkt från enzymet guanylylcyklas (figurerna 14.8 och 14.9). I detta experiment tillsattes NMDA till ett neuronpreparat för att aktivera NOS. NOS använder arginin som substrat för att producera NO och som nämnts, om en icke hydrolyserbar analog som metyl-arginin tillsätts i systemet, konstaterades citrullin- och cGMP-ackumulationen upphöra på samma dosberoende sätt. Dessa starka korrelationer ledde till upptäckten att guanylylcyklas är ett huvudmål för NO.
Guanylylcyklas är ett ovanligt enzym eftersom det har en hemring med en associerad järnmolekyl som en del av sin struktur. NO aktiverar detta enzym genom att binda till järn i hemen, vilket initierar produktion av cykliskt GMP från GTP (figur 14.10) genom konformationsförändringar i enzymet. cGMP aktiverar sedan ett cGMP-beroende proteinkinas och andra enzymer som beskrivs nedan. Spektrumet av effekter som produceras av aktiveringen av cGMP-beroende proteinkinas börjar först nu förstås.
14.12 Biologiska effekter av NO
NO ger upphov till en mängd olika biologiska effekter. Tyvärr är vi särskilt okunniga om NO:s roll när det gäller att modulera cellulära processer i nervsystemet. NO:s roll i regleringen av kärlsystemet är väldokumenterad och verkar spela en lika viktig roll i nervsystemet.
14.13 Vasodilator
Figur 14.11
Klicka här för att se en förstorad bild.
Under normala omständigheter bidrar NO till kontrollen av blodflödet i hjärnans blodkärl. En snabb återkopplingsmekanism existerar nödvändigtvis för att förse mer aktiva områden i hjärnan med nödvändiga näringsämnen. Denna mekanism är nödvändig på grund av hjärnans svaga reserv av energilager. NO produceras i neuroner som innehåller NOS och som är ihållande aktiva. Dessa förhållanden gynnar aktivering av NMDA-receptorer, vilket är känt för att orsaka NO-produktion. NO diffunderar från dessa lokaliserade områden med hög neuronal aktivitet till den omgivande mikrovaskulaturen (figur 14.11) och orsakar vasodilatation och ökat blodflöde.
Även om de exakta mekanismerna genom vilka NO producerar vasodilatation ännu inte är definierade, vet man att aktivering av cGMP-beroende proteinkinas i glatta muskelceller orsakar en avslappning av kärlen. Eftersom ett av NO:s viktigaste mål är guanylylcyklas (som producerar cGMP och aktiverar cGMP-beroende proteinkinas), antas det att en viktig väg för NO:s vasodilaterande verkan går via cGMP-beroende proteinkinas. Aktivering av detta kinas leder indirekt till minskade Ca2+-nivåer i de glatta muskelcellerna och därefter till defosforylering av myosinkontraktilapparaten som orsakar relaxation (figur 14.12). I glatta muskelceller verkar NO också direkt hyperpolarisera cellerna möjligen genom att aktivera K+-kanaler, vilket leder till sekundär stängning av Ca2+-kanaler som också ger muskelavslappning. Sammanfattningsvis verkar en av NO:s viktigaste funktioner vara att integrera nivån på neuronal aktivitet med lokala förändringar i det cerebrala blodflödet för att upprätthålla adekvat perfusion av metaboliskt aktiv vävnad.
Figur 14.12
14.14 Neuromodulator
NO tros också fungera som en lokalt diffusibel budbärare. Det produceras av varje åtgärd som höjer Ca2+ i celler som innehåller NOS, t.ex. glutamatstimulering av NMDA-receptorer. Genom efterföljande aktivering av guanylylcyklas och produktion av cGMP påverkar NO-produktionen en rad sekundära processer. Dessa omfattar direkt modulering av jonkanaler, stimulering av cGMP-beroende proteinkinas och både upp- och nedreglering av cAMP-fosfodiesteras. Effekterna i efterföljande led är sedan många och omfattar upp- och nedreglering av Ca2+-kanaler, ökad excitabilitet (ökar neuronernas eldningsfrekvens), ökad eller minskad frisättning av neurotransmittorer och förändringar i neuronernas morfologi.
14.15 Toxicitet
NO i överskott är giftigt för celler. Det finns dock en paradox när det gäller NO-toxicitet. Celler som producerar höga nivåer av NO är resistenta mot dess toxiska effekter. Till exempel används NO-toxicitet av makrofager och neutrofiler som en mekanism för att döda tumörceller och bakterier. Ingen av de celltyper som producerar NO är dock mottagliga för dess skadliga effekter. Detta konstaterande gäller även för neuroner i det centrala nervsystemet. Överskott av glutamat inducerar neurotoxicitet i hjärnan och anses vara den främsta orsaken till neurondöd vid sjukdomar som Huntingtons eller Alzheimers sjukdom eller efter akut stroke eller trauma. Överskottsproduktion av NO tros spela en viss roll i denna neuronala förlust på grund av dess toxicitet när det produceras i överskott. Intressant nog är celler som har en positiv färgning för enzymet NOS skonade i degenererande områden av hjärnan som drabbats av dessa sjukdomar. Dessa cellers motståndskraft verkar likna motståndskraften hos de immunceller som beskrivs ovan.
Testa dina kunskaper
- Fråga 1
- A
- B
- C
- D
- E
Neuropeptider finns i synaptiska terminaler eftersom de är:
A. Syntetiseras i terminalen.
B. Förda genom snabb axonal transport
C. Bärs genom diffusion
D. Bäras av långsam axonal transport
E. Tas upp från det extracellulära rummet
Neuropeptider finns i synaptiska terminaler eftersom de är:
A. Syntetiseras i terminalen. Detta svar är felaktigt.
Det syntetiska maskineri som behövs för syntesen av peptider och proteiner finns inte i axonterminalen.B. Bärs av snabb axonal transport
C. Bbärs genom diffusion
D. Bäras av långsam axonal transport
E. Tas upp från det extracellulära rummet
Neuropeptider finns i synaptiska terminaler eftersom de är:
A. Syntetiseras i terminalen.
B. Transporteras genom snabb axonal transport Detta svar är RÄTT!
Neuropeptider syntetiseras i cellkroppen och bearbetas i vesiklar som transporteras till axonterminaler längs mikrotubuli via snabb axonal transport.C. Transporteras genom diffusion
D. Transporteras genom långsam axonal transport
E. Tas upp från det extracellulära rummet
Neuropeptider finns i synaptiska terminaler eftersom de är:
A. Syntetiseras i terminalen.
B. Förda genom snabb axonal transport
C. Bärs genom diffusion Detta svar är INKORREKT.
Diffusion är också en utmärkt mekanism för att förflytta molekyler över korta avstånd (några mikrometer), men den är ineffektiv när det gäller att förflytta molekyler över de avstånd som typiskt skiljer neuronsoman från axonterminalerna.D. Bärs av långsam axonal transport
E. Tas upp från det extracellulära rummet
Neuropeptider finns i synaptiska terminaler eftersom de är:
A. Syntetiseras i terminalen.
B. Förda genom snabb axonal transport
C. Bärs genom diffusion
D. Bäras genom långsam axonal transport Detta svar är INKORREKT.
Det är också viktigt att så snabbt som möjligt fylla på tillgången på neuropeptider till terminalerna. I detta fall är snabbare bättre.E. Tas upp från det extracellulära rummet
Neuropeptider finns i synaptiska terminaler eftersom de är:
A. Syntetiseras i terminalen.
B. Förda genom snabb axonal transport
C. Bärs genom diffusion
D. Bäras av långsam axonal transport
E. Tas upp från det extracellulära utrymmet Detta svar är INKORREKT.
Det finns ingen känd upptagningsmekanism för att ta bort neuropeptider från det extracellulära utrymmet. Deras verkningsmekanism avslutas genom diffusion och genom enzymatisk nedbrytning av extracellulära proteaser.
- Fråga 2
- A
- B
- C
- D
- E
Nitric Oxide:
A. Har en lång livslängd
B. Är membranpermeabel.
C. Är icke reaktiv
D. Är även känd som skrattgas.
E. Är icke-toxisk för celler.
Nitric Oxide:
A. Har en lång livstid Detta svar är felaktigt.
NO har en halveringstid som mäts i sekunder och är mycket instabil.B. Är membranpermeabel.
C. Är icke reaktiv
D. Är även känd som skrattgas.
E. Är icke-toxisk för celler.
Nitric Oxide:
A. Har en lång livslängd
B. Är membranpermeabel. Detta svar är RÄTT!
NO är fritt genomsläppligt för membran och påverkar alla celler inom en viss radie från dess produktionsplats.C. Är icke reaktiv
D. Är även känd som skrattgas.
E. Är giftfri för celler.
Nitric Oxide:
A. Har en lång livslängd
B. Är membranpermeabel.
C. Är icke-reaktiv Detta svar är felaktigt.
NO är en mycket reaktiv fri radikal. Den reagerar med proteiner, lipider och nukleinsyra och har en särskilt hög affinitet för reducerade metaller (t.ex. Fe2+ i guanylylcyklasets hemgrupp).D. Är även känd som skrattgas.
E. Är icke-toxisk för celler.
Nitric Oxide:
A. Har en lång livslängd
B. Är membranpermeabel.
C. Är icke reaktiv
D. Är även känd som skrattgas. Detta svar är FELFULLT.
Lustig gas är dikväveoxid och inte kväveoxid. Den är icke-reaktiv och icke-toxisk men påverkar membranegenskaperna.E. Är icke-toxisk för celler.
Nitric Oxide:
A. Har en lång livslängd
B. Är membranpermeabel.
C. Är icke reaktiv
D. Är även känd som skrattgas.
E. Är icke-toxisk för celler. Detta svar är FEL.
NO är mycket giftigt för cellerna när det produceras i överskott. Faktum är att överproduktion av NO tros orsaka vissa neurodegenerativa sjukdomar. NO produceras också av makrofager som den giftiga produkten för att döda invaderande bakterier.