INLEDNING
Amyloidos är en sjukdom som orsakas av extracellulär ackumulering av fibriller vars källa består av proteiner med en instabil struktur som veckar sig, aggregerar och genomgår avlagring.1 Sådana avlagringar kan förändra vävnadsstrukturen och försämra funktionen hos olika organ och system.2
Amyloidfibriller är olösliga och proteolysresistenta och färgas vanligen med Kongoröd och uppvisar en intensiv gulgrön dubbelriktning i polariserat ljus.3 Mer än 30 proteiner kan orsaka amyloidavlagring, men endast 5 orsakar betydande avlagring i hjärtvävnad1:
- –
Ljuskedjor, som orsakar primär amyloidos (AL).
- –
Transthyretin (TTR), som orsakar TTR-amyloidos (ATTR).
- –
Apolipoprotein A.
- –
Fibrinogen.
- –
Serum amyloidprotein A, som ger upphov till sekundär amyloidos.
Primär amyloidos och ATTR är de vanligaste formerna av kardiell amyloidos, AL-formen har historiskt sett ansetts vanligare i industriländerna.3
De flesta uppgifter om hjärtamyloidos har baserats på AL. Men även om antalet patienter med AL har förblivit stabilt har antalet ATTR-diagnoser nyligen ökat och man tror nu att ATTR kan vara mycket vanligare än AL.2
Transthyretinamyloidos har mycket ofta varit föremål för feldiagnoser eller betydande förseningar tills den korrekta diagnosen ställs. Orsakerna är bland annat heterogenitet i dess former, behovet av histologisk bekräftelse, brist på specialiserad utrustning och felaktiga uppfattningar bland vissa kardiologer om att det är en sällsynt sjukdom utan behandlingsalternativ.2,3
Dessa aspekter håller dock på att förändras. Diagnosen har konsekvenser för patienthanteringen. Specifika behandlingar har utvecklats som kan fördröja eller stabilisera nedläggningen och som är mer effektiva i tidiga stadier. En tidig diagnos är därför avgörande. I denna översikt beskrivs viktiga framsteg på senare tid inom diagnostik och behandling av ATTR, vilket ger hopp för patienter med detta tillstånd.
TRANSTHYRETIN CARDIAC AMYLOIDOSIS
Transthyretin är ett tetrameriskt plasmaprotein som ansvarar för att transportera tyroxin och retinolbundet protein. Det syntetiseras i första hand i levern och i andra hand i plexus choroidus och retinala pigmentepitelet.4
Transthyretin tenderar att dissociera till dimerer och monomerer, som missmonteras till fibriller och genomgår avlagring. Punktmutationer eller effekten av ålder kan öka denna tendens, vilket ger upphov till de två kliniska formerna av ATTR: mutant (ATTRm) och vildtyp (ATTRwt).
MUTANT TRANSTHYRETIN AMYLOIDOSIS
Mer än 120 mutationer är för närvarande kända för att orsaka ATTRm. Dessa mutationer uppvisar ett autosomalt dominant arvsmönster, med varierande penetrans.4 På grund av den stora geografiska spridningen är det svårt att fastställa prevalensen av ATTR, men den anses vara en sällsynt sjukdom med en prevalens på mindre än 1/100 000 invånare2 (tabell 1)
Huvudsakliga kliniska och diagnostiska egenskaper hos muterade och vilda-Type Transthyretin Cardiac Amyloidosis
| ATTRwt | ATTRm | |
|---|---|---|
| Prevalens | Okänd. Tydligen mycket vanlig | |
| Genetisk undersökning | Frivaro av mutationer i TTR | Mutationer i TTR |
| Typisk ålder vid presentation | > 60 y | Variabel beroende på orsakande mutation |
| Kön | Manlig dominans. 80 % av patienterna | Manlig dominans, med mer aggressiv fenotyp |
| Extrakardiella manifestationer | – Karpaltunnelsyndrom (33 %-49 %) – Lumbala spinal stenos – Traumatisk ruptur av biceps senan (32 %) |
– Ascenderande bilateral sensorisk-motorisk polyneuropati – Dysautonomi: Ortostatisk hypotension, diarré-konstipation, erektil dysfunktion – Ögonpåverkan: Glaukom, intravitrealt nedfall, |
| Kardiell funktionsnedsättning | Konstant | Variabel beroende på orsakande mutation |
| Kardiell effekt | – Hjärtsvikt (53%-86%) – Konduktionsstörningar – AF (43%-67%) – Degenerativ AoS |
– Konduktionsstörningar – Hjärtsvikt – Ovanlig AF (10%) |
| Diagnostiska tekniker | ||
| EKG | – Pseudoinfarktmönster (63%-66%) – Låg spänning (22%-33%) – Sokolow LVH (6%-13%) |
– Pseudoinfarktmönster (18%-69%) – Låg spänning (2%-25%) – Sokolow LVH (3%-8%) |
| ECHO | – Måttlig-svår hypertrofi – Mild-moderat nedsatt LVEF (30%) |
– Måttlig hypertrofi – LVEF, typiskt bevarad |
| Kardiell MRT | – Sen förstärkning – Förhöjd inhemsk T1 och EV |
|
| 99mTc DPD scintigrafi | – Grad 2-3 | – Grad 0: Asymtomatiska bärare – Grad 1: initial hjärtpåverkan – Grad 2-3: Betydande hjärtpåverkan |
AF, förmaksflimmer; AoS, aortastenos; ATTRm, mutant transthyretin amyloidos; ATTRwt, vildtyp transthyretin amyloidos; EKG: elektrokardiogram; ECO: ekokardiogram; EV: extracellulär volym; LVEF: vänster kammares ejektionsfraktion; LVH: vänsterkammarhypertrofi; TTR: transthyretin.
De första TTR-mutationerna rapporterades som familjär amyloid polyneuropati (eller Andrades sjukdom), och följaktligen har ATTRm fram till nyligen betraktats som en neurologisk sjukdom. Nya rön visar dock att mer än hälften av fallen är involverade i hjärtat.3
Det finns en stark genotyp-fenotyp korrelation, där mutationer förknippas med rent neurologisk sjukdom eller rent kardiell sjukdom.3
Uppdelningen av ATTRm i kardiell eller neurologisk sjukdom kan dock vara en överdriven förenkling, eftersom det finns en betydande överlappning mellan de 2 kliniska formerna på sjukdomsspektrumet.
Val30Met-mutationen (numera känd som Val50Met efter att 20 positioner lades till det traditionella mutationsnamnet i ATTRm) är den mest frekventa mutationen i världen och är endemisk i Portugal, Japan och Sverige. Dess uppskattade incidens i Portugal är 1 per 538 invånare.2 Mallorca (Spanien) och Valverde del Camino (Huelva, Spanien) anses också vara områden där ATTRm är endemisk. Den uppskattade prevalensen på Mallorca hos symtomatiska patienter är 3/100 000 invånare.5
Val30Met-mutationen orsakar ett övervägande neurologiskt tillstånd med symmetrisk sensomotorisk polyneuropati, som börjar i de nedre extremiteterna och följer ett stigande mönster. Det kan vara förknippat med dysautonomi med ortostatisk hypotension, erektil dysfunktion, urininkontinens och gastrointestinala symtom. Den börjar vanligtvis i slutet av det andra eller tredje decenniet i livet, och upp till 43 % av patienterna har hjärtpåverkan som är en vanlig dödsorsak4 (tabell 1).
Påtagligt relevant är Val122Ile-mutationen (p. Val142Ile), som förekommer hos 3 % till 4 % av den nordamerikanska svarta befolkningen.3 Även om dess penetrering är ofullständig,3 har denna mutation förknippats med en 47 % ökad risk att utveckla hjärtsvikt (HF).6 En nyligen genomförd studie visade att Val122Ile-amyloidos var den fjärde vanligaste orsaken till HF i den brittiska afrokaribiska befolkningen.7 Även om upp till 30 % av patienterna med denna mutation kan ha drag av lindrig neuropati,6 liknar den kliniska fenotypen vanligen ATTRwt.4 Val122Ile bör inte betraktas som en mutation som uteslutande är förknippad med den svarta befolkningen, eftersom den också kan förekomma i den vita befolkningen. Vi har till exempel identifierat denna mutation i 4 vita spanska familjer utan svart härkomst.
WILD-TYPE TRANSTHYRETIN AMYLOIDOSIS
Wild-type transthyretin amyloidos beskrevs första gången 1876. Den kallades tidigare för senil amyloidos, men dess diagnos hos patienter i åldern 40-60 år har gjort denna term föråldrad. Intressant är att det tidigaste kända fallet av denna mutation hittades hos en 47-årig amerikansk patient.8
Den exakta prevalensen av ATTRwt är fortfarande okänd. Studier tyder dock på att den är underdiagnostiserad och att den kan vara den vanligaste formen av hjärtamyloidos.2,3 Följande resultat stöder denna hypotes:
- –
Hos patienter som är äldre än 80 år är prevalensen av TTR-avlagring 25 % vid obduktion.3
- –
Hos patienter med HF med bevarad ejektionsfraktion (HFpEF) är måttligt allvarlig TTR-deposition 5 % vid obduktion.9
- –
Hos patienter över 60 år som tagits in för HFpEF och vänsterkammarhypertrofi (LVH) ≥ 12 mm fann vår grupp nyligen en prevalens på 13 %.10
TTRwt är, till skillnad från ATTRm, en sporadisk sjukdom som vanligtvis börjar efter 70 års ålder.4 Den förekommer främst hos män och publicerade serier har rapporterat frekvenser på mellan 89 % och 98 %.11,12 I en nyligen genomförd serie av patienter som diagnostiserats med ATTRwt på två sjukhus (Madrid, Spanien och Bologna, Italien) fann vår grupp dock att 20 % var kvinnor. Dessutom har andra obduktionsstudier också antytt att ATTRwt hos kvinnor kan vara mer utbrett än vad som tidigare rapporterats. Därför bör kvinnligt kön inte minska den kliniska misstanken om ATTRwt (tabell 1).13
Autopsifynd visar att TTR-depositionen är spridd i olika organ vid ATTRwt. Avlagringen är dock mycket större i hjärtat på grund av TTR:s kardiella tropism, och hjärtpåverkan är den huvudsakliga kliniska manifestationen.4 Patienter kan uppvisa symtom på extrakardiell TTR-avlagring, såsom stenos i lumbalkanalen, atraumatisk ruptur av bicepssenan eller ”Popeyeye-tecken” och karpaltunnelsyndrom (CTS)3 (figur 1). Alla dessa kännetecken kan hjälpa till att vägleda och snabbt fastställa diagnosen. CTS kan åtfölja andra amyloidos-subtyper, men det är vanligare i ATTRwt. Avlagring kan föregå hjärtmanifestationer med flera år.6 Det kan användas som indikation hos äldre patienter med LVH, särskilt om de har bilateralt CTS som inte är förknippat med specifika yrkesaktiviteter och befinner sig i New York Heart Associations funktionella klass ≥ II (opublicerade data).
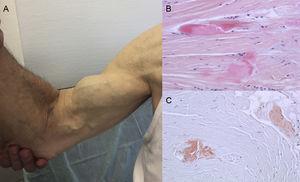
Tecken och symtom på transthyretinamyloidos. A: Icke-traumatisk ruptur av den högra bicepssenan (”Popeye-tecken”). B och C: Färgning med hematoxylin-eosin (B) och Kongoröd (C), båda ×200, av karpalligamentprov som visar täta kollagenbuntar med icke-cellulärt material. Med tillstånd av Dr Clara Salas Antón.
DIAGNOSIS AV TRANSTHYRETIN AMYLOIDOSISKlinisk presentation
Amyloid kan infiltrera vilken som helst av hjärtats strukturer.1 Typiskt sett ökar avlagringen den ventrikulära väggtjockleken, vilket orsakar en gradvis minskning av distensibiliteten som leder till allvarlig diastolisk dysfunktion. ATTR har därför traditionellt inkluderats som en orsak till restriktiv kardiomyopati.
Det kliniska spektrumet av ATTR är emellertid mycket bredare och mer heterogent. Det vanligaste symtomet vid ATTR är HF. Som nämnts föreslog en studie som publicerades av vår grupp 2015 att ett protokoll baserat på 99mTc-3,3-difosfon-1,2-propanodikarboxylsyra (99mTc-DPD) scintigrafi kan vara användbart för att diagnostisera ATTRwt hos en betydande andel (13 %) av patienter äldre än 60 år som tagits in för HFpEF.10 Baserat på detta resultat inkluderades 99mTc-DPD-scintigrafi i 2016 års europeiska riktlinjer för HF som ett användbart verktyg för identifiering av patienter med ATTR14. ATTR bör dock inte misstänkas enbart hos patienter med HFpEF eftersom den kontraktila funktionen försämras i takt med att amyloiddepositionen fortskrider, och följaktligen kan ATTR associeras med olika grader av systolisk dysfunktion.
Transthyretinamyloidos är en fenokopi av hypertrofisk kardiomyopati (HCM) och kan förväxlas med denna. En nyligen genomförd fransk multicenterstudie rapporterade att 5 % av patienterna med HCM har ATTRm.15 Våra resultat stämmer dock inte överens med denna höga frekvens, vilket kan ha samband med den stora svarta befolkningen i Frankrike.
Kardiella ledningsavvikelser kan vara den första manifestationen av ATTR. Amyloidinfiltration av sinus- och atrioventrikulära noder1 kan indikera behovet av pacemakerimplantation (tabell 1). Den tidigare nämnda studien som genomfördes i Spanien och Italien visade att ledningsstörningar var den första manifestationen av ATTRwt hos 7 % av patienterna med denna sjukdom.13
Atriella arytmier är också mycket vanliga hos patienter med ATTRwt13 (figur 2A), och den första manifestationen av sjukdomen kan vara stroke.4 Faktum är att Mayo Clinic-gruppen nyligen föreslog att ATTRwt bör uteslutas i samband med en diagnos av icke-valvulärt förmaksflimmer (AF) hos äldre patienter.8 Däremot är AF mycket mindre vanligt hos patienter med ATTRm (tabell 1).
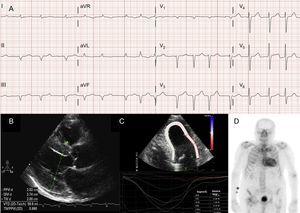
Diagnostiska tekniker vid transthyretin hjärtamyloidos (ATTR). A: Elektrokardiogram hos en patient med transthyretin amyloidos av vildtyp (ATTRwt), som visar förmaksflimmer och pseudoinfarktmönster i inferiöra ledningar. B: Ekokardiogram av en patient med mutant transthyretinamyloidos med Val30Met-mutation, med markerad koncentrisk vänsterkammarhypertrofi och mild perikardiell utgjutning. C: longitudinell regional stamning hos en patient med ATTRwt, med bevarade värden i det apikala segmentet och nedsatta värden i de basala och midventrikulära segmenten. D, 99mTc-DPD (99mTc-3,3-difosfon-1,2-propanodikarboxylsyra) skanning av en patient med ATTRwt, som visar biventrikulärt upptag överordnat benupptag, vilket motsvarar Perugini grad 3.
Finally, we note that ATTR and degenerative aortic stenosis can coexist in the same patient. Under 2016 uppmärksammade flera studier denna möjlighet, och en prospektiv studie rapporterade att ATTRwt hade en prevalens på 6 % hos patienter över 65 år som genomgick aortaklaffbyte16 . Denna studie antydde att patienter med båda entiteterna hade en mycket sämre postoperativ prognos än de utan ATTRwt (mortalitet 50 % jämfört med 6,9 % efter en medianuppföljning på 2,3 år).16 I en annan nyligen genomförd studie med 99mTc-DPD-scintigrafi hos 43 patienter med aortastenos med lågt flöde/låg gradient identifierades 5 patienter med ATTRwt (prevalens 12 %). 17 Patienter med svår aortastenos och ATTRwt har samma demografiska profil, och lämplig behandling för patienter med båda sjukdomarna är fortfarande inte fastställd.
Nyttan av diagnostiska metoder
Diagnosen av ATTR är en utmaning i den dagliga kliniska praktiken. Även om elektrokardiografi och ekokardiografi spelar en roll för diagnosen har nya icke-invasiva tekniker fått en nyckelroll i bedömningen av patienter med ATTR.
Elektrokardiogram
Sambandet mellan lågspänning och kardiell amyloidos har länge ansetts vara obestridligt.3 De mest använda kriterierna i klinisk praxis är QRS amplitud 1 Även om låga elektrokardiografiska spänningar i samband med LVH bör skapa misstanke, var prevalensen i en samtida serie av ATTR så låg som 20 % till 25 %.3,4,13 Prevalensen varierar också beroende på vilka kriterier som tillämpas. Till exempel kan användningen av Sokolow-kriteriet (S-våg i ledningen V1 + R-våg i ledningen V5 eller V6
1,5 mV) öka den beräknade prevalensen till mellan 46 % och 58 %.13 Förhållandet mellan vänsterkammarväggens tjocklek och den totala QRS-spänningen har rekommenderats för att bättre kunna bedöma skillnaderna mellan resultaten av de två teknikerna.2,3 Upp till 20 % av patienterna med ATTR kan dock uppfylla elektrokardiografiska kriterier för LVH.2,3
I de flesta serier av patienter med hjärtamyloidos är pseudoinfarktmönstret det vanligaste elektrokardiografiska fyndet2,3,13 (figur 2A). På grund av eventuell inblandning i ledningssystemet är det också vanligt med kompletta eller ofullständiga grenblock.3
Echokardiografi
Även om ekokardiografi är en hörnsten i den första diagnosen av ATTR är inga fynd specifika.3 Transthyretinamyloidos har typiskt sett förknippats med en normal eller liten vänster kammare med koncentrisk hypertrofi.3 Vid det tionde internationella symposiet om amyloid och amyloidos som hölls 2004 fastställdes det ekokardiografiska kriteriet för hjärtsjukdom på grund av AL i avsaknad av andra orsaker till LVH som närvaron av LVH med ett gränsvärde på 12 mm för interventrikulär septumväggens tjocklek.4 Detta kriterium extrapolerades senare till andra former av amyloidos (figur 2B), vilket gav en hög grad av specificitet men låg sensitivitet.
Och även om koncentrisk LVH har beskrivits klassiskt, tyder aktuella serier på att cirka 20 % har asymmetrisk LVH.13
Trots det klassiska sambandet mellan en normal eller något minskad vänster ventrikulär ejektionsfraktion (LVEF) och amyloidos i hjärtat,2 är LVEF-området mycket varierande.8 I en nyligen genomförd studie vid Mayo Clinic var en LVEF 8 medan det i vår serie var en LVEF 13. Dessutom är användningen av LVEF vid bedömning av systolisk funktion vid hjärtamyloidos begränsad, eftersom något nedsatta värden redan indikerar relevant hjärtsjukdom. Denna begränsning kan övervinnas genom användning av vävnadsdopplerhastigheter, strain imaging och myokardisk kontraktionsfraktion, som har föreslagits som mer lämpliga index för att bedöma hjärtfunktionen.2
Andra klassiska ekokardiografiska tecken är högerkammarhypertrofi, biatriell dilatation, mild perikardutgjutning, förtjockning av den atrioventrikulära klaffen, förtjockning av förmaksskiljeväggens tjocklek och granulärt gnistrande utseende på myokardiet.3,6 Eftersom vissa av dessa kännetecken observerades i en mycket utvald serie av patienter i avancerade sjukdomsstadier behöver dock inte alla kännetecken vara närvarande för att misstankar ska uppstå.1
Regional strain imaging är en mycket användbar teknik för tidig diagnos av patienter med ATTR. Hos patienter med ATTR är den longitudinella töjningen nedsatt i basala och mittventrikulära segment men bevarad i apikala segment18 (figur 2C). Detta typiska mönster kan vara användbart vid differentialdiagnostik av ATTR från andra hjärtsjukdomar.4
Biomarkörer
Det finns färre uppgifter om den roll som N-terminal prohormone of brain natriuretic propeptide (NT-proBNP) och troponin spelar vid ATTR än vad som finns vid AL.4 NT-proBNP-nivåerna i ATTR är vanligtvis lägre än i AL,4 vilket återspeglar två olika patofysiologiska mekanismer: direkt ljuskedjetoxicitet i AL jämfört med inducerad vävnadsskada genom protofibriller i ATTR.
Redan nyligen föreslog Mayo Clinic-gruppen ett stratifieringssystem som liknar det som gäller för AL. I en kohort av 360 patienter med ATTRwt visade sig båda biomarkörerna vara prediktorer för mortalitet. Patienter i stadium III (NT-proBNP > 3000 pg/mL och troponin T > 0,05 ng/mL) hade en medianöverlevnad på 20 månader, medan patienter i stadium I och II hade en medianöverlevnad på 66 månader och 40 månader (ingen biomarkör eller bara en biomarkör över de fastställda gränsvärdena, respektive).
Hjärtaggregatets magnetiska resonansavbildning
Hjärtaggregatets magnetiska resonansavbildning (CMRI) kan användas för att erhålla strukturell och funktionell information och för att karakterisera sammansättningen av hjärtmuskelvävnad.3 CMRI är viktigt vid tidig identifiering av ATTR och vid dess differentialdiagnostik från andra hjärtsjukdomar.
Karakteriseringen av vävnad med CMRI baseras på följande egenskaper:
- –
Late enhancement: Ett globalt subendokardialt mönster är praktiskt taget patognomoniskt för kardiell amyloidos, men förekommer endast hos ungefär en fjärdedel av patienterna. Andra mönster, t.ex. transmurala (det vanligaste) eller patching, är också kompatibla (figur 3). Trots dess höga sensitivitet och specificitet bör man ta hänsyn till att det kan finnas en möjlig avsaknad av sen förstärkning (15 % av patienterna) och, enligt vår erfarenhet, en icke försumbar andel falskt negativa av tekniska skäl.3 Det transmurala förstärkningsmönstret är förknippat med sämre prognos och är en oberoende prediktor för mortalitet.19
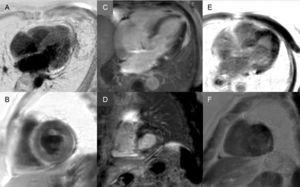 Figur 3.
Figur 3.Mångfald av sena förstärkningsmönster vid magnetisk resonanstomografi av hjärtat vid transthyretinamyloidos. A och B: Sena förstärkningssekvenser, 4-kammarplan respektive kort axel på mittennivå, hos en patient med mutant transthyretinamyloidos (ATTRm), som visar diffus patologisk transmural gadoliniumavlagring. C och D: Sena förstärkningssekvenser, 4-kammarplan respektive kortaxel basal nivå, av patienter med ATTRm som visar patologisk gadoliniumavlagring med ett fläckigt mönster, med lägre inferoseptalt och inferolateralt basalt fokalt område. E och F, sena förstärkningssekvenser, 4-kammarplan respektive kortaxel på apikal nivå, hos patienter med ATTRm, som visar omfattande patologisk transmural avlagring, utom i basala och mellersta anterolaterala segment. Med tillstånd av Dr Jesús González Mirelis.
(0,15MB).- –
Långa T1-tider: T1-kartläggning är en teknik där en kvantitativ myokardiell signal mäts före (native T1) eller efter kontrasttillförsel. Nativa T1-tider är mycket långa vid kardiell amyloidos.3 T1-mappning kräver inte administrering av kontrast och kan därför användas vid njursvikt. T1-tiderna kan till och med vara onormala innan LVH observeras.3 T1-tiderna är längre i ATTR än i HCM och kontroller (1097 ms ± 43 ms vs 1026 ms ± 64 ms vs 9,67 ms ± 34 ms, respektive; P
ms ± 68 ms; P = 0,01).20
- –
Kontrastadministrering kan användas för att beräkna extracellulär volym (ECV) och bedöma ökningar av extracellulärt utrymme. ECV-värdena vid kardiell amyloidos är högre än vid andra hjärtsjukdomar, utom i myokardinfarktzoner.21 År 2016 rapporterade vår grupp, i samarbete med andra nationella centra, att ECV-kvantifiering kan identifiera kardiell involvering vid ATTRm och för första gången korrelerade den med graden av neurologisk funktionsnedsättning, vilket stödjer användningen av den här tekniken vid tidig diagnos och spårning av ATTRm.22
Kvantitativa tekniker för T1-kartläggning och ECV-beräkning kan vara mycket användbara vid ATTR för tidig diagnos, klinisk uppföljning och bedömning av behandlingssvar (figur 4).
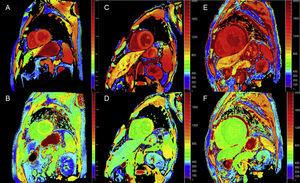 Figur 4.
Figur 4.T1-kartläggning, före och efter kontrast, med modifierad look-locker inversion-recovery (MOLLI) vid 3T magnetresonanstomografi av hjärtat hos frisk kontroll, patient med transthyretinamyloidos och patient med primär lättkedjeamyloidos. A och B: native T1-kartläggning respektive extracellulär volym (EV) hos en frisk kontroll som visar normala värden (EV = 0,214). C och D: Kartläggning av T1 och EV hos en patient med muterad transthyretinamyloidos med neurologiska skador och begynnande hjärtpåverkan, förhöjd T1 och något förhöjd EV (0,361). E och F: Kartläggning av T1 och EV hos en patient med transthyretin-kardiell amyloidos av vildtyp, förhöjd T1 och mycket hög EV (0,626), vilket återspeglar massiv amyloidinfiltration. Med tillstånd av Dr Jesús González Mirelis.
(0,68MB).Cardiac Scintigraphy
På 1980-talet observerades att det fanns ett kardialt upptag av flera bendifosfonatspårare som histologiskt korrelerade med förekomsten av hjärtamyloidos.23 Upptagsmekanismen är inte väl karakteriserad, men den kan vara relaterad till kalciuminnehållet i amyloidavlagringar.
En tidig studie av Bolognagruppen som använde 99mTc-DPD visade på upptag i hjärtat hos 15 patienter med ATTR och avsaknad av upptag hos 10 patienter med AL, med hjälp av en poäng som baserades på biventrikulärt upptag som var likvärdigt med eller överlägset upptag i benet (Perugini-poäng)24 (figur 2D). Liknande resultat rapporterades senare av vår grupp och andra.25 Mildt upptag (poäng 1) och måttligt upptag (poäng 2) kan hittas hos 30 % respektive 10 % av patienterna med AL.24
Med tanke på dess höga sensitivitet och specificitet är denna teknik ytterst användbar för att fastställa diagnosen ATTR och kan visa på kardiell involvering även när ekkokardiografi- och MRT-fynd fortfarande är normala. Faktum är att efter scintigrafi för onkologiska eller reumatologiska indikationer är tillfälliga fynd av ATTR inte ovanliga.26
Tc-DPD finns inte tillgängligt i USA, men liknande resultat har rapporterats med hjälp av 99mTc-PYP (pyrofosfat)-avbildning.27
Andra radiotrakers är för närvarande under utredning. Till exempel har 18F-florbetapir, som redan har godkänts för avbildning av beta-amyloid i hjärnan,4 studerats hos patienter med AL och ATTR. Resultaten visar att 18F-florbetapir kan upptäcka myokardiella AL- och ATTR-avlagringar.28 Även om de tillgängliga uppgifterna har erhållits i fallstudier29 och den höga kostnaden för denna radiotracer begränsar dess användning, pågår flera studier om den potentiella fördelen med dess användning jämfört med Tc-DPD som screeningteknik för de två vanligaste typerna av amyloidos.
Invasiv diagnos
Den definitiva diagnosen av ATTR baseras på histologisk påvisande av amyloida fibriller. Även om det kan finnas extrakardiell deposition varierar sannolikheten för att påvisa amyloid histologiskt beroende på organ.2 Det finns få studier om kostnadseffektiviteten av extrakardiell biopsi (t.ex. bukfett, gingival, spottkörtel, gastrointestinal) vid ATTR, som är större vid ATTRm än vid ATTRwt. En negativ biopsi av ett kliniskt opåverkat organ utesluter dock inte diagnosen ATTR.4
Som vid ATTRwt är endomyokardiell biopsi indicerad hos patienter utan extrakardiell involvering eller med enbart hjärtsjukdom.3,4 Endomyokardiell biopsi är en lågriskprocedur (särskilt på erfarna centra) och provtagningsfel är osannolika.6
Efter histologisk bekräftelse av amyloidos, som ibland kan kräva tolkning av utbildad personal,6 är korrekt klassificering av subtypen avgörande.4 För närvarande beror klassificeringen på en kombination av immunohistokemi, genetisk analys och proteomik:
- –
Immunohistokemi bygger på användning av specifika antikroppar mot kända amyloidproteiner. Även om resultaten av denna teknik vanligtvis är definitiva är den mindre känslig när det gäller igenkänning av lätta kedjor.4
- –
Denna begränsning kan övervinnas genom användning av masspektrometri, som ger definitiva resultat och är kriteriestandarden vid bekräftelse av den amyloida subtypen2. Även om denna teknik endast är tillgänglig på specialiserade centra är den särskilt användbar i tveksamma fall eller i fall som är positiva för flera antikroppar vid immunohistokemi, vilket enligt vår erfarenhet förekommer i cirka 20-30 % av fallen. 4
- –
Om de kliniska eller histologiska teknikerna inte kan skilja ATTRm från ATTRwt rekommenderas genetiska undersökningar i alla fall av ATTR. Upptäckten av en orsakande mutation kan vara av betydelse för att erbjuda genetisk rådgivning och uppföljning till asymtomatiska bärare, 4,30 som skulle kunna dra nytta av kommande terapier som fördröjer eller till och med förhindrar sjukdomsutbrott.31
Noninvasiv diagnos
Intill helt nyligen ansågs histologiska studier vara nödvändiga för att diagnostisera ATTR.3 För att underlätta diagnosen föreslog dock en internationell multicenterstudie 2016 en ny algoritm för icke-invasiv diagnos av ATTR.32
Studien analyserade resultaten från 1217 patienter. Förekomsten av klassiska tecken på hjärtamyloidos med hjälp av avbildningstekniker, grad 2 eller 3 av Tc-DPD/PYP-upptag vid scintigrafi och avsaknaden av ett monoklonalt protein hade en specificitet och ett positivt prediktivt värde för ATTR på 100 %32 (figur 5).
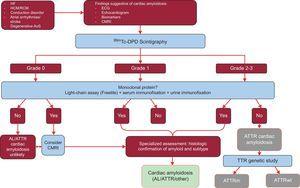 Figur 5.
Figur 5.Diagnostisk algoritm för patienter med misstänkt hjärtamyloidos. Graderingssystem för 99mTc-DPD-scintigrafi: grad 0, inget upptag i hjärtat; grad 1, något lägre upptag än i benet; grad 2, måttligt upptag som är lika stort som i benet; grad 3, allvarligt upptag som är större än i benet. ACV, stroke; AL, primär lättkedjeamyloidos; AoS, aortastenos; ATTR, transthyretinamyloidos; ATTRm, mutant transthyretinamyloidos; ATTRwt, vildtyp transthyretinamyloidos; CMRI: kardiell magnetresonansavbildning; EKG: elektrokardiogram; HCM: hypertrofisk kardiomyopati; HF: hjärtsvikt; RCM: restriktiv kardiomyopati; TTR: transthyretin.
(0,32MB).Ett viktigt kännetecken denna algoritm är frånvaron av ett monoklonalt protein som skulle kunna orsaka AL på serumkedjeanalys (Freelite, The Binding Site, UK) och på immunofixeringselektrofores av blod och urin. Förekomsten av ett monoklonalt protein är en indikation för endomyokardiell biopsi för att skilja mellan ATTR och AL.32 Upp till 5 % av befolkningen över 65 år har monoklonal gammopati av obestämd betydelse.2 Hos äldre personer bör en måttlig ökning av cirkulerande lätta kedjor inte direkt leda till en diagnos av AL. Det har rapporterats att upp till 10 % av äldre patienter med ATTRwt och monoklonal gammopati av obestämd betydelse i referenscentra tidigare hade fått en felaktig diagnos av AL.3,33 En korrekt diagnos är nödvändig för att undvika olämplig kemoterapi. Av intresse är att vårt sjukhus har dokumenterat 2 fall av patienter med multipelt myelom och samtidig ATTRwt på masspektrometri.
BEHANDLING AV TRANSTHYRETIN CARDIAC AMYLOIDOSIS
Bearbetning av patienter med ATTR har 2 mål: att ge medicinskt stöd och, om möjligt, att stoppa eller fördröja amyloidavlagring genom användning av specifika behandlingar.
Medicinsk behandling
Följande avsnitt beskriver stödjande hjärtvård för patienter med ATTR.
Hantering av hjärtsvikt
Euvolemia måste upprätthållas hos patienter med hjärtamyloidos. Kost- och livsstilsåtgärder är mycket viktiga. Diuretika är nyckeln till behandlingen av HF vid ATTR. Men eftersom överdriven användning av diuretika kan leda till hypotension (ofta på grund av autonom dysfunktion) och förvärra den kliniska situationen, särskilt vid ATTRm, måste man vara ytterst försiktig vid hanteringen.
I behandlingen av HF vid ATTR måste man ta hänsyn till att nedsatt diastolisk dysfunktion och minskad slagvolym leder till kompensatorisk takykardi för att upprätthålla hjärtminutvolymen. Därför måste betablockerare användas med försiktighet och individualiseras för varje patient. Standardpraxis är att ta bort dem i avsaknad av svårigheter att kontrollera hjärtfrekvensen. Detta tillvägagångssätt är ännu viktigare, om möjligt, i ATTRwt på grund av den frekventa förekomsten av konduktionsstörningar.6 Kalciumantagonister och digoxin kan binda till amyloida fibriller och är därför kontraindicerade i ATTR på grund av risken för toxicitet även vid terapeutiska doser.6
I motsats till HF med systolisk dysfunktion på grund av andra etiologier finns det inga bevis till stöd för en prognostisk fördel på grund av användning av betablockerare, angiotensinkonverterande enzymhämmare eller angiotensin II-receptorantagonister vid hjärtamyloidos. I själva verket kan användningen av dem leda till klinisk försämring på grund av hypotoni och låg produktion: en nyligen publicerad publikation har rapporterat sämre prognos i ATTRm och en neutral effekt i ATTRwt.34
Hantering av förmaksarytmier
Hanteringen av förmaksflimmer i ATTR är en utmaning. Det är svårt att upprätthålla långvarig sinusrytm. Elektrisk kardioversion kan dock försöka eftersom det kan leda till klinisk förbättring.
Tromboembolisk risk hos patienter med ATTR är mycket hög. Dessutom kan kronisk amyloidinfiltration leda till mekanisk förmaksdysfunktion, vilket kan vara den bakomliggande orsaken till utvecklingen av förmaksstrombos hos vissa patienter utan AF. Antikoagulantiabehandling vid ATTR bör inte baseras på CHADS2-VASC-poängen utan bör vara standardbehandling vid förmaksflimmer. Blödningshändelser är mindre vanliga än i AL, och därför rekommenderar vissa sjukhus antikoagulantiabehandling hos patienter med sinusrytm om det finns en dålig förmaksfunktion enligt transmittral dopplerhastighet. Även om det inte finns några jämförande studier om effektiviteten av direkta orala antikoagulantia jämfört med vitamin K-antagonister har vårt sjukhus administrerat direkta orala antikoagulantia till utvalda patienter.
Roll för anordningar
Aktuella rekommendationer för pacemakerimplantation är desamma i ATTR och i den allmänna befolkningen. Vissa grupper förespråkar dock profylaktisk implantation, särskilt hos patienter med ATTRm och konduktionsstörningar.35 Vi förespråkar inte denna förebyggande strategi och har inte funnit en så hög frekvens av konduktionsstörningar att det motiverar profylaktisk implantation hos patienter med ATTRm.
Rollen för användning av implanterbara kardioverter-defibrillatorer (ICD) vid ATTR är inte väl etablerad. I en liten serie förbättrade ICD-implantationen inte signifikant överlevnaden, även om den hade en lämplig effekt hos flera patienter under de första två åren.36
Hjärttransplantation
Hjärttransplantation har spelat en mindre roll vid ATTR eftersom ATTRm kan involvera olika organ och ATTRwt vanligtvis drabbar äldre patienter. Avsaknaden av extrakardiell involvering hos patienter med ATTRwt gör dem dock till goda kandidater för ingreppet. I litteraturen finns exempel på lyckade transplantationer hos patienter yngre än 70 år med ATTRwt eller med ATTRm och dominerande hjärtinvolvering.4
Specifik behandling av Transthyretin Cardiac Amyloidosis
För närvarande finns det ingen godkänd terapi för specifik behandling av ATTR-kardiell amyloidos, även om levertransplantation (TxH) ensamt eller i kombination med hjärttransplantation har använts vid ATTRm sedan 1990-talet som ett sätt att eliminera huvudkällan till prekursor-TTR.4
Levertransplantation
The Familial Amyloidotic Polyneuropathy World Transplant Registry37 rapporterade att mer än 2 000 patienter med ATTRm har genomgått TxH i 20 länder.4 Patienter med Val30Met-mutationen och en övervägande neurologisk klinisk bild har en överlevnadsfrekvens på mer än 50 % efter 20 år.3 Dessa lovande resultat bygger på ett strikt patienturval enligt ålder, typ av mutation och sjukdomsstadium. Den mest allmänt accepterade indikationen för TxH är kombinationen av ung ålder, Val30Met-mutationen och tidiga sjukdomsstadier.
De viktigaste begränsningarna för denna teknik är dock bristen på donatorer, behovet av kronisk immunsuppression, hög ålder vid presentationstillfället och sämre resultat som erhållits hos patienter med andra mutationer än Val30Met-mutationen.
Det teoretiska undertrycket av produktionen av det muterade proteinet motverkas dessutom av en progressiv progressiv inhemsk TTR-avlagring efter implantationen,4,6 vars mekanism inte är helt klarlagd. Faktum är att kardiell TTR-avlagring efter TxH påverkar morbiditet och mortalitet.
Behovet av att bättre förstå patogenesen för ATTR och begränsningarna av TxH har stimulerat utvecklingen av flera läkemedel.
Dessa nya föreningar verkar vid olika punkter i TTR-amyloidogenesekaskaden (figur 6). Behandlingen kommer alltid att innebära en minskning av prekursorproteinet, även om det är lika viktigt att undvika avlagringar och eliminera befintliga avlagringar. Därför tror vi att tillvägagångssättet för denna sjukdom i framtiden kommer att vara i form av kombinerad behandling.
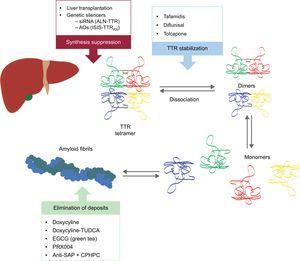 Figur 6.
Figur 6.Specifika behandlingar vid transthyretin hjärtamyloidos och huvudsakliga måltavlor. AntiSAP + CPHPC, antiserum amyloid P-komponent + (R)-1–6-oxo-hexanoyl]pyrrolidin-2-carboxylsyra; AOs, antisense oligonukleotider; EGCG, epigallocatechin-3-gallat; siRNA, small interfering RNA; TTR, transthyretin; TUDCA, tauroursodeoxycholic acid.
(0,27MB).Suppression av transthyretinsyntesen
Två forskningslinjer pågår när det gäller hämning av TTR-leveruttrycket: användning av små interfererande RNA (siRNA) och användning av läkemedel med antisense-oligonukleotider (AO).
- –
SiRNA är dubbelsträngade RNA-molekyler som tystar messenger RNA-sekvenser genom att specifikt binda sig till dem, vilket förhindrar proteinbildning. Patisiran (ALN-TTR02) har visat sig minska TTR-produktionen med 80 %.38 Hos patienter med ATTRm var TTR-reduktionen 87 %.39 En fas 2-studie har visat lovande resultat, med stabila ekkokardiografiska, funktionella och analytiska parametrar vid 12 månader och 24 månader.40 Resultaten av fas 3-studien av neurologisk art hos patienter med ATTRm och en subanalys av patienter med kardialt engagemang väntas under 2017 (tabell 2). Ett annat läkemedel, revusiran (ALN-TTR01), administreras subkutant och skiljer sig från patisiran genom de lipidnanopartiklar som kapslar in siRNA. Detta läkemedel var föremål för en klinisk fas III-studie hos patienter med ATTRm som har hjärtsjukdom. Studien avbröts förra året på grund av en oväntad ökning av dödligheten i behandlingsgruppen (tabell 2).
Tabell 2.Huvudsakliga pågående kliniska prövningar av transthyretin kardiell amyloidos
Aktionsmekanism Substans Prövning Design. Patienter (N) och ATTR-subtyp Intervention Primära mål Situation/resultat TTR-syntesundertryckning Patisiran (ALN-TTR02) NCT01961921 Fas II-studie, multicenter 27
ATTRm (11 hjärtsjukdomar)Patisiran 0.30 mg/kg IV var 3:e vecka i 2 år Långtidssäkerhet. Sekundära effektmått: Effekt på neurologiska störningar och hjärtparametrar Välttolererat läkemedel, med liknande säkerhetsprofil i neurologisk och hjärtfenotyp
Troponin I, NT-proBNP och ekokardiografiska data förblev stabila vid 12 mo och 24 moNCT01960348 (APOLLO) Fas III, randomiserad, dubbelblind, placebokontrollerad, multicenter 225
ATTRm med neurologisk involveringPatisiran infusion IV vs placebo 2:1 Förändringar i mNIS+7 Förväntat november 2017
Subanalys av patienter med förutspådd kardiell involveringNCT02510261 APOLLO extension study Patisiran infusion IV vs placebo 2:1 i 52 veckor Säkerhet och biverkningar på lång sikt Under pågående Revusiran (ALN-TTR01) NCT02319005 (ENDEAVOUR) Fas III, randomiserad, dubbelblind, placebokontrollerad 206
ATTRm med hjärtpåverkanRevusiran 500 mg 5 d, sedan varje vecka i 2 y vs placebo Förändringar i 6-m gångtest och i plasma TTR-värden Underbröts på grund av ökad dödlighet i revusiran armen ISISIS-TTRRX NCT01737398 Fas II/III, randomiserad, dubbelblind, placebokontrollerad, multicenter 172
ATTRm med neuropati; 50 % samtidig hjärtpåverkanISISIS-TTRRX 300 mg SC var 12:e timme i 1 vecka, sedan varje vecka i 64 veckor jämfört med placebo Förändringar i mNIS+7 och Norfolks frågeformulär om livskvalitet Tillfälligt september 2017
Fall av allvarlig trombocytopeni och blödning rapporterade
Analys av ekokardiografiska parametrar och NT-proBNP förväntas hos patienter utan hypertoni med LVH > 12 mmBehandling av TTR-kardiomyopati med TTR-specifik antisense oligonukleotid Fas II, öppen, icke-randomiserad 20
ATTRm med hjärtinvolvering och ATTRwtISISIS-TTRRX 300 mg SC var 12:e timme/vecka Ekokardiografiska parametrar och kardiell MRT jämfört med historiska kontroller Ingen försämring av belastning och minskad LV-massa med cirka 5 %
6 patienter fullföljde 12 månader; 15 patienter 6 mån; 1 patient TxCNCT02627820 Fas II, öppen, icke-randomiserad 50
ATTRwtISISIS-TTRRX 300 mg SC var 12:e timme i 1 vecka, därefter 1 vecka i 18 veckor Förändringar i belastning mätt med speckle tracking Avbruten utan att påbörja patientrekrytering Fas III-studie med ISIS-TTRRX för behandling av TTR-amyloidkardiopati Fas III, randomiserad, dubbelblind, placebokontrollerad, multicenter 490
ATTRwt och ATTRm med hjärtpåverkanISISIS-TTRRX 300 mg SC var 12:e timme i 1 vecka, därefter varje vecka i 16 veckor med placebo, därefter varje vecka i 24 månader Dödsfall, TxC eller intagning av kardiovaskulära orsaker Under väntan Stabilisering av TTR Tafamidis NCT01994889 Fas III, randomiserad, dubbelblind, placebokontrollerad, multicenter 441
ATTRwt och ATTRm med hjärtinvolveringTafamidis 20 mg eller 80 mg oralt var 24:e timme i 30 månader jämfört med placebo Alla-dödsorsak och kardiovaskulär sjukhusvistelse Slutar februari 2018 NCT02791230 Extension Fas III NCT01994889 330
ATTRwt och ATTRm med hjärtinfarktTafamidis 20 mg eller 80 mg per oralt var 24:e timme i 60 månader All-Cause mortality and incidence of adverse effects Expected December 2021 NCT00935012 Phase II, öppen effekt- och säkerhetsstudie 31
ATTRwt eller ATTRm p.Val122Ile med hjärtpåverkanTafamidis 20mg oralt Säkerhet och effektivitet Gående till december 2021 Diflunisal NCT00294671 Fas III, randomiserad, dubbelblind, placebokontrollerad, multicenter 130
ATTRm med neurologisk fenotyp (50 % med hjärtpåverkan)Diflunisal 250 mg oralt var 12:e timme jämfört med placebo under 24 månader NIS+7 vid 24 månader NIS+7 diflunisal vs placebo 16.3 (P Ingen minskning av ventrikeltjocklek eller belastning hos patienter med hjärtinvolvering jämfört med placebo Eliminering av avlagringar Doxycyklin + TUDCA/UDCA NCT01171859 Fas II, öppen, icke-randomiserad, prospektiv 40
ATTR (25 ATTRm, 13 ATTRwt och 2 domino levertransplantatmottagare)Doxycyklin 100 mg var 12:e timme + TUDCA 250 mg var 8:e timme i 12 månader, därefter 6 mo utan behandling Förbättring 14 patienter drog sig ur
Observerade hudreaktioner, 16 patienter
68 % av de 25 utvärderingsbara patienterna uppfyllde den primära slutpunkten
Övergripande förbättring av stam vid 12 mo och försämring efter 6 mo utan behandlingNCT01855360 Fas II, öppen, icke-randomiserad, prospektiv vs historiska kontroller 30
Hjärtat ATTR-amyloidos (27 ATTRwt och 3 ATTRm). Historiska kontroller, 14 ATTRwt-patienterDoxycyklin 100 mg var 12:e timme + TUDCA 250 mg var 8:e timme i 18 mo Förändringar i longitudinell stamning var 6:e månad 22 patienter fullföljde studien och var utvärderingsbara
Större försämring av stamningen hos kontrollerna jämfört med behandlingsgruppen
Förhöjt NT-proBNP i behandlingsgruppen; Mättes inte i kontrollernaNCT01677286 Fas II, öppen, icke-randomiserad, prospektiv 25
Systemisk amyloidos (6 ATTRwt och 3 ATTRm)Doxycyklin 100 mg var 12:e timme i 12 månader Läkemedelssäkerheten
Svaret hos drabbade organFörsvårande av NT-proBNP och njurfunktion
Ingen förbättring av andra studerade parametrar
60 % av patienterna hade hudkomplikationer och 30 % drog sig ur på grund av hud- eller gastrointestinala problemNCT01171859 Fas II, öppen, icke-randomiserad, prospektiv 45
35 med hjärtinfarkt; 25 ATTRm; 5 ATTRm med TxH; 13 ATTRwt; och 2 domino levertransplantatmottagareDoxycyklin 100 mg var 12:e timme + TUDCA 250 mg var 8:e timme i 12 månader
Följande uppföljningsfas utan behandling i 6 månaderLäkemedelssvar definierat som Hjärtsvar utvärderat hos 25 patienter
68% hade hjärtsvar
Förhöjt NT-proBNP och försämrad stamning under uppföljning utan behandling
Hög antal avbrott på grund av biverkningar
14 avbröt i behandlingsfasen och 5 avbröt i fas utan behandlingEffekt av doxycyklin + UDCA på ATTR Fas II, öppen, icke-randomiserad, prospektiv 28
ATTR med hjärtpåverkan (27 ATTRm och 1 ATTRwt)Doxycyklin 200 mg/d i 4 veckor, sedan avbruten 2 veckor, därefter UDCA 750 mg/d i 12 mån
Sekvenserande uppföljningsfas utan behandling i 6 månFörändringar i NT-proBNP och Kumamoto-poäng Bara 14 % fullföljde studien och 36 % fullföljde 12 mån
Inga förändringar i NT-proBNP vid 6 mo och försämring vid 12 mo
Stabil LVH
Förbättring av Kumamoto-score vid 12 moEGCG NCT01171859 Fas II, öppen, icke-randomiserad, prospektiv 25
ATTRwt600 mg EGCG i 12 månader Förändringar i ECHO och hjärt-MRI (n = 14) Förminskad LV-massa 6 % genom hjärt-MRI (P = 0.03)
LVEF, myokardietjocklek och MAPSE genom ECHO oförändradeAntiSAP + CPHPC NCT03044353 Fas II, öppen, randomiserad 40
Kohort 1: Kardiell ATTR-amyloidos
Kohort 2: primär amyloidos efter 6 mo kemoterapiAnti-SAP + CPHPC månadsvis i 6 mo Reducerad amyloidbörda genom kardiell MRT och ECHO Start 2017 AntiSAP + CPHPC, Antiserum amyloid P-komponent + (R)-1–6-oxo-hexanoyl]pyrrolidin-2-carboxylsyra; ATTRm, mutant transthyretinamyloidos; ATTRwt, vildtyp transthyretinamyloidos; BNP, natriuretisk peptid i hjärnan; ECHO, ekokardiogram; EGCG, epigallocatechin-3-gallat; IV, intravenöst; LV, vänster kammare; LVEF, vänster kammares ejektionsfraktion; LVH, vänsterkammarhypertrofi; MAPSE, mitral annular plane systolic excursion; mNIS, Modified Neuropathy Impairment Score; MRI, magnetisk resonanstomografi; NIS, Neuropathy Impairment Score; NIS-LL, Neuropathy Impairment Score of the Lower Limbs; NT-proBNP, aminoterminal pro-brain natriuretic peptide; SC, subkutan; TTR, transthyretin; TUDCA, tauroursodeoxycholic acid; TxC, hjärttransplantation; TxH, levertransplantation; UDCA, ursodeoxycholic acid.
- –
AOS är korta strängar av oligonukleotider som specifikt binder till RNA, förhindrar översättning och målproteinsyntes.4 ISIS-TTRRX är en subkutan AO, med påvisade dosberoende minskningar av TTR-värden på 75-90 % hos friska frivilliga.4 Fas III-studien på patienter med ATTRm och neurologisk fenotyp avslutades i mars 2017 och dess resultat förväntas i slutet av 2017. Det amerikanska läkemedelsverket sköt dock upp inledandet av en fas III-studie hos patienter med ATTRwt och ATTRm med hjärtsjukdom på grund av fall av allvarlig trombocytopeni i den neurologiska studien (tabell 2). Eftersom 50 % av deltagarna i den neurologiska studien hade hjärtsjukdom kommer resultaten av denna delstudie på hjärtområdet att avgöra om fas III-studien återupptas. Å andra sidan finns det preliminära data från en öppen fas II-studie. I denna studie fick 22 patienter med ATTRwt och ATTRm med hjärtsjukdom en veckovis injektion av ISIS-TTRRX. Enligt rapporten är säkerhetsprofilen för läkemedlet mycket gynnsam och de mellanliggande uppgifterna om hjärtsjukdomsprogression genom CMR, NT-proBNP och 6-minuterstest är positiva.41
Stabilisering av transthyretin
Dissociation av TTR-tetrameren i underenheter är ett avgörande steg i ATTR-fibrillbildningen. Diflunisal och tafamidis är 2 TTR-stabilisatorer med påvisad effekt vid ATTRm-polyneuropati.
- –
Tafamidis är en oralt administrerad liten molekyl som binder till TTR vid T4-bindningsställen genom att stabilisera proteinet och förhindra dess dissociation. Efter offentliggörandet av resultaten av en randomiserad dubbelblind studie på 125 patienter med ATTRm och mutationen Val30Met i de inledande stadierna av neurologisk sjukdom42 godkände Europeiska läkemedelsmyndigheten 2011 dess användning som särläkemedel för att fördröja den neurologiska utvecklingen. Nya data visar att läkemedlet är effektivt för att uppnå neurologisk stabilitet hos minst 60 % av deltagarna efter mer än fyra års uppföljning. Hittills har läkemedlet begränsat användningsområde för ATTR och kardiologiska sjukdomar. En fas II-studie på 21 patienter med ATTRm och olika mutationer visade att NT-proBNP och ekokardiografiska parametrar förblev stabila efter 12 månader.43 Data från en femårig kohortstudie bekräftade att läkemedlet tolererades väl i en dos på 20 mg, även om få patienter med ATTRwt förblev stabila efter 3,5 år.44 ATTR-ACT-studien är en 30-månaders fas III-studie som bedömer effekt, säkerhet och tolerabilitet av doser av 20 mg och 80 mg tafamidis jämfört med placebo hos 440 patienter med ATTRm, ATTRwt och HF. Den primära endpointen omfattar dödlighet och inläggning på sjukhus. Dess resultat väntas 2018.3,27
- –
Diflunisal är ett icke-steroidalt antiinflammatoriskt medel som stabiliserar TTR-molekyler in vitro. Det är inte tillgängligt i Spanien, men kan medicinskt begäras från utlandet för compassionate use. I en fas III-studie av ATTRm hos patienter med övervägande neurologiskt engagemang, varav mer än hälften hade hjärtsjukdom, fann man inga signifikanta skillnader i ekokardiografiska parametrar under studieperioden (tabell 2).45 Dess potential för gastrointestinala biverkningar, njursvikt, vätskeretention och hypertoni gör det olämpligt för patienter med hjärtsjukdom. Evidens om diflunisal hos patienter med ATTR är mycket begränsad. Det finns en studie, men den begränsades av att den hade en icke-randomiserad singelcenterdesign med liten uppföljning och få patienter (n = 13). Det fanns inga inläggningar för dekompenserad HF, men det fanns en signifikant försämring av njurfunktionen.46
- –
Nyligen visade en spansk grupp att tolkapon (en oral katekol-O-metyltransferashämmare som används vid behandling av Parkinsons sjukdom) har förmågan att in vitro binda till TTR hos patienter med ATTRwt och Val122Ile med högre affinitet än andra stabilisatorer.47
Eliminering av amyloidavlagringar
Amyloidavlagringar är mycket stabila och det verkar som om den mänskliga organismen har liten förmåga att eliminera dem. Behandlingar som förhindrar nyproduktion av amyloid, t.ex. kemoterapi i AL, kan dock gradvis eliminera avlagringar i olika organspecifika hastigheter. Hjärtans clearance är särskilt låg och än så länge är bevisen för regression sällsynta. Flera molekyler undersöks för närvarande för att påskynda den kardiella clearance av amyloid i ATTR:
- –
Doxycyklin (ett vanligt förekommande antibiotikum) stör bildningen av amyloidfibriller. Den synergistiska effekten av kombinerat doxycyklin och tauroursodeoxycholisk gallsyra (TUDCA), som används vid behandling av leversjukdomar, har visats eliminera TTR-avlagringar i djurmodeller. En fas II-studie med 20 patienter visade ingen kardiell eller neurologisk progression efter ett års behandling med doxycyklin/TUDCA, med en acceptabel säkerhets- och tolerabilitetsprofil.4 I andra fas II-studier har man försökt bekräfta dessa resultat genom att använda kombinerat doxycyklin/TUDCA, doxycyklin/ursodeoxikolsyra eller enbart doxycyklin.48-50 De preliminära resultaten från en av dessa studier tyder på en skyddande effekt, med mindre försämring av hjärtfunktionen på grund av belastning i behandlingsgruppen. I en annan av dessa studier erhölls liknande resultat hos 40 patienter med ATTR: parametrarna NT-proBNP, funktionell klass, LVEF och myokardietjocklek, bland annat, förblev stabila efter 12 månader (tabell 2). Trots detta hade alla dessa studier ett högt bortfall (35-44 %), främst på grund av biverkningar, särskilt solöverkänslighet och gastrointestinala besvär (upp till 30 %).48-50
- –
Eggcg (epigallocatechin-3-gallat) är den vanligaste katekinet i grönt te och har in vitro och i en murinmodell visat sig hämma amyloidbildning och eliminera befintliga avlagringar.4 CMRI visade att daglig administrering av 600 mg EGCG var förknippad med stabilisering av vänsterkammarmassan i en grupp av 25 patienter (tabell 2).51
- –
PRX004 är en monoklonal antikropp som verkar genom att binda till monomerspecifika epitoper och felveckad TTR. Den framkallar således eliminering av avlagringar genom att aktivera fagocytos.52 Grunden för dess verkningsmekanism liknar den för en antikropp som används vid AL. Fas II-studier på denna antikropp visar lovande resultat. En fas I-II-studie av denna nya antikropp kommer att inledas 2017.
- –
Oavsett typen av amyloidprekursorprotein innehåller alla avlagringar amyloidkomponent P i serum (SAP). Med denna molekyl som måltavla har anti-SAP-antikroppar visat sig framkalla en makrofagmedierad och komplementberoende reaktion som orsakade en omfattande eliminering av viscerala amyloidavlagringar i en murinmodell. Bis-D-prolinföreningen CPHPC kan neutralisera plasma-SAP, och samtidig administrering med anti-SAP IgG gör det möjligt för antikroppen att nå SAP-innehållande avlagringar i vävnad.53 En fas I-studie som publicerades 2015 visade eliminering av leveravlagringar hos 15 patienter med systemisk amyloidos utan hjärtinblandning, med få biverkningar.53 En fas II-studie av patienter med ATTR-kardiell amyloidos och AL kommer att påbörjas 2017 (tabell 2).
KONKLUSIONER
Transthyretin-kardiell amyloidos diagnostiseras med ökande frekvens. 99mTc-DPD-scintigrafi och CMRI är exempel på tekniker som kan användas för enkel och tidig identifiering av patienter med ATTR.
Flera ATTR-specifika läkemedel befinner sig för närvarande i slutfasen av forskningen. Därför tror vi att ATTR-kardiell amyloidos snart kommer att betraktas som en behandlingsbar entitet snarare än en dödlig sjukdom.
FINANsiering
Detta arbete utfördes med delvis stöd från Carlos III Health Institute och det spanska kardiologisällskapet (forskningsanslag 2016 till E. González-López). Stödet från Carlos III Health Institute finansieras av Europeiska regionala utvecklingsfonden ”Another Way to Make Europe”.
Interessentkonflikter
E. González-López har deltagit som talare i aktiviteter som anordnats av Pfizer. P. Garcia-Pavia har fått ersättning som talare vid aktiviteter som anordnats av Pfizer och som konsult till Alnylam, Prothena och Pfizer. E. González-López, A. López-Sainz och P. Garcia-Pavia förklarar att Pfizer har finansierat forskningsprojekt vid deras institution.
- –
- –