Som vi har sett innehåller vår kost många kolhydrater, och du kanske undrar om det finns ett sätt att analysera ett prov för att avgöra om det är sackaros eller ett av de syntetiska sötningsmedlen som sorbitol eller majssirap med hög fruktos eller till och med en förening som C-vitamin, som syntetiseras från sockerarter och som i likhet med dessa bara innehåller C, H och O. Det finns ett sådant sätt, och det är en av de mest fundamentalt viktiga analysformerna, kallad elementaranalys. Det är en av de första metoderna som forskare använder för att identifiera en ny förening.
Här har vi hittills fått fram alla stökiometriska förhållanden från koefficienterna i balanserade kemiska ekvationer. Kemiska formler anger dock också relativa mängder av ämnen, och stökiometriska förhållanden kan också härledas från dem. Till exempel säger formeln CO2 att oavsett hur stort prov av koldioxid vi har, kommer det alltid att finnas 2 mol syreatomer för varje mol kolatomer. Det vill säga, från formeln CO2 har vi det stökiometriska förhållandet
\
Vi kan också bestämma att för CO2
\
\
\
(De reciproka delarna av dessa stökiometriska förhållanden är också giltiga för CO2.)
Stökiometriska förhållanden som härleds från formler i stället för ekvationer ingår i det vanligaste förfarandet för att bestämma de empiriska formlerna för föreningar som endast innehåller C, H och O. En vägd mängd av det ämne som ska analyseras placeras i ett förbränningståg och värms upp i en ström av torrt O2. Allt H i föreningen omvandlas till H2O(g) som selektivt fångas upp i ett tidigare vägt absorptionsrör. Allt C omvandlas till CO2(g) och detta absorberas selektivt i ett andra rör. Ökningen av massan i varje rör anger hur mycket H2O respektive CO2 som producerades vid förbränning av provet
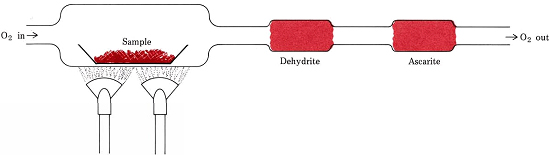
Figur \(\PageIndex{1}\) Ett förbränningståg. H2O och CO2, som produceras genom kombination av O2 med H och C i provet, absorberas selektivt av rör som innehåller dehydrit och askarit (NaOH på asbest).
Exempel \(\PageIndex{1}\): Empirisk formel för askorbinsyra
Ett prov på 6,49 mg askorbinsyra (C-vitamin) förbrändes i ett förbränningståg. Det bildades 9,74 mg CO2 och 2,64 mg H2O. Bestäm den empiriska formeln för askorbinsyra.
Lösning Vi måste känna till mängden C, mängden H och mängden O i provet. Förhållandet mellan dessa ger subscripts i formeln. De två första kan erhållas från massorna av CO2 och H2O med hjälp av de molära massorna och de stökiometriska förhållandena
\
Därmed
Förbindelsen kan också ha innehållit syre. För att se om den har det, beräkna massorna av C och H och subtrahera från provets totala massa
Därmed har vi
och
Eftersom nC:nH:nO är 3 mol C:4 mol H:3 mol O är den empiriska formeln C3H4O3.
En ritning av en molekyl av askorbinsyra visas här. Du kan bestämma genom att räkna atomerna att molekylformeln är C6H8O6 – exakt dubbelt så mycket som den empiriska formeln. Det är också uppenbart att det finns mer att veta om en molekyl än bara hur många atomer av varje slag som finns. I askorbinsyra, liksom i andra molekyler, är det sätt på vilket atomerna är sammankopplade och deras placering i det tredimensionella rummet ganska viktigt. En bild som visar vilka atomer som är kopplade till vilka kallas en strukturformel. Empiriska formler kan erhållas från procentuell sammansättning eller från experiment med förbränningståg, och om molekylvikten är känd kan molekylformlerna bestämmas från samma uppgifter. Det krävs mer komplicerade experiment för att hitta strukturformler. I exempel 2 fick vi fram massan av O genom att subtrahera massorna av C och H från provets totala massa. Detta förutsatte att endast C, H och O var närvarande. Ibland kan ett sådant antagande vara felaktigt. När penicillin först isolerades och analyserades missade man att det innehöll svavel. Detta misstag upptäcktes inte förrän efter en tid eftersom atomvikten för svavel är nästan exakt dubbelt så stor som för syre. Två syreatomer ersattes i stället för en svavelatom i formeln.
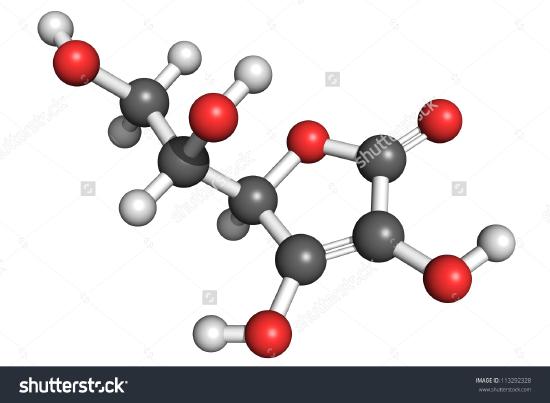
Figur \(\PageIndex{2}\) En 3D-representation av L-Ascorbinsyra 1
Från ChemPRIME: 3.4: Analys av föreningar