Den mest generella principen för syrastyrka kan sägas vara: starka syror har relativt stabila konjugerade baser. I allmänhet gäller att ju stabilare den konjugerade basen är, desto starkare är syran. En viktig sak att komma ihåg är att stabilitet och reaktivitet är omvända. Ju stabilare ett ämne är, desto mindre reaktivt är det, och vice versa. Ett annat sätt att uttrycka regeln ovan är därför att säga att starka syror har svaga konjugerade baser. HCl och H3O+ är starka syror. Följaktligen är motsvarande konjugerade baser, Cl- och H2O, svaga (mycket stabila). Kloridjonen är stabil eftersom den negativa laddningen sitter på en mycket elektronegativ atom. Vattenmolekylen är ett av de mest stabila ämnen vi känner till.
Hur vet vi vilken proton som är den mest sura i en molekyl (t.ex. ättiksyra) som innehåller mer än en typ av proton? Kom ihåg att ju högre grad av positiv karaktär protonerna har, desto surare är de. Undersökning av en pKa-tabell avslöjar vissa tendenser för sura protoner. Följande riktlinjer kan användas för att förutsäga surheten.
1. Vätesubstanser som är direkt knutna till mycket elektronegativa atomer som syre, svavel och halogenerna har en betydande grad av surhet.
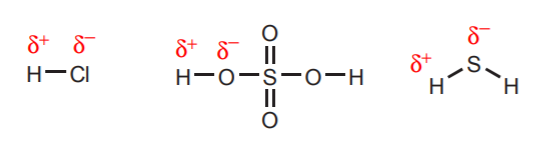
2. Vätesubstanser som är knutna till ett positivt laddat kväve, syre eller svavel är sura. Den höga elektronegativiteten hos dessa atomer gör dem obekväma med den positiva laddningen. De försöker sprida laddningen bland grannatomerna genom att dra tillbaka elektrontätheten från dem. Detta kan visas genom att rita resonansstrukturer som visas.
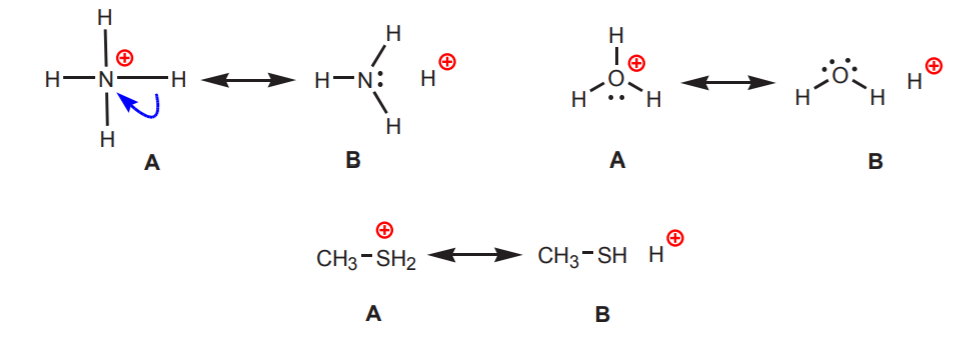
I samtliga fall avslöjar struktur B vätets positiva karaktär och därmed dess sura karaktär.
3. Som framgår av pKa-värdena för alkaner och alkener har väte som är knutet till kol en mycket låg surhet. Sådana ämnen betraktas normalt inte alls som syror. Vissa kolväten kan dock vara svagt sura om deras konjugerade baser är stabila joner. Detta kan ske i följande fall:
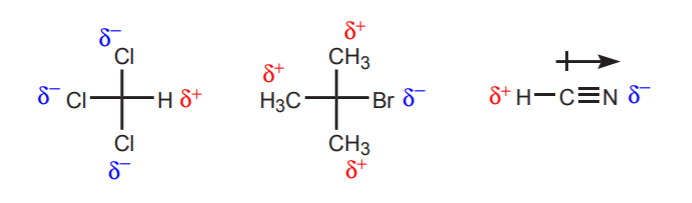
a) Det finns en eller flera elektronegativa atomer i närheten av den aktuella protonen. Den induktiva effekten av dessa elektronegativa atomer gör att väteatomerna i närheten saknar elektrontäthet och därför har delvis positiv karaktär.
b) En väteatom som är bunden till ett kol som i sin tur är bunden till ett annat kol som bär en partiell eller fullständig positiv laddning är sur.
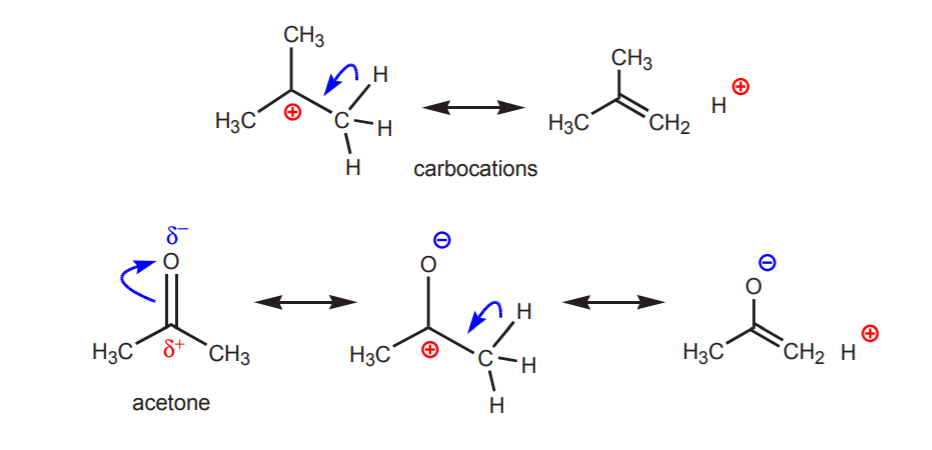
De visade protonernas surhet blir uppenbar i eliminationsreaktioner (kapitel 6) och i enolernas kemi (kapitel 22), när när närvaron av en bas leder till att alkener eller enolatjoner bildas genom ett steg som inbegriper en protonöverföring.
c) Den konjugerade basen är resonansstabiliserad. Denna effekt är viktigast när det finns en annan faktor som förstärker surheten, t.ex. närvaron av en dipol eller elektronegativ atom (som i den funktionella nitrilgruppen, -CN). Annars är resonansstabilisering i sig inte tillräckligt för att dramatiskt öka surheten hos ett väte som är knutet till kol (som i toluen, där pKa endast är 40).
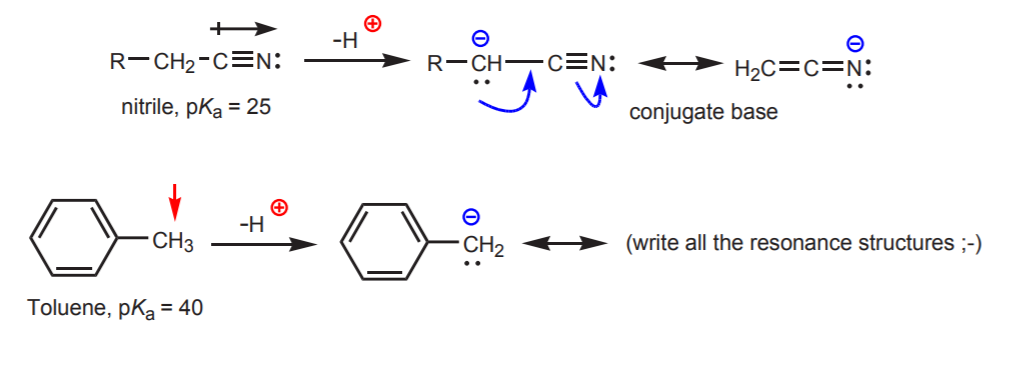
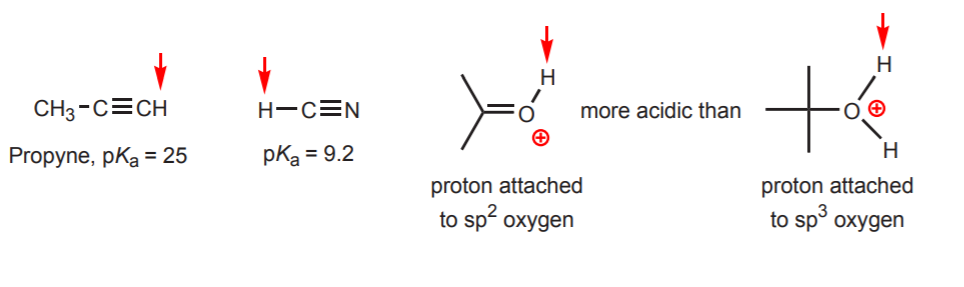
d) Vätet är knutet till ett sp-hybridiserat kol. Hybridiseringseffekter på surheten diskuteras i kapitel 9. Trenderna för hybridisering kan utvidgas till syre och kväve förutom kol, som i exemplet till höger.
.