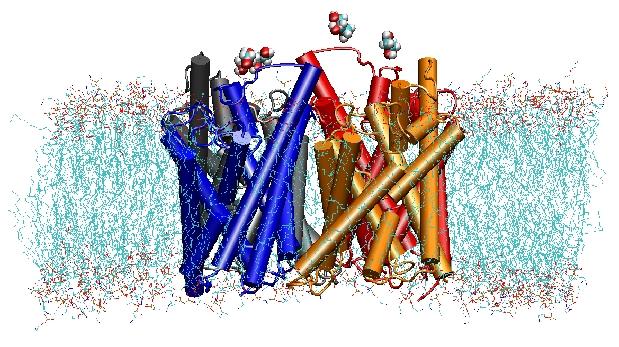
Structure, Dynamics, and Function of Aquaporins
 2004 Winner of Visualization Challenge in Science and Engineering,
2004 Winner of Visualization Challenge in Science and Engineering, Organized by the National Science Foundation and Science Magazine. (Viz související článek v Science.)
Náš film o prostupu vody a Nobelova cena za chemii za rok 2003
Umění transportu vody v akvaporinech
Akvaporiny jsou membránové vodní kanály, které hrají kritickou roli při kontrole obsahu vody v buňkách. Tyto kanályjsou široce rozšířeny ve všech říších života, včetně bakterií,rostlin a savců. V lidském těle bylo nalezeno více než deset různých akvaporinů a s narušenou funkcí těchto kanálů souvisí několik onemocnění, například vrozená katarakta nebo nefrogenní diabetes insipidus. V buněčné membráně tvoří tetramery a usnadňují transport vody a v některých případech i dalších malých rozpuštěných látek přes membránu. Vodní póry jsou však zcela nepropustné pro nabité látky, jako jsou protony, což je pozoruhodná vlastnost, která je rozhodující pro zachování elektrochemického potenciálu membrány, ale zároveň paradoxní, protože protony mohou být obvykle snadno přenášeny molekulami vody. Výsledky našich simulací nyní poskytly nový pohled na mechanismus, který je základem této fascinující vlastnosti. Molekuly vody procházející kanálem jsou nuceny elektrostatickými silami proteinu přetočit se ve středu kanálu (viz animace), čímž se poruší alternativní uspořádání donor-akceptor, které je nezbytné pro přenos protonů (celý příběh si můžete přečíst v našem článku v časopise Science).

Funkční význam zvláštní architektury proteinu
V roce 2000 se Stroudově laboratoři na UCSF podařilo vyřešit první strukturu akvaporinu s vysokým rozlišením pomocí rentgenové krystalografie. Studovaná struktura byla strukturou E. coliglycerol uptake facilitator (GlpF), což je akvaglyceroporin,tj. kanál propustný i pro malé lineární molekuly cukrůjako je glycerol. Nanosekundové MD simulace tetramerního GlpF v hydratované vrstvě lipidové dvojvrstvy POPE charakterizovaly kompletní cestu vedení substrátu v kanálu. Analýza vodíkových vazebinterakcí substrátu s vnitřkem kanálu také poprvé vysvětlila, proč tyto kanály obsahují ve své architektuře dvě charakteristické smyčky, včetně energeticky nepříznivých prvků sekundární struktury, které jsou konzervovány v celé akvaporinové rodině (Jensenet al., Structure, 2001).
Energetika propustnosti cukrů
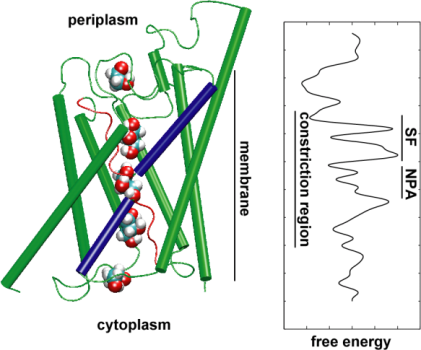
Poté jsme zkoumali energetiku transportního kanálu, abychom pochopili, jaké překážky musí substrát překonat při průchodu kanálem. Abychom popsali profil volné energie, vypočítali jsme potenciál střední síly proúplnou kondukční událost z trajektorií, ve kterých byl pohyb glycerolu kanálem urychlen působením vnějších sil. Tato technika, známá jako řízená molekulová dynamika (SMD), umožňuje pozorovat pomalé události v rámci dostupné časové škály MD simulací. Vzhledem k nerovnovážné povaze trajektorií se však při analýze výsledků setkáváme s problémem nevratné práce, kterou je třeba započítat. Pomocí Jarzinského identity, rovnosti mezi volnou energií a prací v nerovnovážných systémech, jsme mohli kompletně popsat energetiku transportu glycerolu kanálem. Vypočtený potenciál střední síly zachycuje hlavní vazebná místa a bariéry v kanálu v těsném souladu s výsledky rovnovážných MD simulací a krystalové struktury. Navíc se v jeho tvaru projevuje výrazná asymetrie, což naznačuje, žeasymetrická struktura proteinu může být funkčně důležitá pro efektivní příjem živných molekul z prostředí. (Jensen, etal., PNAS, 2002).
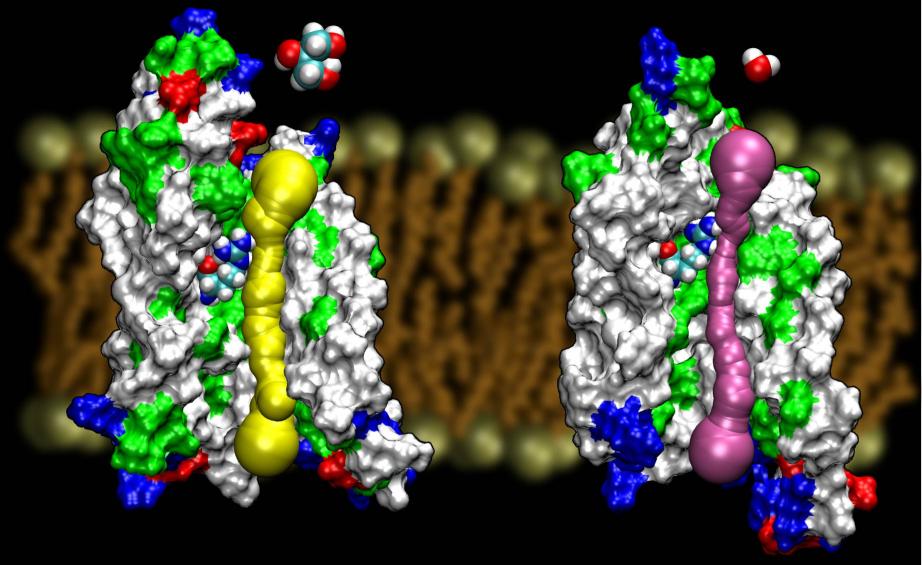
Co dělá akvaporin glycerolovým kanálem
Akvaporiny jsou velmi šťastnou rodinou membránových proteinů,které jsou notoricky odolné vůči určování struktury. Známe struktury s vysokým rozlišením několika AQP: GlpF, AQP1, AQP0 aAqpZ. Očekává se, že se brzy objeví další struktury. Dostupnost struktury dvou AQP z E. coli, z nichž jeden je čistě vodním kanálem (AqpZ) a druhý je glycerolovým kanálem (GlpF), nám poskytla jedinečnou příležitost pochopit principy selektivity uplatňované přírodou při použití dvou geneticky a strukturně vysoce homologních kanálů pro membránový přenos různých látek. porovnání bariér vypočtených pro vedení glycerolu v těchto dvou kanálech ukázalo, že AqpZ využívá sterické bariéry, aby ztížil průchod glycerolu. Ve skutečnosti je pór celkově užší než GlpF (viz obrázek níže). Zdá se, že příroda se obrátila k velmi základnímu mechanismu, totiž k ladění velikosti pórů kanálu, aby dva proteiny ze stejné rodiny vykazovaly různé vodivé vlastnosti. Celý článek si můžete přečíst v časopise Wang, etal., STRUCTURE, 2005.
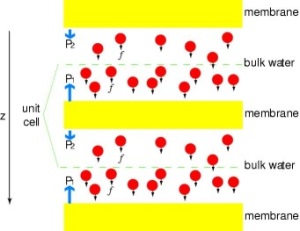
Putting Channels under Pressure
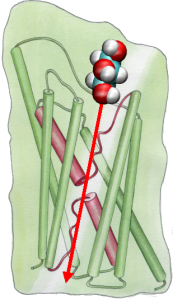
Abychom mohli přímo porovnat výsledky MDsimulací s biochemickými měřeními vodivosti membránových vodních kanálů, při nichž se k vyvolání toku vody přes membránu používají osmotické tlakové gradienty, vyvinuli jsme novoumetodiku pro MD simulace. Působením malých sil na molekuly vody v objemové oblasti (viz obrázek) se přes membránu vytváří gradient hydrostatického tlaku. Tlakový gradient vyvolává rychlost vedení, kterou lze studovat pomocí MD simulací, které jsou obvykle omezeny na několik nanosekund. Tato metoda byla použita při simulaci permeace vody přes GlpF a vedla k lineární korelaci mezi aplikovaným tlakem a tokem (Zhu et al.,Biophys. J., 2002).
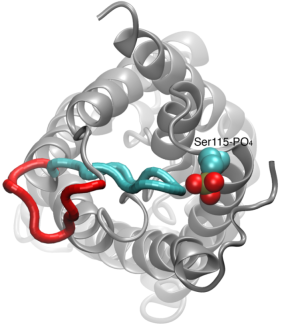
Gating of Water Channels
Propouštění vody přes akvaporiny je pasivní proces, který sleduje směr osmotického tlaku přes membránu. Ačkoli mnoho akvaporinů funguje jako stále otevřené kanály, u podskupiny akvaporinů, zejména u rostlin, se vyvinul důmyslný molekulární mechanismus, díky němuž se kanál může uzavřít v reakci na nepříznivé podmínky prostředí, za nichž může být výměna vody pro organismus škodlivá. Příkladem takových podmínek jsou stres suchem a záplavy, které vyvolávají určité buněčné signály (defosforylaci a změnu pH), jež vedou k uzavření kanálu. Nedávno vyřešená struktura akvaporinu ze špenátu byla simulována za různých podmínek, aby se prozkoumal molekulární mechansim bránění v těchto membránových kanálech. Bylo zjištěno, že prodloužená cytoplazmatická smyčka u akvaporinů schopných gatingu fyzicky uzavírá vstup do vodního póru v uzavřeném kanálu a blokuje přístup molekul vody do póru. Posunutí této smyčky v reakci na fosforylaci, jak bylo pozorováno v simulacích, odstraňuje smyčku z cytoplazmatického vstupu do póru. Navíc hydrofobní aminokyselina, která je konformačně těsně spojena s touto smyčkou, bude v důsledku pohybu smyčky vytažena zpět z kanálu. Tyto molekulární události společně vedou k otevřenému kanálu, který je propustný pro molekuly vody. Studie vyšla v časopise Nature2006.

Gating and Ion Conductivity of the Tetrameric Pore
AQP jsou obecně známé svou vysokou propustností pro vodu. Předpokládá se však jejich zapojení do dalších buněčných funkcí, včetně prostupu malých molekul jiných než voda, a také do komunikace mezi buňkami. Tetramerizace je běžným strukturním rysem AQP. Skutečnost, že každý ze čtyř monomerů tvoří funkčně nezávislý vodní pór, ale pro svou funkci vyžadují tetramerní uspořádání, naznačuje synergický přínos oligomerizace, a nutí tak k další analýze potenciální role centrálního póru v AQPs. Zajímavým návrhem je možné zapojení centrálního póru do iontového vedení při aktivaci cGMP. Pomocí MD simulací membránových modelů AQP1 jsme tuto vlastnost AQP1 zkoumali, abychom zjistili, jak a za jakýchkonformačních a hydratačních podmínek může centrální pór vést ionty a jak je tato vodivost regulována. Jedna z cytoplazmatických smyček, konkrétně smyčka D bohatá na arginin, hrála podle našich simulací klíčovou roli při aktivaci centrálního póru zprostředkovanou cGMP. Předpokládaná role smyčky D byla experimentálně ověřena navrženým mutantem smyčky D, který vykazoval úplnou ztrátu iontové vodivosti ( Yu et al.,Structure, 2006 ).
Molekuly plynů dojíždějí do buňky
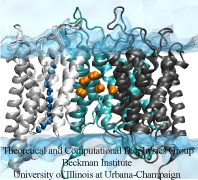
Mnoho lidí jezdí každé ráno do práce autem, jiní mohou jet na kole, autobusem nebo metrem. podobně i různé biomolekuly v lidském těle se dostávají na místo svého určení různými způsoby. Například malé hydrofobní molekuly plynů, aby prošly buněčnou membránou, difundují lipidovou vrstvou, zatímco molekuly vody procházejí akvaporiny (AQP). zajímavé je, že stejně jako se člověk může dostat do práce autobusem i autem, bylo nedávno zjištěno, že některé molekuly plynů mohou mít více než jednu cestu, jak projít membránou, tj, Kromě difúze přeslipidy mohou AQP procházet také kyslík a oxid uhličitý.Cesty, kterými tyto plynné molekuly procházejí, však zůstávají neznámé.Pomocí molekulární dynamiky provedené pomocí NAMD jsme zkoumali propustnost AQP1 pro plyny pomocí dvou komplementárních metod (explicitní simulace difúze plynů a implicitní vzorkování ligandů). Výsledky simulací naznačují, že zatímco čtyřmonomerní póry AQP1 fungují jako vodní kanály, centrální pór AQP1 může sloužit jako cesta pro molekuly plynů přes membránu (Wang et al., Journal of Structural Biology, 2007 ).
Molekulární překážková dráha
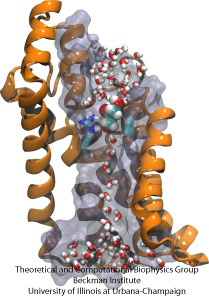
Biologické buňky chrání své nitro prostřednictvím buněčných membrán, přesto jsou závislé na importu živin. Vyvinuly si pro tento import rychlé vodivé kanály, které obsahují spolehlivé kontrolní body rozlišující žádoucí a nežádoucí sloučeniny. Kontrolní bod staví skutečnou překážkovou dráhu, kterou mohou rychle projít jen ty správné sloučeniny. Pochopení konstrukce kanálů je obtížné kvůli nedostatku podrobných experimentálních údajů o dynamice živin. V současnosti nejpodrobnější informace pocházejí z počítačového zobrazení dynamiky kanálů, přičemž se vychází ze statických krystalografických struktur. Nedávná studie zkoumala, jak glyceroly, malé živné molekuly potřebné pro některé bakterie, procházejí kontrolními body realizovanými prostřednictvím glycerolového kanálu GlpF. GlpF poskytuje čtyři paralelní kanály, které byly sledovány výpočetně pomocí NAMD a nového algoritmu, který zkoumá energetiku kanálů dostatečně rychle, aby to bylo metodicky proveditelné na dnešních počítačích. Výsledky ukazují, jak jsou podél kanálu zkoumány fyzikální vlastnosti glycerolů, jejich schopnost vytvářet tzv. vodíkové vazby, jejich elektrické dipólové momenty, jejich difúzní pohyblivost a jejich vnitřní flexibilita (Henin et al., Biophysical Journal, v tisku ).
Náš výzkum akvaporinů ve zprávách
|
Tým Aquaporin
|
Publikace
-//W3C//DTD XHTML 1.0 Transitional//EN“ „http://www.w3.org/TR/xhtml1/DTD/xhtml1-transitional.dtd“>Publications Databáze Difuze glycerolu přes akvaglyceroporin GlpF Escherichia coli.“ Jerome Henin, Emad Tajkhorshid, Klaus Schulten a Christophe Chipot. Biophysical Journal, 94:832-839, 2008. Exploring gas permeability of cellular membranes and membrane channels with molecular dynamics (Zkoumání propustnosti plynů buněčných membrán a membránových kanálů pomocí molekulární dynamiky).Yi Wang, Jordi Cohen, Walter F. Boron, Klaus Schulten, and Emad Tajkhorshid. Journal of Structural Biology, 157:534-544, 2007. Mechanism of gating and ion conductivity of a possible tetrameric pore in Aquaporin-1. Jin Yu, Andrea J. Yool, Klaus Schulten, and Emad Tajkhorshid. Structure, 14:1411-1423, 2006. Structural mechanism of plant aquaporin gating.S. Törnroth-Horsefield, Y. Wang, K. Hedfalk, U. Johanson, M. Karlsson, E. Tajkhorshid, R. Neutze, and P. Kjellbom. Nature, 439:688-694, 2006. Co dělá akvaporin glycerolovým kanálem: Yi Wang, Klaus Schulten a Emad Tajkhorshid. Structure, 13:1107-1118, 2005. Kinetic theory and simulation of single-channel water transport (Kinetická teorie a simulace jednokanálového transportu vody).Emad Tajkhorshid, Fangqiang Zhu, and Klaus Schulten. In S. Yip, editor, Handbook of Materials Modeling, Vol. I: Methods and Models, s. 1797-1822. Springer, Nizozemsko, 2005. Towards understanding membrane channels (K pochopení membránových kanálů): Emad Tajkhorshid, Jordi Cohen, Aleksij Aksimentiev, Marcos Sotomayor a Klaus Schulten. In Boris Martinac a Andrzej Kubalski, editoři, Bakteriální iontové kanály a jejich eukaryotické homology, pp. 153-190. ASM Press, Washington, DC, 2005. Collective diffusion model for water permeation through microscopic channels [Kolektivní difuzní model pro prostup vody mikroskopickými kanály] Fangqiang Zhu, Emad Tajkhorshid, and Klaus Schulten. Physical Review Letters, 93:224501, 2004. (4 strany). Computational studies of membrane channels (Výpočetní studie membránových kanálů). benoit Roux a Klaus Schulten. Structure, 12:1343-1351, 2004.