Hlavní rozdíl – sterické a torzní pnutí
Pnutí je odpuzování mezi vazebnými elektrony molekuly. Uspořádání molekuly závisí na deformaci, protože vazebné elektronové páry jsou uspořádány tak, aby se deformace minimalizovala. V molekule se vyskytují tři hlavní typy deformace. Jsou to úhlová deformace, torzní deformace a sterická deformace. Úhlové napětí vzniká, když se vazebné úhly skutečných molekul liší od vazebných úhlů ideálních molekul. Torzní deformace vzniká, když se molekula otáčí kolem vazby. Sterické napětí vzniká, když se dvě nebo více objemných skupin přiblíží k sobě. Hlavní rozdíl mezi sterickým a torzním napětím spočívá v tom, že sterické napětí nelze zmenšit otáčením molekuly kolem vazby, zatímco torzní napětí lze zmenšit otáčením molekuly kolem vazby.
Klíčové oblasti, kterými se zabýváme
1. Co je to sterické napětí
– definice, vysvětlení s příklady
2. Co je to torzní napětí
– definice, vysvětlení s příklady
3. Jaký je rozdíl mezi sterickým a torzním napětím
– porovnání klíčových rozdílů
Klíčové pojmy: Úhlové napětí, elektronový pár vazby, sterické napětí, torzní napětí

Co je to sterické napětí
Sterické napětí je odpuzování mezi dvěma atomy nebo skupinami atomů při zmenšení vzdálenosti mezi nimi. Nazývá se také sterická překážka. Sterické napětí je velmi důležité při určování uspořádání molekuly, protože každá molekula je uspořádána tak, aby sterické napětí bylo minimální. Když je sterické napětí minimalizováno, snižuje se potenciální energie dané molekuly. Protože hmota je stabilní, když má nižší energetickou hladinu, nižší energetická hladina molekuly z ní činí stabilní molekulu.
Koncept sterického napětí je velmi důležitý při předpovídání produktů chemické reakce. Je to proto, že skupiny atomů jsou připojeny k atomu uhlíku takovým způsobem, že sterická překážka je minimalizována. Proto při chemické reakci vznikne směs molekul, v níž jsou zahrnuty stabilní produkty a nestabilní produkty. Hlavní složkou této směsi však bude vždy stabilní produkt s minimalizovanou sterickou překážkou.

Obrázek 1: Sterické napětí v organických sloučeninách
Jak je znázorněno na výše uvedeném obrázku, potenciální energie molekuly se zvyšuje podle sterického napětí, které mají. Když se vzdálenost mezi dvěma methylovými skupinami zmenší, potenciální energie se zvýší.
Obrázek 2: Sterické napětí se zvyšuje, když jsou přítomny objemné skupiny
Výše uvedený obrázek ukazuje, že sterické napětí se zvyšuje, když jsou přítomny objemné skupiny. Více stericky brzděné molekuly mají vyšší potenciální energii ve srovnání s méně stericky brzděnými molekulami. Proto jsou méně stericky brzděné molekuly stabilnější.
Co je torzní napětí
Torzní napětí je odpuzování, které vzniká mezi atomy nebo skupinou atomů při rotaci molekuly kolem sigma vazby. Jedná se o odpuzování, které lze pozorovat, když vazebné elektrony procházejí kolem sebe. Tento typ napětí je důležitý při určování stabilních konformací organických sloučenin. Tyto konformace lze znázornit pomocí Newmanových projekcí. Newmanova projekce molekuly je konformace této molekuly při pohledu přes vazbu C-C ze směru zepředu dozadu.
Torzní deformace vzniká, když je dihedrální úhel objemných skupin nízký. Difedrální úhel je úhel mezi dvěma vazbami dvou různých atomů uhlíku v Newmanově projekci. Pokud je dihedrální úhel vysoký, pak je torzní deformace nízká.
Newmanovy projekce se vyskytují ve dvou typech jako rozložená konformace a zatmělá konformace. Zatemněná konformace vykazuje vysoké torzní napětí než konformace šachovnicová.
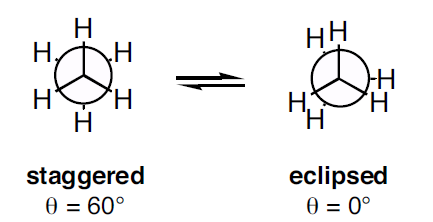
Obrázek 3: Dva typy Newmanovy projekce
Jak je vidět na výše uvedeném obrázku, šachovnicová konformace vykazuje dihedrální úhel 60o a zatemněná konformace dihedrální úhel 0o. Při rotaci molekuly se však konformace změní. Torzní deformace v rozložené konformaci je nižší než v zatměné konformaci. Při rotaci molekuly se ze zatmělé konformace může stát konformace rozložená; torzní deformace se tedy sníží.
Rozdíl mezi sterickou a torzní deformací
Definice
Sterická deformace: Sterické napětí je odpuzování mezi dvěma atomy nebo skupinami atomů při zmenšení vzdálenosti mezi nimi.
Torzní napětí:
Rotace molekuly
Sterické napětí: Torzní napětí je odpuzování, které vzniká mezi atomy nebo skupinou atomů při rotaci molekuly kolem sigma vazby:
Torzní napětí: Sterické napětí nelze zmenšit rotací molekuly kolem sigma vazby.
Torzní napětí:
Příčina deformace
Sterická deformace: Sterická deformace vzniká, když se zmenší vzdálenost mezi objemnými skupinami molekuly.
Torzní deformace:
Závěr
K torzní deformaci molekuly dochází, když se vazebné elektrony při rotaci molekuly vzájemně míjejí.
Závěr
Deformace molekuly je odpuzování mezi vazebnými elektrony nebo osamělými elektronovými páry přítomnými v této molekule. Toto odpuzování způsobuje zvýšení potenciální energie molekuly. Pak činí molekulu nestabilní. Sterické napětí molekuly je určeno objemnými skupinami přítomnými v molekule a vzdáleností mezi těmito objemnými skupinami. Newmanova projekce je jednoduchá struktura, která znázorňuje uspořádání atomů nebo skupin atomů v organické molekule. Lze ji použít k určení torzního napětí molekuly. Hlavní rozdíl mezi sterickým a torzním napětím spočívá v tom, že sterické napětí nelze zmenšit otáčením molekuly kolem vazby, zatímco torzní napětí lze zmenšit otáčením molekuly kolem vazby.
1. „Torzní deformace.“ OChemPal, Dostupné zde. Dostupné 28. 8. 2017.
2. „Strain (Chemistry)“. Wikipedia, Wikimedia Foundation, 25. července 2017, Dostupné zde. Dostupné 28. 8. 2017.
3. „Dihedral Angle“. OChemPal, Dostupné zde. Dostupné 28. 8. 2017.
Obrázek s laskavým svolením:
1. „Napthalene phenanthraene methyl-methyl strai“ By DMacks – Own work (Public Domain) via Commons Wikimedia
2. „Steric hindrance disp“ By Mwolf37 – Own work (CC BY-SA 3.0) via Commons Wikimedia
3. „Escalonada e eclipsada“ By Pauloquimico – Own work (CC BY-SA 3.0) via Commons Wikimedia
![]()
.