Hoofdverschil – Sterische vs Torsionale spanning
Spanning is de afstoting tussen bindingselektronen van een molecuul. De rangschikking van een molecuul hangt af van de spanning, omdat de elektronenparen van de bindingen zo worden gerangschikt, dat de spanning tot een minimum wordt beperkt. Er zijn drie hoofdtypen vervormingen die in een molecuul kunnen worden aangetroffen. Dat zijn hoekvervorming, torsievervorming en sterische vervorming. De hoekverdraaiing treedt op wanneer de bindingshoeken van reële moleculen verschillen van die van ideale moleculen. De torsievervorming ontstaat wanneer een molecuul rond een binding wordt gedraaid. Sterische vervorming ontstaat wanneer twee of meer volumineuze groepen dicht bij elkaar komen. Het belangrijkste verschil tussen sterische en torsionele spanning is dat sterische spanning niet kan worden verminderd door het molecuul rond een binding te draaien, terwijl torsionele spanning kan worden verminderd door het molecuul rond een binding te draaien.
Belichte gebieden
1. Wat is Sterische Vervorming
– Definitie, Uitleg met Voorbeelden
2. Wat is Torsionele Vervorming
– Definitie, Uitleg met Voorbeelden
3. Wat is het Verschil tussen Sterische en Torsionele Vervorming
– Vergelijking van de Belangrijkste Verschillen
Key Termen: Angular Strain, Bond Electron Pair, Steric Strain, Torsional Strain

Wat is Steric Strain
De sterische spanning is de afstoting tussen twee atomen of groepen atomen als de afstand tussen hen wordt verkleind. Dit wordt ook wel sterische hinder genoemd. De sterische vervorming is zeer belangrijk bij het bepalen van de rangschikking van een molecuul, omdat elk molecuul zo wordt gerangschikt dat de sterische vervorming tot een minimum wordt beperkt. Wanneer de sterische vervorming tot een minimum is beperkt, neemt de potentiële energie van dat molecuul af. Aangezien materie stabiel is wanneer zij een lager energieniveau heeft, maakt het lagere energieniveau van een molecuul het tot een stabiel molecuul.
Het concept van sterische vervorming is zeer belangrijk bij het voorspellen van de producten van een chemische reactie. Dit komt omdat groepen atomen op zodanige wijze aan een koolstofatoom zijn verbonden, dat de sterische hinder tot een minimum wordt beperkt. Daarom zal een chemische reactie een mengsel van moleculen opleveren waarin stabiele producten en onstabiele producten zijn opgenomen. Maar het hoofdbestanddeel van dit mengsel zal altijd het stabiele product met een geminimaliseerde sterische hinder zijn.

Figuur 1: Sterische spanning in organische verbindingen
Zoals in de bovenstaande afbeelding te zien is, neemt de potentiële energie van een molecuul toe naarmate de sterische spanning groter is. Wanneer de afstand tussen twee methylgroepen kleiner wordt, neemt de potentiële energie toe.
Figuur 2: Sterische spanning neemt toe wanneer volumineuze groepen aanwezig zijn
De bovenstaande afbeelding laat zien dat de sterische spanning toeneemt wanneer volumineuze groepen aanwezig zijn. Meer sterisch gehinderde moleculen hebben een hogere potentiële energie in vergelijking met minder sterisch gehinderde moleculen. Daarom zijn minder sterisch gehinderde moleculen stabieler.
Wat is Torsionale spanning
Torsionale spanning is de afstoting die ontstaat tussen atomen of groepen atomen wanneer een molecuul rond een sigma binding wordt geroteerd. Dit is de afstoting die kan worden waargenomen wanneer bindingselektronen langs elkaar heen gaan. Dit type spanning is belangrijk bij het bepalen van de stabiele conformaties van organische verbindingen. Deze conformaties kunnen worden voorgesteld door Newmanprojecties. De Newman projectie van een molecuul is de conformatie van dat molecuul wanneer men door de C-C binding heen kijkt vanuit de voor-achter richting.
De torsionale spanning ontstaat wanneer de dihedraalhoek van volumineuze groepen laag is. De dihedraalhoek is de hoek tussen twee bindingen van twee verschillende koolstofatomen in een Newmanprojectie. Als de dihedraalhoek groot is, is de torsievervorming gering.
Newmanprojecties zijn er in twee soorten: verspringende conformatie en verduisterde conformatie. De verduisterde conformatie vertoont een hogere torsiespanning dan de verspringende conformatie.
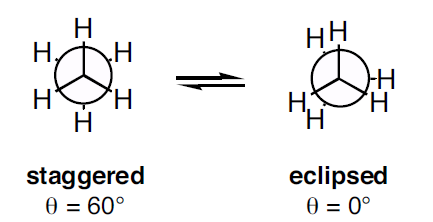
Figuur 3: Twee typen Newman-projectie
Zoals uit de bovenstaande afbeelding blijkt, vertoont de verspringende conformatie een tweevlakshoek van 60o en de verduisterde conformatie een tweevlakshoek van 0o. Maar als het molecuul wordt geroteerd, verandert de conformatie. De torsievervorming in de verspringende conformatie is lager dan die in de verduisterde conformatie. Wanneer het molecuul wordt geroteerd, kan de verduisterde conformatie overgaan in de verspringende conformatie; zo wordt de torsievervorming minder.
Verschil tussen Sterische en Torsievervorming
Definitie
Sterische vervorming: Sterische rek is de afstoting tussen twee atomen of groepen atomen wanneer de afstand tussen hen wordt verkleind.
Torsionele rek: Torsionale rek is de afstoting die ontstaat tussen atomen of groep atomen wanneer een molecuul om een sigma binding wordt gedraaid.
Rotatie van het Molecuul
Sterische rek: Sterische rek kan niet worden verminderd door het molecuul rond een sigma-binding te draaien.
Torsionale rek: Torsionale spanning kan worden verminderd door het molecuul rond een sigma binding te draaien.
Oorzaak van de spanning
Sterische spanning: Sterische rek treedt op wanneer de afstand tussen volumineuze groepen van een molecuul wordt verkleind.
Torsionele rek: Torsionale rek treedt op wanneer bindingselektronen elkaar passeren wanneer het molecuul draait.
Conclusie
De rek van een molecuul is de afstoting tussen bindingselektronen of lone elektronenparen die in dat molecuul aanwezig zijn. Deze afstoting zorgt ervoor dat de potentiële energie van een molecuul toeneemt. Daardoor wordt het molecuul onstabiel. De sterische spanning van een molecuul wordt bepaald door de volumineuze groepen die in een molecuul aanwezig zijn en de afstand tussen die volumineuze groepen. De Newmanprojectie is een eenvoudige structuur die de rangschikking van atomen of groepen atomen in een organisch molecuul weergeeft. Zij kan worden gebruikt om de torsiespanning van een molecuul te bepalen. Het belangrijkste verschil tussen sterische en torsionale rek is dat sterische rek niet kan worden verminderd door het molecuul rond een binding te draaien, terwijl torsionale rek kan worden verminderd door het molecuul rond een binding te draaien.
1. “Torsionele spanning.” OChemPal, Hier beschikbaar. Accessed 28 Aug. 2017.
2. “Strain (Chemistry).” Wikipedia, Wikimedia Foundation, 25 juli 2017, Hier beschikbaar. Accessed 28 Aug. 2017.
3. “Dihedral Angle.” OChemPal, Hier beschikbaar. Accessed 28 Aug. 2017.
Image Courtesy:
1. “Napthalene phenanthraene methyl-methyl strai” By DMacks – Own work (Public Domain) via Commons Wikimedia
2. “Steric hindrance disp” By Mwolf37 – Own work (CC BY-SA 3.0) via Commons Wikimedia
3. “Escalonada eclipsada” By Pauloquimico – Own work (CC BY-SA 3.0) via Commons Wikimedia
![]()
.