Structure, Dynamics, and Function of Aquaporins
 2004 Winner of Visualization Challenge in Science and Engineering,
2004 Winner of Visualization Challenge in Science and Engineering, Organiseerd door de National Science Foundation en Science Magazine. (Zie het gerelateerde Science artikel.)
Onze water permeatie film en de 2003Nobel prijs voor Scheikunde
The Art of Water Transport in Aquaporins
Aquaporins zijn membraan waterkanalen die een cruciale rol spelen bij het controleren van de waterinhoud van cellen. Deze kanalen zijn wijdverspreid in alle rijken van het leven, met inbegrip van bacteriën, planten, en zoogdieren. In het menselijk lichaam zijn meer dan tien verschillende aquaporines aangetroffen, en verschillende ziekten, zoals aangeboren cataract en nefrogene diabetes insipidus, houden verband met de gestoorde werking van deze kanalen. Zij vormen tetrameren in het celmembraan en vergemakkelijken het transport van water en, in sommige gevallen, andere kleine opgeloste stoffen over het membraan. De waterporiën zijn echter volledig ondoordringbaar voor geladen stoffen, zoals protonen, een opmerkelijke eigenschap die van cruciaal belang is voor het behoud van de elektrochemische potentiaal van het membraan, maar die tegelijkertijd paradoxaal is, omdat protonen gewoonlijk gemakkelijk door watermoleculen kunnen worden getransporteerd. De resultaten van onze simulaties hebben nu een nieuw inzicht verschaft in het mechanisme dat aan deze fascinerende eigenschap ten grondslag ligt. Watermoleculen die het kanaal passeren worden gedwongen, door de elektrostatische krachten van het eiwit, om te draaien in het midden van het kanaal (zie de animatie), waardoor de alternatieve donor-acceptor rangschikking die nodig is voor proton translocatie wordt verbroken (lees het volledige verhaal in onzeScience-paper).

Functionele Implicatie van een Eigenaardige Eiwit Architectuur
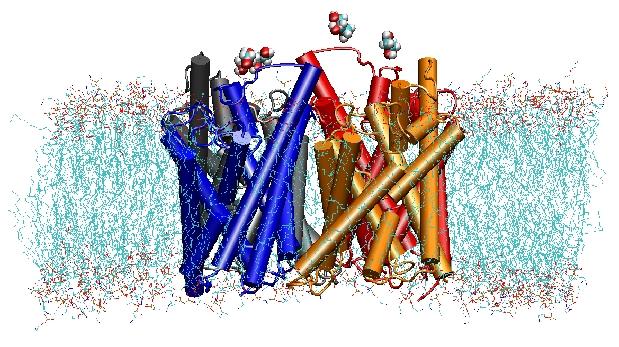
In het jaar 2000 slaagde het lab van Stroud aan de UCSF erin om de eerste hoge resolutie structuur van een aquaporine op te lossen door middel van röntgen-kristallografie. De bestudeerde structuur was die van de E. coliglycerol uptake facilitator (GlpF), die een aquaglyceroporine is, d.w.z., het kanaal is ook permeabel voor kleine lineaire suikermoleculen zoals glycerol. Nanoseconde MD simulaties van tetramerisch GlpF in een gehydrateerde patch van POPE lipide bilaag karakteriseerden de volledige route van substraat geleiding in het kanaal. Analyse van waterstofbruginteracties van het substraat met het inwendige van het kanaal verklaarde ook voor het eerst waarom deze kanalen twee karakteristieke lussen in hun architectuur hebben, inclusief energetisch ongunstige secundaire structuurelementen, die in de hele aquaporinfamilie bewaard blijven (Jensenet al, Structure, 2001).
Energetica van suikerpermeatie
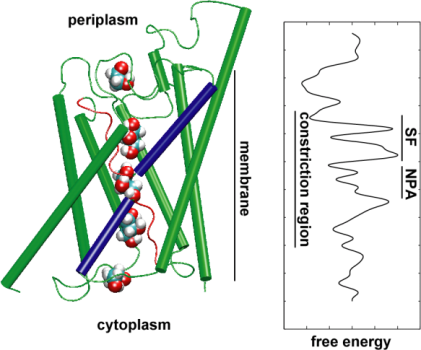
Vervolgens hebben we de energetica van het transportevent onderzocht om te begrijpen welke barrières een substraat moet overwinnen tijdens zijn passage door het kanaal. Om het vrije-energieprofiel te beschrijven, berekenden wij de potentiaal van de gemiddelde kracht voor de volledige geleidingsgebeurtenis uit de trajecten waarin de beweging van glycerol door het kanaal werd versneld door externe krachten toe te passen. Deze techniek, bekend als gestuurde moleculaire dynamica (SMD), maakt het mogelijk langzame gebeurtenissen te observeren binnen de toegankelijke tijdschaal van MD simulaties. Door het niet-evenwichtskarakter van de banen wordt men bij de analyse van de resultaten echter geconfronteerd met het probleem van onomkeerbare arbeid die in rekening moet worden gebracht. Met behulp van Jarzinsky’s identiteit, de gelijkheid tussen de vrije energie en de arbeid in niet-evenwichtssystemen, konden wij de energetica van het glyceroltransport door het kanaal volledig beschrijven. De berekende potentiaal van de gemiddelde kracht legt de belangrijkste bindingsplaatsen en barrières in het kanaal vast in nauwe overeenkomst met de resultaten van evenwichts-MD simulaties en de kristalstructuur. Bovendien vertoont het kanaal een uitgesproken asymmetrie in zijn vorm, wat suggereert dat deasymmetrische structuur van het eiwit functioneel belangrijk kan zijn voor een efficiënte opname van voedingsmoleculen uit de omgeving. (Jensen, etal., PNAS, 2002).
What Makes an Aquaporin a Glycerol Channel
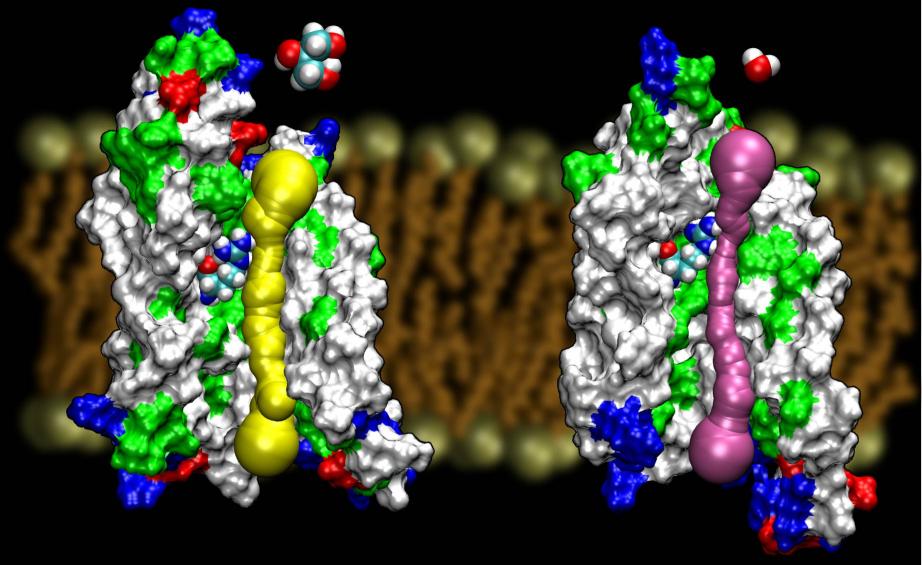
Aquaporins zijn een zeer gelukkige familie van membraaneiwitten, die notoir resistent zijn tegen structuurbepaling. We hebben hoge resolutie structuren van verschillende AQPs: GlpF, AQP1, AQP0, en AqpZ. Verwacht wordt dat binnenkort meer structuren beschikbaar zullen komen. De beschikbaarheid van de structuur van twee AQPs van E. coli, waarvan de ene een zuiver waterkanaal is (AqpZ) en de andere een glycerolkanaal (GlpF), bood ons een unieke gelegenheid om de selectiviteitsprincipes te begrijpen die de natuur hanteert bij het gebruik van twee genetisch en structureel sterk homologe kanalen voor membraantransport van verschillende materialen.Vergelijking van de barrières berekend voor geleiding van glycerol in deze twee kanalen toonde aan dat AqpZ gebruik maakt van sterische barrières om glycerol moeilijk door te laten. In feite is de porie in het algemeen nauwer dan GlpF (zie onderstaande figuur). Het lijkt erop dat de natuur gebruik heeft gemaakt van een zeer basaal mechanisme, namelijk het afstemmen van de poriegrootte van het kanaal, om twee eiwitten van dezelfde familie verschillende geleidingseigenschappen te laten vertonen. Lees het hele verhaal in Wang, etal., STRUCTURE, 2005.
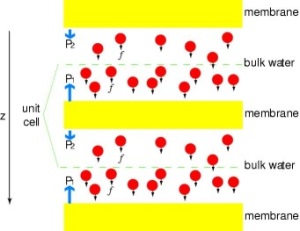
Kanalen onder druk zetten
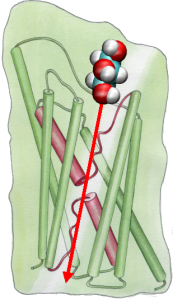
Om de resultaten van MD-simulaties direct te kunnen vergelijken met biochemische metingen van de geleidbaarheid van membraanwaterkanalen, waarbij osmotische drukgradiënten worden gebruikt om de waterstroom over het membraan te induceren, hebben we een nieuwe methodologie voor MD-simulaties ontwikkeld. Door kleine krachten uit te oefenen op watermoleculen in het bulkgebied (zie figuur), wordt een hydrostatische drukgradiënt gegenereerd over het membraan. De drukgradiënt induceert geleidingssnelheden die bestudeerd kunnen worden met MD simulaties, die gewoonlijk beperkt zijn tot enkele nanoseconden. De methode is toegepast bij de simulatie van waterpermeatie door het GlpF, en heeft geresulteerd in een lineaire correlatie tussen de uitgeoefende druk en de flux (Zhu et al., Biophys. J., 2002).
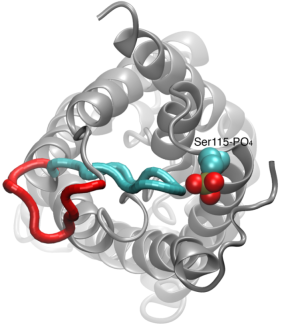
Gating of Water Channels
Waterpermeatie door aquaporines is een passief proces dat de richting van de osmotische druk over het membraan volgt. Hoewel veel aquaporines functioneren als altijd open kanalen, heeft een subgroep van aquaporines, vooral in planten, een verfijnd moleculair mechanisme ontwikkeld waardoor het kanaal kan worden gesloten als reactie op zware milieuomstandigheden, waaronder uitwisseling van water schadelijk kan zijn voor het organisme. Voorbeelden van dergelijke omstandigheden zijn droogtestress en overstroming, die bepaalde cellulaire signalen (defosforylering en verandering van pH) teweegbrengen die leiden tot sluiting van het kanaal. Een recent opgeloste structuur van een aquaporine uit spinazie werd gesimuleerd onder verschillende condities om het moleculaire mechansim van gating in deze membraankanalen te onderzoeken. Het bleek dat een langgerekte cytoplasmatische lus in gating-competente aquaporines de ingang van de waterporie in het gesloten kanaal fysiek afsluit en de toegang van watermoleculen tot de porie blokkeert. Verplaatsing van deze lus in reactie op fosforylering, zoals waargenomen in simulaties, verwijdert de lus van de cytoplasmatische ingang van de porie. Bovendien zal een hydrofoob aminozuur dat conformationeel nauw gekoppeld is aan deze lus, teruggetrokken worden uit het kanaal als gevolg van de verplaatsing van de lus. Samen resulteren deze moleculaire gebeurtenissen in een open kanaal dat doorlaatbaar is voor watermoleculen. De studie verscheen in Nature2006.

Gating and Ion Conductivity of the Tetrameric Pore
AQPs staan over het algemeen bekend om hun hoge permeabiliteit voor water. Hun betrokkenheid bij andere cellulaire functies, waaronder permeatie van kleine moleculen anders dan water, evenals cel-cel communicatie is echter gesuggereerd. Tetramerisatie is een gemeenschappelijk structureel kenmerk van AQPs. Het feit dat de vier monomeren elk een functioneel onafhankelijke waterporie vormen, maar voor hun functie een tetramerische organisatie nodig hebben, suggereert een synergetisch voordeel van oligomerisatie, en dwingt dus tot verdere analyse van de potentiële rol van de centrale porie in AQPs. Een interessante stelling is de mogelijke betrokkenheid van de centrale porie bij de ionengeleiding bij cGMP activering. Met behulp van MD simulaties van membraan-ingebedde modellen van AQP1, hebben wij deze eigenschap van AQP1 onderzocht, om te bepalen hoe, en onder welkeconformationele en hydratatiecondities, de centrale porie zou kunnen geleiden en hoe de geleiding wordt gereguleerd. Eén van de cytoplasmatische lussen, namelijk de argininerijke lus D, zou volgens onze simulaties een sleutelrol spelen in cGMP-gemedieerde activering van de centrale porie. De gesuggereerde rol van lus D werd experimenteel geverifieerd door een ontworpen mutant van lus D die een volledig verlies van ion-geleidbaarheid vertoonde ( Yu et al.,Structure, 2006 ) .
Gasmoleculen pendelen naar de cel
Elke ochtend rijden veel mensen naar hun werk, terwijl anderen fietsen, de bus nemen of de metro nemen.Op dezelfde manier bereiken verschillende biomoleculen in het menselijk lichaam hun bestemming op verschillende manieren. Om bijvoorbeeld het celmembraan te passeren diffunderen kleine hydrofobe gasmoleculen door de lipidebilaag, terwijl watermoleculen door aquaporines (AQP’s) passeren.Interessant is dat, net zoals men zowel met de bus als met de auto naar het werk kan komen, men onlangs heeft ontdekt dat sommige gasmoleculen meer dan één manier hebben om het membraan te passeren, d.w.z, Met behulp van moleculaire dynamica, uitgevoerd met NAMD, hebben wij de gasdoorlaatbaarheid van AQP1 onderzocht met twee complementaire methoden (expliciete gasdiffusiesimulatie en impliciete ligandampling). De simulatieresultaten suggereren dat terwijl de viermonomere poriën van AQP1 functioneren als waterkanalen, de centrale porie van AQP1 kan dienen als een route voor gasmoleculen om het membraan te doorkruisen (Wang et al., Journal of Structural Biology, 2007 ).
Moleculaire hindernisbaan
Biologische cellen beschermen hun inwendige door hun celmembranen, maar zijn toch afhankelijk van de import van voedingsstoffen. Zij hebben voor deze invoer snelle geleidingskanalen geëvolueerd die betrouwbare controleposten bevatten die gewenste en ongewenste verbindingen van elkaar onderscheiden. Een controlepost vormt een ware hindernisbaan die alleen de juiste verbindingen snel kunnen passeren. Inzicht in het kanaalontwerp is moeilijk wegens gebrek aan gedetailleerde experimentele gegevens over de dynamica van de voedingsstoffen. Momenteel komt de meest gedetailleerde informatie van het computationeel bekijken van de kanaaldynamica, uitgaande van statische kristallografische structuren. In een recente studie werd onderzocht hoe glycerolen, kleine voedingsmoleculen die sommige bacteriën nodig hebben, controlepunten passeren die worden gerealiseerd via glycerolkanaal GlpF. GlpF levert vier parallelle kanalen die computationeel werden gecontroleerd met behulp van NAMD en een nieuw algoritme dat de kanaalenergetica snel genoeg verkent om methodologisch haalbaar te zijn op de computers van vandaag. De resultaten laten zien hoe de fysische eigenschappen van glycerol, hun vermogen om zogenaamde waterstofbruggen te vormen, hun elektrische dipoolmomenten, hun diffusieve mobiliteit en hun intrinsieke flexibiliteit langs het kanaal worden gesondeerd (Henin et al, Biophysical Journal, in press ).
Ons Aquaporine Onderzoek in het Nieuws
|
Aquaporin Team
|
Publicaties
-.//W3C//DTD XHTML 1.0 Transitional//EN” “http://www.w3.org/TR/xhtml1/DTD/xhtml1-transitional.dtd”>Publications Database Diffusie van glycerol door Escherichia coli aquaglyceroporine GlpF.Jerome Henin, Emad Tajkhorshid, Klaus Schulten, and Christophe Chipot. Biophysical Journal, 94:832-839, 2008. Exploring gas permeabiliteit van cellulaire membranen en membraankanalen met moleculaire dynamica.Yi Wang, Jordi Cohen, Walter F. Boron, Klaus Schulten, and Emad Tajkhorshid. Tijdschrift voor Structurele Biologie, 157:534-544, 2007. Mechanism of gating and ion conductivity of a possible tetrameric pore in Aquaporin-1.Jin Yu, Andrea J. Yool, Klaus Schulten, and Emad Tajkhorshid. Structure, 14:1411-1423, 2006. Structurele mechanisme van plant aquaporin gating.S. Törnroth-Horsefield, Y. Wang, K. Hedfalk, U. Johanson, M. Karlsson, E. Tajkhorshid, R. Neutze, en P. Kjellbom. Nature, 439:688-694, 2006. Wat maakt een aquaporine een glycerol kanaal: Een vergelijkende studie van AqpZ en GlpF.Yi Wang, Klaus Schulten, and Emad Tajkhorshid. Structure, 13:1107-1118, 2005. Kinetische theorie en simulatie van watertransport via één kanaal. Emad Tajkhorshid, Fangqiang Zhu, and Klaus Schulten. In S. Yip, editor, Handbook of Materials Modeling, Vol. I: Methods and Models, pp. 1797-1822. Springer, Nederland, 2005. Naar een beter begrip van membraankanalen. Emad Tajkhorshid, Jordi Cohen, Aleksij Aksimentiev, Marcos Sotomayor, en Klaus Schulten. In Boris Martinac and Andrzej Kubalski, editors, Bacterial ion channels and their eukaryotic homologues, pp. 153-190. ASM Press, Washington, DC, 2005. Collectief diffusiemodel voor waterpermeatie door microscopische kanalen. Fangqiang Zhu, Emad Tajkhorshid, and Klaus Schulten. Physical Review Letters, 93:224501, 2004. (4 pagina’s). Computationele studies van membraankanalen. Benoit Roux en Klaus Schulten. Structure, 12:1343-1351, 2004.