Het chemische element waterstof wordt geclassificeerd als een niet-metaal. Het kan metaal worden bij zeer hoge druk. Het werd in 1766 ontdekt door Henry Cavendish.

Gegevenszone
| Classificatie | Waterstof is een niet-metaal. Het kan bij zeer hoge druk metallisch worden. |
| Kleur | kleurloos |
| Atomisch gewicht | 1.0079 |
| Staat | gas |
| Smeltpunt | -259,14 oC, 14,01 K |
| kookpunt | -252,87 oC, 20.28 K |
| Elektronen: | 1 |
| Protonen: | 1 |
| Neutronen in meest voorkomende isotoop: | 0 |
| Elektronenschillen | 1 |
| Elektronenconfiguratie | 1s1 |
| Dichtheid bij 20oC | 0.0000899 g/cm3 |
Toon meer, o.a.: Warmte, Energie, Oxidatie,
Reacties, Verbindingen, Stralen, Geleidbaarheden
| Atomair volume | 14.4 cm3/mol |
| Structuur | hcp: hexagonaal dicht opeen gepakt (als vaste stof bij lage temperaturen) |
| Hardheid | – |
| Specifieke warmtecapaciteit | 14.304 J g-1 K-1 |
| Smeltingswarmte | 0,117 kJ mol-1 van H2 |
| Verstuivingswarmte | 218 kJ mol-1 |
| Verstuivingswarmte | 0.904 kJ mol-1 van H2 |
| 1ste ionisatie-energie | 1312 kJ mol-1 |
| 2de ionisatie-energie | kJ mol-1 |
| 3de ionisatie-energie | 11815.0 kJ mol-1 |
| Elektronenaffiniteit | 72.7711 kJ mol-1 |
| Minimum oxidatiegetal | -1 |
| Min. gewone oxidatienr. | -1 |
| Maximum oxidatiegetal | 1 |
| Max. gewone oxidatiegetal | 1 |
| Max. gewone oxidatiegetal | 1 |
| 1 | |
| Elektronegativiteit (Pauling Schaal) | 2.18 |
| Polariseerbaarheidsvolume | 0.7 Å3 |
| Reactie met lucht | krachtig, ⇒ H2O |
| Reactie met 15 M HNO3 | geen |
| Reactie met 6 M HCl | geen |
| Reactie met 6 M NaOH | geen |
| Oxide(s) | H2O |
| Hydride(s) | H2 |
| Chloride(s) | HCl |
| Atomaire straal | 25 pm |
| Ionische straal (1+ ion) | – – H2O |
| Ionische straal (1+ ion) | – H2O |
| Ionstraal (2+ ion) | – |
| Ionstraal (3+ ion) | – |
| Ionstraal (1- ion) | – |
| Ionstraal (2-ion) | – |
| Ionstraal (3-ion) | – |
| Warmtegeleidingscoëfficiënt | 0.1805 W m-1 K-1 |
| Elektrisch geleidingsvermogen | – |
| Vries-/Smeltpunt: | -259,14 oC, 14,01 K |

Nasa-beeld: Enorme hoeveelheden waterstof in afgelegen sterrenstelsels.

Theophrastus Paracelsus – De eerste persoon die waterstof genereerde: “Lucht ontstaat en breekt uit als een wind.”
Ontdekking van Waterstof
Een favoriet scheikunde-experiment op school is het toevoegen van een metaal, zoals magnesium, aan een zuur. Het metaal reageert met het zuur, vormt een zout en laat waterstof uit het zuur vrijkomen. Het waterstofgas borrelt op uit de vloeistof en de leerlingen verzamelen het in kleine hoeveelheden voor verdere experimenten, zoals de ‘pop-test.’
Het eerste geregistreerde geval van waterstof gemaakt door menselijk toedoen was in de eerste helft van de jaren 1500, volgens een methode die vergelijkbaar is met die welke nu op scholen wordt gebruikt.Theophrastus Paracelsus, een arts, loste ijzer op in zwavelzuur en observeerde het vrijkomen van een gas. Hij zou over het experiment gezegd hebben: “Lucht ontstaat en breekt uit als een wind.” Hij ontdekte echter geen van de eigenschappen van waterstof.(1)
Turquet De Mayerne herhaalde Paracelsus’ experiment in 1650 en ontdekte dat het gas ontvlambaar was.(2) Noch Paracelsus noch De Mayerne stelden voor dat waterstof een nieuw element kon zijn. Paracelsus geloofde inderdaad dat er slechts drie elementen waren – de tria prima – zout, zwavel en kwik – en dat alle andere stoffen gemaakt waren van verschillende combinaties van deze drie. (3) (De chemie had nog een lange weg te gaan!)
In 1670 voegde de Engelse wetenschapper Robert Boyle ijzer toe aan zwavelzuur. Hij toonde aan dat het resulterende (waterstof)gas alleen brandde als er lucht aanwezig was en dat een fractie van de lucht (we zouden het nu zuurstof noemen) werd verbruikt door de verbranding.(4)
Waterstof werd voor het eerst erkend als een afzonderlijk element in 1766 door de Engelse wetenschapper Henry Cavendish, toen hij het bereidde door zoutzuur te laten reageren met zink. Hij beschreef waterstof als “ontvlambare lucht uit metalen” en stelde vast dat het dezelfde stof was (door zijn reacties en zijn dichtheid), ongeacht welk metaal en welk zuur hij gebruikte om het te produceren.(1) Cavendish merkte ook op dat wanneer de stof werd verbrand, het water produceerde.
De Franse wetenschapper Antoine Lavoisier gaf het element later de naam waterstof (1783). De naam komt van het Griekse ‘hydro’ dat water betekent en ‘genes’ dat vorming betekent – waterstof is een van de twee watervormende elementen.
In 1806, met waterstof als element goed ingeburgerd, duwde de Engelse scheikundige Humphry Davy een sterke elektrische stroom door gezuiverd water.
Hij ontdekte dat waterstof en zuurstof werden gevormd. Het experiment toonde aan dat elektriciteit stoffen uit elkaar kon trekken tot hun samenstellende elementen. Davy realiseerde zich dat stoffen door een elektrisch verschijnsel met elkaar verbonden waren; hij had de ware aard van chemische binding ontdekt.(5)
Bezoek de pagina met coole waterstoffeiten van Chemicool.

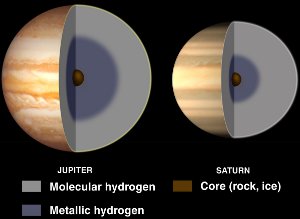
Interieurs van Jupiter en Saturnus, met vloeibare metaalwaterstof. Met dank aan NASA/JPL-Caltech.

Nasa: De externe brandstoftank (oranje) van de Space Shuttle gevuld met vloeibare waterstof en zuurstof.

Wagens met waterstof stoten water uit in plaats van verontreinigende stoffen.

Laboratoriumelektrolyse van water. Elektrische energie wordt gebruikt om water te splitsen. Waterstof verzamelt zich in de ene reageerbuis, zuurstof in de andere.
Opzicht en kenmerken
Schadelijke effecten:
Waterstof is zeer ontvlambaar en heeft een bijna onzichtbare vlam, die tot toevallige brandwonden kan leiden.
Eigenschappen:
Waterstof is het eenvoudigste element van allemaal, en het lichtste. Het is ook verreweg het meest voorkomende element in het heelal. Meer dan 90 procent van de atomen in het heelal bestaat uit waterstof.
In zijn meest voorkomende vorm bestaat het waterstofatoom uit één proton, één elektron, en geen neutronen. Waterstof is het enige element dat zonder neutronen kan bestaan.
Waterstof is een kleurloos, reukloos gas dat bij standaardtemperatuur en -druk bestaat als diatomische moleculen, H2.
Het brandt en vormt explosieve mengsels in lucht en het reageert heftig met oxidanten.
Op aarde bevindt waterstof zich voornamelijk in water, H2O. Er is weinig vrije waterstof op aarde omdat waterstof zo licht is dat het niet door de zwaartekracht van de planeet wordt vastgehouden. Alle waterstof die zich vormt, ontsnapt uiteindelijk uit de atmosfeer in de ruimte.
Hoewel waterstof gewoonlijk een niet-metaal is, wordt het een vloeibaar metaal wanneer er enorme druk op wordt uitgeoefend.
Zulke druk wordt gevonden binnen gasreuzenplaneten zoals Jupiter en Saturnus. Het hoge magnetische veld van Jupiter (14 maal dat van de aarde) wordt vermoedelijk veroorzaakt door een dynamo-effect als gevolg van elektrisch geleidende metallische waterstof die circuleert als de planeet draait.
Toepassingen van waterstof
Grote hoeveelheden waterstof worden gebruikt in het Haber-proces (productie van ammoniak), hydrogenering van vetten en oliën, methanolproductie, hydrocracking, en hydrodesulfurisering. Waterstof wordt ook gebruikt bij de raffinage van metalen.
Vloeibare waterstof wordt gebruikt als raketbrandstof, bijvoorbeeld om de Space Shuttle op te tillen en in een baan om de aarde te brengen. Vloeibare waterstof en zuurstof worden bewaard in de grote, externe brandstoftank van de Shuttle. (Zie afbeelding links.)
De twee zwaardere isotopen van waterstof (deuterium en tritium) worden gebruikt bij kernfusie.
De waterstofeconomie is voorgesteld als vervanging voor onze huidige op koolwaterstof (olie, gas en kolen) gebaseerde economie.
De basis van de waterstofeconomie is dat energie wordt geproduceerd wanneer waterstof met zuurstof verbrandt en het enige bijproduct van de reactie water is.
Op dit moment wordt de waterstof voor auto’s op waterstof echter geproduceerd uit koolwaterstoffen. Pas wanneer bijvoorbeeld zonne- of windenergie commercieel kan worden gebruikt om water in waterstof en zuurstof te splitsen, zal een echte waterstofeconomie mogelijk zijn.
Bepaling en isotopen
Bepaling aardkorst: 1400 gewichtsdelen per miljoen (0,14%), 2,9% naar mol
Bepaling zonnestelsel: 75% naar gewicht, 93% naar mol
Kosten, zuiver: $12 per 100g
Kosten, bulk: $ per 100g
Bron: Waterstof wordt commercieel bereid door oververhitte stoom te laten reageren met methaan of koolstof. In het laboratorium kan waterstof worden geproduceerd door de inwerking van zuren op metalen zoals zink of magnesium, of door de elektrolyse van water (links afgebeeld).
Isotopen: Waterstof heeft drie isotopen, 1H (protium), 2H (deuterium) en 3H (tritium). De twee zwaardere isotopen (deuterium en tritium) worden gebruikt voor kernfusie. Protium is de meest overvloedige isotoop, tritium de minst overvloedige. Tritium is onstabiel met een halveringstijd van ongeveer 12 jaar en 4 maanden. In de natuur voorkomende waterstof is een mengsel van de twee isotopen 1H en 2H met natuurlijke abundanties van respectievelijk 99,99% en 0,01%.

- Peter Hoffmann, Tomorrow’s Energy: Hydrogen, Fuel Cells, and the Prospects for a Cleaner Planet., (2001) p22. MIT Press, Cambridge, MA.
- P. Litherland Teed, The Chemistry and Manufacture of Hydrogen., (2008) p2. Dabney Press.
- John S. Davidson, Annotations to Boyle’s “The Sceptical Chymist”.
- Andreas Züttel, Andreas Borgschulte, Louis Schlapbach, Hydrogen as a future energy carrier., (2008) p8. Wiley-VCH, Weinheim.
- Kendall Haven, 100 Greatest Science Discoveries of All Time., (2007) p62. Libraries Unlimited.
Cite this Page
Voor online linken, kopieer en plak een van de volgende:
<a href="https://www.chemicool.com/elements/hydrogen.html">Hydrogen</a>
of
<a href="https://www.chemicool.com/elements/hydrogen.html">Hydrogen Element Facts</a>
Voor het citeren van deze pagina in een academisch document, gebruik dan de volgende MLA-conforme citatie:
"Hydrogen." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/hydrogen.html>.