Dit zijn aantekeningen uit college 4 van de cursus celbiologie van Harvard Extension.
De secretorische route verwijst naar het endoplasmatisch reticulum, het Golgi-apparaat en de blaasjes die daartussen liggen, evenals het celmembraan en de lysosomen. Hij wordt “secretorisch” genoemd omdat het de weg is waarlangs de cel eiwitten uitscheidt naar het extracellulaire milieu. Maar zoals gewoonlijk vertelt etymologie slechts een fractie van het verhaal. Deze route verwerkt ook eiwitten die aan het membraan gebonden zijn (hetzij in het celmembraan, hetzij in de ER of Golgi-membranen zelf), evenals lysosomale enzymen, en ook alle eiwitten die hun leven in de secretorische route zelf zullen slijten. Het doet ook enkele andere dingen dan eiwitten verwerken.
De cytosol en de ‘lumen’ (de vloeistof die de secretorische route vult) zijn verschillende chemische milieus, en zij mengen zich normaliter nooit. Het cytosol is reductief (als je in het cytosol bent, ontmoet je steeds moleculen die je elektronen willen aanbieden), en de ER, Golgi en extracellulaire omgeving zijn oxidatief (moleculen komen steeds naar je toe en vragen om elektronen). Zie redox als je nog steeds in de war bent. Dit zorgt voor verschillende eiwitvouwingscondities: zo worden disulfidebindingen gewoonlijk alleen gevormd in oxidatieve omstandigheden. Bovendien kunnen verschillende eiwitten alleen in de secretorische route of alleen in het cytosol voorkomen. De secretorische route biedt de cel een route om dingen te verwerken die misschien niet goed zijn om in het cytoplasma te hebben, en/of het nuttigst zijn wanneer ze geconcentreerd worden gehouden in een gespecialiseerd compartiment met hun gewenste interacterende partners. Hepatocyten (in de lever) sekwestreren drugs en toxines in de gladde ER en breken ze daar af voor uitscheiding uit het lichaam. De secretorische route is niet aaneengesloten, maar elke beweging tussen zijn componenten vindt plaats in kleine bubbelachtige microkosmossen van zijn eigen chemische wereld, die vesikels worden genoemd.
Veel eiwitten die door de secretorische route gaan, raken nooit het cytosol aan – behalve de delen van membraaneiwitten die aan de cytosolische kant uitsteken. Velen van hen hebben chaperonnes nodig om te helpen vouwen, en/of een hele reeks post-translationele modificaties om klaar te zijn voor hun eigen functie, en de secretorische route is gespecialiseerd in het leveren van dat alles.
De lezing van vandaag zal zich richten op hoe eiwitten worden vertaald in de ER en hoe ze reizen (in blaasjes) tussen de ER, Golgi en andere bestemmingen. Dit wordt prachtig in beeld gebracht in de video Life of the Cell:
Het endoplasmatisch reticulum is de eerste stap in de secretorische route. Het membraan ervan is ononderbroken met het buitenste kernmembraan, maar het is niet duidelijk waarom dat van belang is, omdat eiwitten hun leven niet in de kern beginnen. In plaats daarvan zwerven mRNA’s rond in het cytoplasma totdat ze worden opgepikt door een ribosoom dat geïnteresseerd is in de vertaling ervan. Bij ‘posttranslationele translocatie’ wordt het nieuwe eiwit naar de ER verplaatst nadat het is vertaald. In het interessantere fenomeen dat ‘cotranslationele translocatie’ wordt genoemd, begint het ribosoom net als elk ander eiwit aan de translatie, maar ergens in de eerste 16 tot 30 aminozuren stuit het op een signaalpeptide (ook wel signaalsequentie genoemd). Het motief van dat signaal is vaak 1 positief geladen aminozuur gevolgd door 6-12 hydrofobe aminozuren. Dit motief wordt herkend door het signaalherkenningsdeeltje (SRP, een ‘ribonucleoproteïne’ of hybride RNA/eiwitmolecuul) dat zich eraan bindt en voorkomt dat het ribosoom de translatie voortzet. De translatie wordt gestopt totdat het ribosoom/SRP-complex een SRP-receptor op het ER-membraan tegenkomt. Wanneer zij elkaar ontmoeten, binden SRP en zijn receptor elk een GTP-molecuul in het ER-membraan, waardoor hun interactie blijkbaar wordt versterkt. Het toeval wil dat dit alles gebeurt in de nabijheid van een Sec61 translocon – een eiwitcomplex dat een kanaal vormt dat het ER membraan doorkruist. De translocon is eigenlijk een complex van drie verschillende eiwitten (genen: SEC61A1 of SEC61A2, SEC61B, SEC61G), waarvan de Sec61a subeenheid 10 membraan-overspannende a-helixen heeft die het kanaal vormen. Zodra het ribosoom aan het membraan is gekoppeld, zet het de translatie voort, waarbij het signaalpeptide en uiteindelijk het hele eiwit door het kanaal in het ER lumen worden geduwd. Wanneer de translatie stopt, hydrolizeren SRP en SRP receptor hun GTP om elkaar en de ribosoom lading te bevrijden (dit moet de energie van GTP vereisen, omdat de oorspronkelijke binding bergafwaarts was), een signaal peptidase klieft het signaal peptide van het ontluikende eiwit, en het eiwit is vrij om te beginnen met vouwen in de ER.
Er zijn nog een paar andere spelers betrokken bij sommige ER eiwitten. Oligosaccharide transferase, dat glycosylgroepen toevoegt aan asparagines in het ontluikende eiwit, maakt deel uit van het transloconcomplex en het voert de glycosylering uit terwijl het nieuwe eiwit nog wordt vertaald. Dus hoewel we glycosylering een “post-translationele modificatie” noemen, wordt het in dit geval eigenlijk tijdens de translatie uitgevoerd. Om de juiste structuur te krijgen, moeten sommige eiwitten volledig vertaald zijn voordat ze mogen beginnen met vouwen – als het N-terminale gedeelte zou mogen beginnen met vouwen zodra het in de lumen komt, zou het uiteindelijk de verkeerde algemene structuur krijgen. Om dit te voorkomen bindt BiP, de chaperon, soms het eiwit om het nog een tijdje ongevouwen te houden. Stel je BiP voor als een andere Pac-Man die op het eiwit bijt om het lineair te houden, zoals Hsc70 in het mitochondriale targeting proces (zie vorige week).
Hiervan is een video:
De eerste paar minuten laten het hierboven beschreven basisscenario zien. Dan gaat het over naar een complexer scenario dat ik in een minuut zal introduceren. FYI, de video toont twee ‘controversiële’ dingen die niet in de bovenstaande beschrijving zijn opgenomen: (1) het signaalpeptide dat in het membraan wordt afgebroken, en (2) een ‘plug-eiwit’ dat het kanaal voor/na translatie ophoudt. Over deze twee dingen zijn nog niet alle wetenschappers het eens.
Alle eiwitten waarvan we weten dat ze door de secretorische route gaan, werden daar aangetroffen door mensen die lokalisatie-experimenten uitvoerden om te zien waar in de cel een eiwit zich bevindt. Een vreemd feit over het ER is dat je de cel in een blender kunt stoppen en dat het ER zich daarna gewoon weer aan zichzelf gaat vasthechten en kleine ‘microsomen’ vormt die niet aan de kern vastzitten maar aaneengesloten bellen ER vormen. Je kunt dan gaan spelen met proteasen – die eiwitten afbreken – en detergenten – die het ER membraan oplossen. Aangenomen dat het eiwit van je interesse vertaald is, kun je nagaan of het (1) protease behandeling overleeft, maar (2) protease + detergent behandeling niet overleeft, dan is het een secretorisch pathway eiwit. De logica is dat in geval (1) het beschermd was in de ER, maar in geval (2) heb je de ER opgelost, dus werd het opgegeten door de protease. Dit alles veronderstelt dat je een antilichaam hebt of een andere manier om te detecteren of het eiwit van interesse er is na deze behandelingen.
Mensen gebruikten dergelijke technieken ook om uit te vinden dat slechts 70 aminozuren van een nieuw eiwit kunnen worden vertaald voordat het te laat is voor dat eiwit om in het ER terecht te komen. Vergeet niet dat het signaalpeptide zich in de eerste 16-30 aminozuren bevindt, en dat translocatie naar de ER afhankelijk is van de aanwezigheid van SRP. Ribosomen vertalen met een voorspelbare snelheid, dus men liet ribosomen beginnen met het vertalen van wat mRNA en wachtte vervolgens bepaalde hoeveelheden tijd alvorens SRP toe te voegen, om te zien hoeveel vertaling kon plaatsvinden voordat SRP niet langer zijn werk kon doen.
De SRP-receptor en de Sec61-eiwitten zijn ER-membraaneiwitten – en er zijn nog vele andere ER-membraan, Golgi-membraan en lysosoom-membraaneiwitten ook. In feite worden zelfs de membraaneiwitten (zie klasse 02) van het celmembraan in de secretorische route verwerkt. Veel van deze eiwitten hebben enkele of tientallen transmembraandomeinen (20-25 hydrofobe aminozuren elk) die in de juiste volgorde en richting moeten worden ingebracht (je wilt bijvoorbeeld echt dat je ionenkanalen en transporters in de juiste richting wijzen, de cel in versus de cel uit). Daarom zijn er een heleboel ingewikkelde biologische mechanismen om deze eiwitten op de juiste manier in het membraan in te brengen. Dit is wat de tweede helft van de bovenstaande video laat zien.
Dus hier is een tautologie: sommige eiwitten hebben een topogene sequentie die hun oriëntatie in het membraan bepaalt. Deze sequentie bestaat uit twee soorten signaalsequenties:
- een stop-transfer sequentie (om de een of andere reden afgekort tot STA) is een 22-25 hydrofobe aminozuursequentie ergens in het midden van het eiwit dat een alfa-helix vormt. Wanneer deze sequentie wordt aangetroffen, wordt hij in het membraan geschoven, waarna de vertaling van de rest van het eiwit in het cytosol wordt voortgezet. Dit maakt dus als het ware de translocatie naar de ER ongedaan, die was gestart door de signaalpeptide aan het begin (N terminus) van het eiwit.
- een signaalanker-sequentie (afgekort SA) is ook een 22-25aa hydrofobe alfa-helix, maar met een reeks van ~3 positief geladen aminozuren aan de linker- of rechterkant. Net als het signaalpeptide wordt dit herkend door SRP, dat het ribosoom naar de ER brengt. Maar in tegenstelling tot het signaalpeptide wordt deze alfa-helische sequentie in het ER-membraan ingebracht. De richting van inbrengen wordt bepaald door de 3 positief geladen aminozuren. De positieve ladingen moeten altijd aan de cytosolzijde eindigen, dus als zij na (d.w.z. C-terminaal van) de hydrofobe sequentie komen, eindigt het eiwit met zijn C-eindpunt naar het cytosol gericht, maar als zij voor (d.w.z. N-terminaal van) de hydrofobe sequentie komen, eindigt het eiwit met zijn N-eindpunt naar het cytosol gericht.
Met deze twee signalen als bouwstenen, kun je je een eiwit voorstellen met een reeks van stop-overdracht en signaalanker-sequenties om een hele reeks heen en weer gaande transmembraandomeinen te creëren die als door een naaimachine in het membraan zijn genaaid. Men heeft de membraaneiwitten in vijf categorieën ingedeeld:
- Type I heeft alleen een signaalpeptide en dan een stop-overdracht in het midden. Daarom eindigt het met zijn (hydrofiele) N-uiteinde in het lumen, zijn (hydrofobe) midden in het membraan en zijn (hydrofiele) C-uiteinde in het cytosol.
- Type II begint niet met een signaalpeptide. Het begint als elk ander eiwit, maar in het midden heeft het een signaalanker-sequentie met de +++ aminozuren eerst en de hydrofobe reeks daarna. Hierdoor wordt het eiwit halverwege de translatie verplaatst, waarbij het al vertaalde N-terminale deel in het cytosol uitsteekt (omdat de +++ cytosolisch moeten blijven) en het nu-beginnende-te-vertalen C-terminale deel direct in de ER wordt vertaald. Dus het eindigt transmembraan met de C-eindpunt in de ER en de N-eindpunt in het cytosol – tegenovergesteld aan Type I.
- Type III is als Type II – geen signaalpeptide, alleen een signaalanker in het midden, maar in dit geval komen de +++ na de hydrofobe sequentie, die de oriëntatie omkeert. Dus eindigt het met zijn N terminus in de ER en zijn C terminus in het cytosol. Tegenovergesteld aan Type II en uiteindelijk hetzelfde als Type I, hoewel het daar op een andere manier is gekomen – het heeft geen signaalpeptide dat in de ER wordt afgesplitst.
- Type IV of ‘multipass’ eiwitten hebben een afwisselende reeks signaal- en stop-transfer-sequenties. Dit zijn duidelijk meer dan één ’type’, maar ze zijn lang niet zo divers als uw combinatorische verbeelding zou toestaan. De oriëntatie van de eerste signaalsequentie bepaalt of de N terminus in het cytosol of in de ER terechtkomt, en het totale aantal stop-transfer + signaalanker-sequenties bepaalt waar de C terminus terechtkomt: een even aantal = zelfde kant als N terminus, oneven aantal = tegenovergestelde kant als N terminus. De STA- en SA-sequenties moeten elkaar strikt afwisselen, met de uitzondering dat je met twee signaalanker-sequenties kunt beginnen als de eerste met de N-terminus in het cytosol is georiënteerd. Om de spot te drijven met dit categoriseringsschema, heeft men enkele onvolledig gedefinieerde subtypen van Type IV gedefinieerd, waarbij Type IVa N-terminaal in het cytosol is (en dus begint als een Type II eiwit) en Type IVb N-terminaal in het lumen is (het begint als een Type III eiwit, maar heeft dan nog een SA-sequentie die het terugbrengt in het ER). GLUT1 van klasse 02 is een Type IVa.
- GPI-geankerde eiwitten, die het vijfde type vormen maar niet Type V worden genoemd, beginnen met een signaalpeptide en eindigen met een hydrofoob C-terminus dat in het membraan ingebed blijft. Dat hydrofobe uiteinde wordt afgesplitst en vervangen door GPI, dat ook in het membraan ingebed blijft. PrP is er zo een – later meer daarover.
We hebben nu besproken hoe eiwitten in het ER lumen terecht kunnen komen of het ER membraan kunnen omspannen. De meeste eiwitten verlaten het ER binnen enkele minuten, getransporteerd in blaasjes die naar de Golgi gaan en dan later voor uitscheiding, lysosomen of het celmembraan. Die voorwaartse reisrichting wordt anterograde genoemd; teruggaan van Golgi naar ER is retrograde transport.
Twee soorten transport vinden plaats in membraangebonden blaasjes. Deze komen los van het membraan van de plaats waar ze vandaan komen, en versmelten later met het membraan van de plaats waar ze naar toe gaan – prachtig uitgebeeld op ~2:25 in de video Life of the Cell hierboven. Het lichaam waaruit de blaasjes ontstaan is het ‘donorcompartiment’, en de bestemming waar ze later samensmelten is het ‘acceptorcompartiment’.
Het ontluikende proces vereist dat G-eiwitten in het membraan Coat-eiwitten rekruteren. Specifiek voor anterograde transport rekruteert G-eiwit Sar1 (gen: SAR1A) COPII (‘cop two’); voor retrograde transport rekruteert een ARF G-eiwit COPI (uitgesproken als ‘cop one’). Deze G-eiwitten worden geactiveerd om dit werk te doen wanneer GEF ze laadt met GTP, waarbij GDP wordt verwisseld.
Dus de stappen in anterograde transport, bijvoorbeeld, zijn als volgt:
- Sec12-GEF (Sec staat voor secretory) laadt Sar1 met GTP. Wanneer gebonden aan GDP, zweeft Sar1 gewoon rond in het donor compartiment, maar wanneer gebonden aan GTP, ondergaat het een conformatie verandering die ervoor zorgt dat zijn anders gebrande N-terminale hydrofobe staart uitsteekt, waardoor het in het membraan steekt, waar COPII-eiwitten zich dan beginnen op te hopen omdat ze die staart erg leuk vinden.
- De COPII’s beginnen te polymeriseren en hebben, vanwege zijn conformatie, een intrinsieke voorkeur voor kromming, zodat hun opeenhoping het ontluiken in gang zet. Tegelijkertijd worden membraangebonden eiwitten die getransporteerd moeten worden – geïdentificeerd door een DXE (d.w.z. aspartaat-anything-glutamaat) aminozuursequentie die een bindingsplaats vormt in hun cytosolische deel – gerekruteerd naar het nieuw gevormde blaasje. Membraan-gebonden eiwitten fungeren als receptoren, die lumenale eiwitten die voor de Golgi gebonden zijn, rekruteren om in de holle ruimte rond te hangen waar zij in het blaasje terecht zullen komen zodra het zich vormt.
- Als er genoeg COPII zijn gearriveerd, komt het blaasje los, op welk punt Sar1 zijn GTP hydrolyseert, waardoor het de energie krijgt om zijn hydrofobe staart terug in zichzelf te zuigen, en de COPII’s los te snijden. Het deeltje is nu losgekoppeld van het donorcompartiment.
- Nu, om slecht verklaarbare (of slecht begrepen?) redenen, valt de mantel van COPIIs gewoon uit elkaar, waarbij receptoren onder de mantel worden blootgelegd, die het richten van het deeltje sturen. Als het deeltje op zijn bestemming aankomt, komt Rab-GTP, ingebed in het membraan van het deeltje, in wisselwerking met een Rab-effector, ingebed in het membraan van het ontvangende compartiment. Er wordt een zijdelingse blik gewisseld, de belangstelling is gewekt. Spoedig zal het vesikel samensmelten met het membraan.
- SNARE-eiwitten aanwezig op zowel het vesikel- als het doelmembraan (respectievelijk V-SNARE en T-SNARE) werken samen om de membranen nog dichter bij elkaar te brengen. In dit voorbeeld beschouwen we VAMP (de VAMP_ genen) als de V-SNARE en Syntaxin (de STX__ genen) en SNAP25 (SNAP25 gen) als de T-SNAREs. Syntaxin en SNAP25 zijn beide membraaneiwitten; Syntaxin heeft 1 alfa-helix en SNAP25 heeft er 2, alle aan de cytosolische zijde. De alfa-helixen drijven de interactie met VAMP aan. De alfa-helixen van de tegenover elkaar liggende zijden hebben een extreem sterke affiniteit voor elkaar, waardoor de membranen dicht genoeg bij elkaar komen om te fuseren. Als dit eenmaal is gebeurd, zijn er twee eiwitten nodig om de V-SNARE’s en T-SNARE’s weer uit elkaar te halen: NSF (gen: NSF; staat voor NEM gevoelige factor) en alpha-SNAP (gen: NAPA), een oplosbaar NSF hechtingseiwit. NSF is een ATPase, en verbrandt ATP om de energetisch bergopwaartse ontmanteling van het complex aan te drijven.
Nu het retrograde transport. Waarom is er überhaupt retrograde transport? Hier is een niet-uitputtende lijst van enkele redenen:
- Sommige membraaneiwitten beginnen hun leven in de ER, moeten in de Golgi gemodificeerd worden, maar moeten dan weer terug naar de ER. Zij doen dit met een KKXX aminozuur sequentie.
- Er is ook een KDEL aminozuur sequentie aan de C terminus van sommige lumenale eiwitten die verondersteld wordt hen in de ER te houden, maar het is niet perfect – soms komen zij in de Golgi terecht, in welk geval zij naar de ER worden teruggebracht via retrograde transport dat afhankelijk is van die KDEL sequentie voor herkenning. Het mechanisme is wel aardig – de eiwitten die KDEL herkennen en zich eraan binden doen dat alleen bij lage pH, en de pH van de Golgi is lager dan die van de ER, dus ze binden KDEL in de Golgi, en laten het los als ze weer terug zijn in de neutralere pH van de ER.
- Ook, denk er eens over na, alle eiwitten die deelnemen aan anterograde transport – de V-SNARES, Rab, enz. – moeten terug naar de ER zodat ze het allemaal opnieuw kunnen doen, zoals hoe de bus aan het eind van de dag terug moet naar de busremise.
- Zoals we straks zullen zien, komen de Golgi in meerdere stadia die afhankelijk zijn van de toevoeging van enzymen van verder stroomafwaarts.
Het proces van retrograde transport is niet zo verschillend van anterograde. Het maakt gebruik van ARF in plaats van Sar1, COPI in plaats van COPII, maar het werkt hetzelfde: ARF geladen met GTP laat zijn hydrofobe staart in het membraan kleven, waardoor het de aandacht trekt van COPI’s. COPI heeft twee componenten, COPIalpha en COPIbeta, die beide interageren met die KKXXX-sequentie om membraan-gebonden eiwitten aan te trekken die bestemd zijn voor retrograde transport. Sommige eiwitten hebben ook een RR-sequentie (ergens in het eiwit) die hen kan markeren voor retrograde transport.
Het Golgi-apparaat is niet aaneengesloten. Het is een gestapeld geheel van afzonderlijke subcompartimenten die zakjes of cisternae worden genoemd. Verschillende compartimenten hebben verschillende eigenschappen en eiwitten bezoeken ze in een bepaalde volgorde. In volgorde van ER tot celmembraan worden de Golgi-compartimenten cis-, mediaal-, trans- en trans-Golgi-netwerk genoemd. Elk compartiment heeft verschillende enzymen die eiwitten modificeren, en de modificaties moeten in een bepaalde volgorde plaatsvinden, vandaar de noodzaak van een gestapelde reeks compartimenten.
Maar wanneer eiwitten in de Golgi rijpen, is het niet zo dat zij in blaasjes uit het ene compartiment naar het volgende gaan. Integendeel, het compartiment waarin ze zich al bevinden, beweegt naar buiten en ‘rijpt’ wanneer er nieuwe enzymen aan worden toegevoegd (van verderop in de Golgi-keten) via retrograde transport. Vreemd, toch? Het is een beetje alsof je, in plaats van van een lagere school naar een middelbare school naar een middelbare school te gaan, je hele kindertijd en adolescentie in één schoolgebouw zou blijven, en ze gewoon elk jaar nieuwe leerboeken en leraren zouden brengen om het passend te houden voor de klas die jij en je klasgenoten nu hadden bereikt. Zo zien de Golgi eruit terwijl ze bewegen en evolueren:
Er is dus (weinig of) geen anterograde transport binnen de Golgi, maar veel retrograde transport om elke nieuwe ronde enzymen binnen te brengen. Wanneer eiwitten uiteindelijk het volledige K-12 curriculum van het Golgi-netwerk hebben doorlopen, ondergaan zij wel transport om naar hun uiteindelijke bestemming te gaan. Zij komen terecht in een blaasje dat naar één van de volgende drie plaatsen gaat:
- Exocytose – versmelting met het celmembraan. De lumenale eiwitten worden dus extracellulair afgescheiden, en de membraaneiwitten worden celmembraaneiwitten.
- Afscheidende blaasjes – deze blijven gewoon als blaasjes in de cel totdat ze nodig zijn – waarbij ‘nodig’ betekent dat ze uiteindelijk wel exocytose ondergaan. In neuronen worden hier neurotransmitters opgeslagen totdat een actiepotentiaal hun secretie in de synaps vereist. In de maag bewaren de cellen die maagenzymen produceren, deze enzymen in secretoire blaasjes totdat de voedselopname hun afgifte in de maag teweegbrengt.
- Lysosomen – waar verkeerd gevouwen eiwitten naartoe gaan om te worden afgebroken.
Het transport van het trans-Golgi-netwerk naar deze bestemmingen verschilt van het andere transport dat hierboven is besproken en er is vaak clathrine (CLT__-genen) bij betrokken. De blaasjes die ontluiken hebben een mantel van twee lagen, met adapter-eiwit (AP) complexen als binnenste laag en clathrine als buitenste laag. De adapter-eiwitten hebben een doelsignaal met een YXXh-motief (h = Φ = een willekeurig hydrofoob aminozuur). Clathrine vormt de zogenaamde ‘clathrine-triskelion’-formatie die hier wordt afgebeeld:

(Afbeelding met dank aan Wikimedia Commons gebruiker Phoebus87)
Clathrine is ook verantwoordelijk voor endocytose – het afknappen van blaasjes met extracellulair spul (en celmembraaneiwitten) om de cel binnen te komen. Dit wordt clathrin-gemedieerde endocytose genoemd. Receptoren in het celmembraan worden zeer vaak geëndocytoseerd: de hele populatie van hormoonreceptoren verandert ongeveer elk uur, vooral wanneer hormonen worden binnengekregen. Het opnemen van de receptor in een blaasje is een manier voor de cel om het binnenkomende signaal af te sluiten totdat het kan worden verwerkt.
In de aantekeningen over het plasmamembraan wordt cystic fibrosis kort besproken: CFTR is een ABC-transporter die verantwoordelijk is voor het uit de cel pompen van Cl- (het laat ook Na+ binnen). Mutanten met een verlies van functie pompen geen Cl- weg, waardoor de drijvende kracht voor osmose wegvalt, het slijm dikker wordt en ademhalingsproblemen ontstaan. Er zijn ten minste 127 verschillende CFTR-mutaties met functieverlies (althans, dat is het aantal waar Natera op test) die (als beide allelen zijn uitgeschakeld) taaislijmziekte veroorzaken. De meest voorkomende mutatie is ΔF508, die ~3% van alle Europese CFTR-allelen uitmaakt en ongeveer 70% van de mutanten. Het verlies van dat ene fenylalanine verandert de conformatie van CFTR zodat de di-zuur exit code (aminozuren D565 en D567) die CFTR richt voor exocytotische blaasjes niet meer correct wordt blootgelegd en het eiwit nooit het celmembraan haalt.
discussiesectie
In de sectie lezen we Hu 2009, die aantoonde dat atlastine-eiwitten betrokken zijn bij het creëren van het tubulaire ER-netwerk. Het bewijs kwam bijna volledig van eiwit-eiwit interacties. Ik was verbaasd dat dit artikel zo belangrijk was, want er zijn miljoenen artikelen over eiwit-eiwit interacties bij de ziekte van Huntington, maar niemand gelooft ze echt allemaal en het heeft ons niet noodzakelijkerwijs dichterbij gebracht om te weten wat huntingtin doet of wat er mis gaat bij de ziekte van Huntington. Maar blijkbaar was Hu in staat om de wisselwerking tussen de atlastines en de reticulons duidelijk te maken, wat een rol in de vorming van de ER impliceert. Het helpt dat Hu in staat was om een ‘genetische interactie’ aan te tonen naast een fysieke (bindende) interactie. Een ‘genetische interactie’ (ik moest het opzoeken) betekent wanneer “Soms mutaties in twee genen een fenotype veroorzaken dat verrassend is in het licht van de individuele effecten van elke mutatie. Dit fenomeen, dat genetische interactie definieert, kan functionele relaties tussen genen en paden onthullen.”
PrP
Dit is een decennium oud, dus sommige dingen kunnen verouderd zijn, maar ik vond Harris 2003 (ft)’s overzicht van PrP celbiologie uiterst duidelijk en nuttig. Kim & Hegde 2002 was ook nuttig. PrP is een eiwit uit de secretorische route. Zijn eerste 22 aminozuren (MANLGCWMLVLFVATWSDLGLC) zijn een signaalpeptide dat cotranslationele translocatie naar de ER veroorzaakt. Normaal wordt PrP gewoon GPI gelinkt aan zijn C terminus en wordt het verankerd aan de exoplasmatische zijde van het membraan. Maar de aminozuren 111-134 (HMAGAAAAGAVVGGLGGYMLGSAM) zijn een soort zwak signaalanker-sequentie (Type II, waarbij de +++ aminozuren vóór het signaalanker komen) die soms, maar niet altijd, een transmembraandomein wordt, waardoor de C-terminus in het lumen terechtkomt. Nog verwarrender is dat die sequentie soms gewoon kan eindigen als een transmembraandomein zonder de inversie, zodat de N-terminus in het lumen ligt. Er zijn dus drie membraantopologieën van PrP: de gewone oude GPI-anker, en twee transmembraanoriëntaties, zoals afgebeeld in Harris 2003 Fig 3:
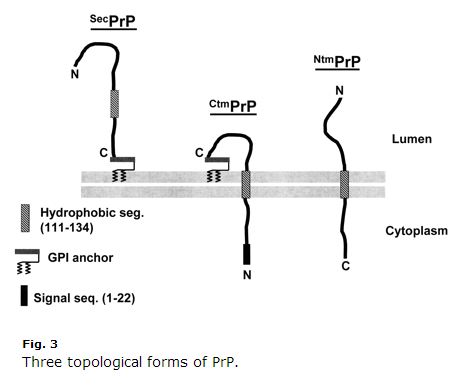
Merk op hoe vreemd CtmPrP is. Het is transmembraan en toch ook GPI-geankerd, en het N-terminale signaalpeptide wordt nooit gesplitst. Normaal zijn de transmembraanvormen < 10% van het totale PrP. In sommige laboratoriumomstandigheden is het percentage hoger, en twee van de GSS-veroorzakende mutaties (A117V en P105L) verhogen ook de fractie CtmPrP tot 20-30% van alle PrP. Van deze drie vormen zijn er veel aanwijzingen dat CtmPrP toxisch is, en dat het een rol zou kunnen spelen bij prionvorming, hoewel de meeste genetische prionziekte-mutaties (waaronder FFI D178N) de membraantopologie van PrP of de fractie van CtmPrP niet lijken te beïnvloeden.
Nadat PrP door de Golgi gaat, is het gericht op het celmembraan. Maar volgens Harris blijft het daar niet gewoon zitten – het gaat vaak door clathrin-gemedieerde endocytose en cyclust elke ~60 minuten door de cel, waarbij sommige moleculen bij elke cyclus worden gesplitst. Koper stimuleert deze endocytose van PrP. De meeste genetische prionziektemutaties veranderen de lokalisatie van PrP – gewoonlijk wordt bij een mutatie minder PrP op het celoppervlak aangetroffen, terwijl meer PrP zich in de ER ophoopt.