Meer dan 200.000 mensen hebben een transkatheter aortaklepvervanging (TAVR) ondergaan, en elk jaar krijgen ongeveer 140.000 patiënten een chirurgische bioprothetische klep.1,2 Ondanks dit toenemende aantal is de optimale postoperatieve antistollingsstrategie vaak onduidelijk. Met name twee vragen onderstrepen de moeilijkheid in de besluitvorming voor deze veel voorkomende klinische scenario’s:
- In de eerste maanden na de vervanging van de bioprothetische klep, welke complicaties proberen we te verminderen met antistolling?
- Moet antistolling aan alle patiënten worden toegediend om deze complicaties te verminderen? Of moeten we een selectievere aanpak hanteren op basis van risicofactoren?
Thrombotische risico’s na bioprothetische klepvervanging
Traditioneel gezien is de reden voor antistolling in de eerste maanden na een chirurgische klepvervanging geweest om trombotische complicaties te beperken, die vermoedelijk verband houden met hechtmateriaal en een naairing die nog niet bedekt is met biofilm en geendothelialiseerd is.3,4 De mogelijke daaropvolgende trombotische complicaties zijn drieledig: trombo-embolische voorvallen, openlijke trombose van de klep, en subklinische georganiseerde trombus die de klepfunctie op lange termijn kan schaden. Ondanks de frequentie van vervanging van bioprothetische kleppen zijn de gegevens over deze complicaties beperkt, deels omdat deze voorvallen schijnbaar niet vaak voorkomen.
Een recente meta-analyse benadrukte het lage aantal voorvallen na vervanging van bioprothetische kleppen. In deze analyse van 31.740 patiënten, voornamelijk met chirurgische aortaklepvervanging, traden vroege trombo-embolische voorvallen op bij 145 patiënten (1%) die vitamine K-antagonisten gebruikten en 262 patiënten (1,5%) die geen vitamine K-antagonisten gebruikten (odds ratio 0,96; 95%-betrouwbaarheidsinterval, 0,60-1,52).5 Als we veronderstellen dat er inderdaad een toename van 0,5% is in trombo-embolische complicaties in de eerste maanden na chirurgische aortaklepvervanging bij patiënten die geen vitamine K antagonisten gebruiken, dan zouden voor een voldoende gerandomiseerde gecontroleerde trial ongeveer 15.500 patiënten nodig zijn.6 Tot op heden zijn er 2 gerandomiseerde trials uitgevoerd, met een totaal van 268 patiënten.7,8 Gezien het kleine aantal patiënten is het ontbreken van een statistisch detecteerbaar verschil in de 2 groepen niet verrassend.
Bij gebrek aan grote gerandomiseerde gecontroleerde studies moeten clinici zich voor inzicht wenden tot observationele studies, zoals de analyse van het Deense nationale patiëntenregister.9 In deze studie van 4.075 patiënten met bioprothetische aortaklepvervangingen werd het staken van warfarine geassocieerd met een toename van trombo-embolische voorvallen en cardiovasculaire sterfgevallen 1-6 maanden na de operatie. Interessant is dat, hoewel het aantal beroertes in de eerste 3 maanden in de behandelingsgroep was toegenomen, het aantal beroertes tussen 3 en 6 maanden niet verschilde tussen patiënten die warfarine bleven gebruiken of stopzetten, hoewel er in deze periode slechts 21 voorvallen waren. Bovendien was er geen verschil in bloedingsincidenten tussen 3 maanden en 1 jaar. Deze observatie is in tegenspraak met eerdere rapporten en klinische ervaring dat patiënten die warfarine gebruiken meer kans hebben om in het ziekenhuis te worden opgenomen voor bloedingen.5 Daarom kunnen de conclusies van de auteurs met betrekking tot cardiovasculaire mortaliteit en trombo-embolische voorvallen te maken hebben met residuele confounding. Meer bepaald is het mogelijk dat er geen verschil in bloedingsgebeurtenissen was omdat clinici minder geneigd waren om antistolling te starten of voort te zetten bij patiënten met het hoogste risico.
Helaas bieden gepubliceerde gegevens, in vergelijking met trombo-embolische voorvallen, nog minder inzicht in inferentiële associaties voor bioprothetische kleptrombose. Er zijn maar weinig voorvallen gerapporteerd, en de meeste literatuur is beperkt tot case series en single-center ervaringen.10 Bijgevolg is de incidentie van bioprothetische kleptrombose niet goed gedefinieerd, hoewel in één studie slechts 8 van 4.568 patiënten met bioprothetische aortakleppen opnieuw moesten worden geopereerd voor aortastenose gerelateerd aan trombus.11 Evenzo is de rol van klinisch stille trombose en mogelijke versnelde bioprothetische klepdegeneratie grotendeels onbekend.
Selectieve antistolling na bioprothetische klepvervanging
Gebaseerd op een onduidelijke grootte van het voordeel en een algemeen aanvaard bloedingsrisico, is universele antistolling na bioprothetische aortaklepvervanging moeilijk te rechtvaardigen; deze onzekerheid wordt weerspiegeld door de aanbeveling van klasse IIb in de 2014 American College of Cardiology and American Heart Association (ACC/AHA) richtlijnen voor valvulaire hartziekten.12 Er kunnen zich echter specifieke klinische situaties voordoen waarin antistolling sterker moet worden overwogen. In een recente case-controlstudie met 46 patiënten met een heroperatie voor trombose van de bioprothetische aortaklep werden bijvoorbeeld een toename >50% van de gemiddelde Doppler-gradiënten op echocardiografie vanaf de uitgangswaarde, een toegenomen dikte van de cusp en abnormale mobiliteit van de cusp allemaal geassocieerd met kleptrombose.13 Daarom kan bij deze patiënten een proef met antistolling en follow-up-echocardiografie ter beoordeling van de Doppler-gradiënten worden overwogen,14 hoewel onduidelijk is in welke mate de klepfunctie op korte en lange termijn door antistolling wordt gewijzigd.
Bovendien lijken patiënten met een bioprothetische mitralisklep een hoger risico te lopen op trombo-embolische voorvallen en kleptrombose (zie de illustratieve casus, met figuren 1-2 en video’s 1-2, hieronder). Omdat bioprothetische mitralisklepvervanging veel minder vaak voorkomt dan aortaklepvervanging, zijn de gegevens nog beperkter. In een single-center studie van 216 patiënten met een bioprothetische mitralisklepvervanging hadden echter 10 (5%) binnen 6 maanden een ischemische beroerte.15 Bovendien ontwikkelden zich in een andere studie van 149 opeenvolgende patiënten 9 (6%) bioprothetische mitraliskleptrombose.16 Patiënten met een bioprothetische mitralisklepvervanging lijken dus een hoger risico te lopen, en routinematige antistolling moet worden overwogen gedurende 3-6 maanden, opnieuw tot uiting komend in de klasse IIa aanbeveling in de 2014 ACC/AHA valvular heart disease guidelines.12
Illustratieve casus: Bioprosthetic Mitral Valve Thrombosis
Een 71-jarige vrouw presenteerde zich met hartfalen 8 maanden na bioprosthetische mitralisklepvervanging voor reumatische mitralisstenose. Postoperatief werd ze gedurende 3 maanden behandeld met coumadin en bleef ze aspirine gebruiken. Ze had geen voorgeschiedenis van atriumfibrilleren en was koortsvrij, en bloedkweken waren negatief.
Video 1
Figuur 1
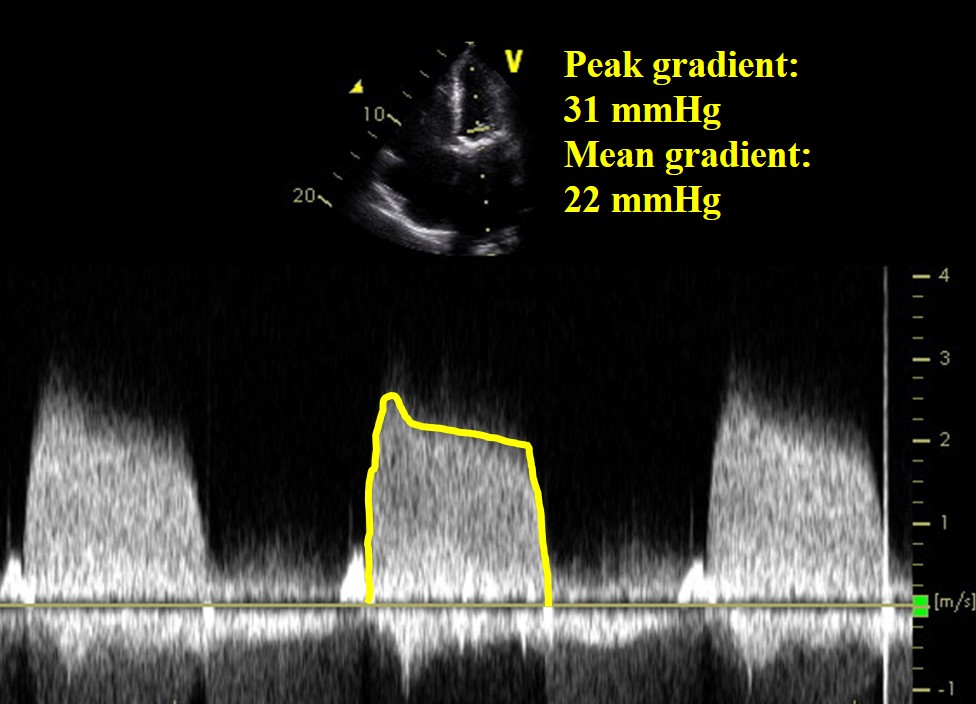
Video 2
Figuur 2
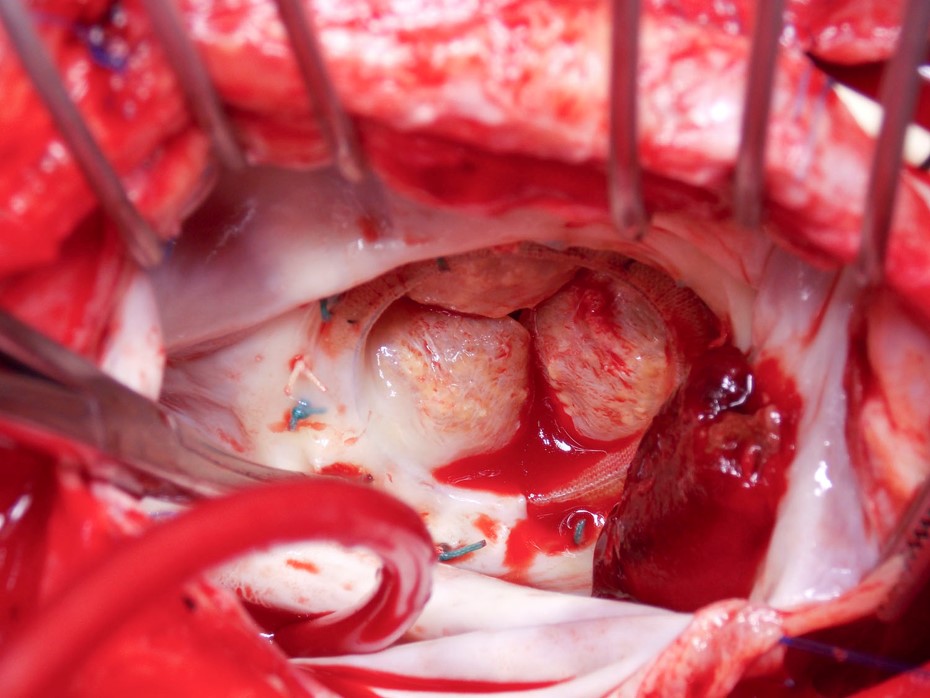
Ten slotte, en misschien wel het meest omstreden, is de vraag of onze benadering van antistolling moet verschillen voor patiënten die een TAVR hebben ondergaan. Aanvankelijk werden deze patiënten standaard behandeld met aspirine en clopidogrel, omdat dit de aanpak was die in de gerandomiseerde onderzoeken werd gevolgd. Meer recentelijk zijn met behulp van elektrocardiografie-geactiveerde vierdimensionale computertomografie-angiografie (CTA) een verminderde mobiliteit van de bioprothetische aortaklepvleugel en een hypoattenueerde verdikking van de vleugelvleugel beschreven, wat duidt op kleptrombose.17,18 Deze patiënten zijn vaak asymptomatisch en hebben normale Doppler-gradiënten op echocardiografie, wat suggereert dat deze bevindingen subklinisch kunnen zijn. Belangrijk is dat deze CTA-afwijkingen kunnen verdwijnen met warfarine, en dat het ontbreken van initiële antistolling een mogelijke risicofactor blijkt te zijn.19 Op dit moment zijn deze beeldvormingsbevindingen echter van onduidelijk klinisch belang.20 Gelukkig loopt er een gerandomiseerde studie, GALILEO (Global Study Comparing a Rivaroxaban-Based Antithrombotic Strategy to an Antiplatelet-Based Strategy After Transcatheter Aortic Valve Replacement to Optimize Clinical Outcomes), waarin rivaroxaban wordt vergeleken met antiplaatjestherapie na TAVR, die waardevolle inzichten zou moeten verschaffen.21 Toch is het mogelijk dat de studie, ondanks een geschatte inclusie van 1.520 patiënten, niet voldoende is aangedreven voor klinische gebeurtenissen.
Conclusies
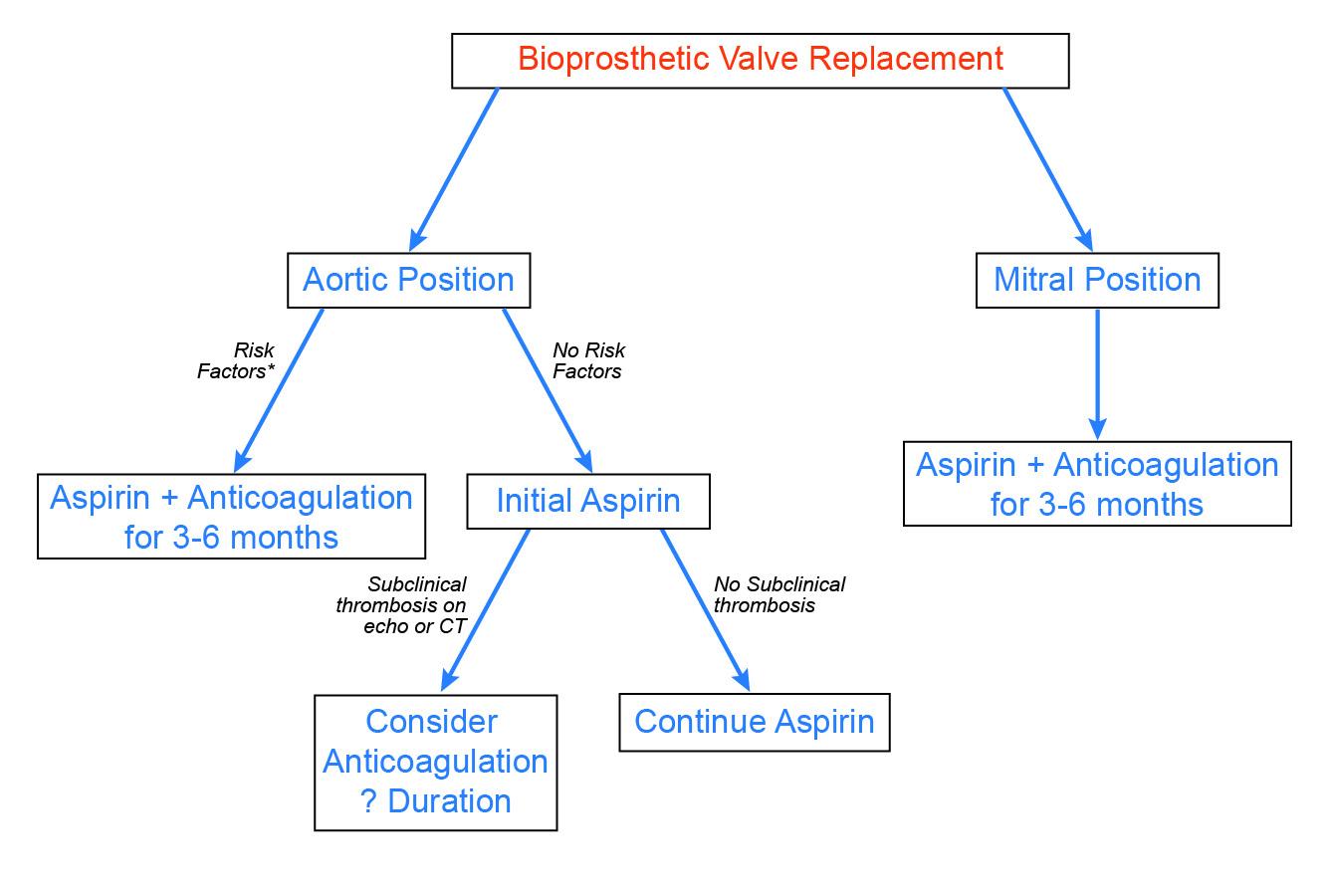
Over het algemeen zijn bij patiënten met bioprothetische kleppen vroege, niet-procedurele trombo-embolische voorvallen ongewoon. Bovendien is de incidentie van openlijke kleptrombose waarschijnlijk laag, en het effect van subacute kleptrombose op de duurzaamheid van de klep wordt nog gedefinieerd. Gezien deze waarnemingen, in combinatie met het verhoogde bloedingsrisico met warfarine, pleiten wij voor een selectieve benadering van postoperatieve antistolling (figuur 3). Voor patiënten met bioprothetische aortakleppen is antistolling gedurende 3-6 maanden geïndiceerd bij patiënten met vastgestelde risicofactoren, zoals atriumfibrillatie. Op basis van recent nieuw bewijsmateriaal moet antistolling en een nauwgezette follow-up worden overwogen bij patiënten met abnormale echocardiografische of CTA-bevindingen, zoals een onverklaarbare toename van Doppler-klepgradiënten of een hypoattenuated folderlet verdikking. Ten slotte lijken patiënten met bioprothetische mitraliskleppen, hoewel er minder gegevens beschikbaar zijn, een hoger risico te lopen op trombotische complicaties, en wordt routinematige anticoagulatie gedurende 3-6 maanden aanbevolen.
Figuur 3: Voorgestelde aanpak van antistolling na vervanging van bioprothetische kleppen
Dit artikel bevat educatief materiaal dat is bedoeld voor bevoegde professionals in de gezondheidszorg en is uitsluitend bedoeld voor gebruik voor educatieve en informatieve doeleinden. Hoewel de inhoud betrekking kan hebben op specifieke medische en gezondheidskwesties, is het geen vervanging of vervanging van persoonlijk medisch advies en is het niet bedoeld om als enige basis te worden gebruikt voor het nemen van geïndividualiseerde medische of gezondheidsgerelateerde beslissingen. De standpunten en meningen die worden geuit zijn die van de bijdragende auteurs en redacteuren en vertegenwoordigen niet noodzakelijkerwijs de standpunten van de ACC. Het materiaal is niet bedoeld om de enige, of noodzakelijkerwijs beste, methoden of procedures voor de behandelde medische situaties te presenteren, maar is eerder bedoeld om een benadering, visie, verklaring of mening weer te geven.
- Pibarot P, Dumesnil JG. Prothetische hartkleppen: selectie van de optimale prothese en langetermijnbeheer. Circulation 2009;119:1034-48.
- Mack MJ, Douglas PS, Holmes DR. Shedding More Light on Valve Thrombosis After Transcatheter Aortic Valve Replacement. J Am Coll Cardiol 2016;67:656-8.
- Heras M, Chesebro JH, Fuster V, et al. Hoog risico op trombo-emboli vroeg na bioprosthetische hartklepvervanging. J Am Coll Caridol 1995;25:1111-9.
- Roudaut R, Serri K, Lafitte S. Thrombose van prothetische hartkleppen: diagnose en therapeutische overwegingen. Heart 2007;93:137-42.
- Masri A, Gillinov AM, Johnston DM, et al. Anticoagulatie versus antiplatelet of geen therapie bij patiënten die een bioprothetische klepimplantatie ondergaan: een systematische review en meta-analyse. Heart 2017;103:40-80.
- R Core Team (2015). R: A language and environment for statistical computing. R Foundation for Statistical Computing; Wenen, Oostenrijk. Beschikbaar op: https://www.R-project.org/. (Met behulp van functie power.prop.test α = 0,05 en β = 0,8)
- Aramendi JI, Mestres CA, Martinez-León J, Campos V, Muñoz G, Navas C. Triflusale versus orale anticoagulatie voor primaire preventie van trombo-embolie na bioprothetische klepvervanging (trac): prospectieve, gerandomiseerde, coöperatieve trial. Eur J Cardiothorac Surg 2005;27:854-60.
- Colli A, Mestres CA, Castella M, Gherli T. Comparing warfarin to aspirin (WoA) after aortic valve replacement with the St. Jude Medical Epic heart valve bioprosthesis: results of the WoA Epic pilot trial. J Heart Valve Dis 2007;16:667-71.
- Mérie C, Køber L, Skov Olsen P, et al. Association of warfarin therapy duration after bioprosthetic aortic valve replacement with risk of mortality, thromboembolic complications, and bleeding. JAMA 2012;308:2118-25.
- Cremer PC, Rodriguez LL, Griffin BP, et al. Early Bioprosthetic Valve Failure: Mechanistic Insights via Correlation between Echocardiographic and Operative Findings. J Am Soc Echocardiogr 2015;28:1131-48.
- Brown ML, Park SJ, Sundt TM, Schaff HV. Early thrombosis risk in patients with biologic valves in the aortic position. J Thorac Cardiovasc Surg 2012;144:108-11.
- Nishimura RA, Otto CM, Bonow RO, et al. 2014 AHA/ACC guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2014;63:e57-185.
- Egbe AC, Pislaru SV, Pellikka PA, et al. Bioprosthetic Valve Thrombosis Versus Structural Failure: Clinical and Echocardiographic Predictors. J Am Coll Cardiol 2015;66:2285-94.
- Stewart WJ. Trombose van Bioprothetische Kleppen: Can We Afford to Ignore It? J Am Coll Cardiol 2015;66:2295-7.
- Russo A, Grigioni F, Avierinos JF, et al. Thrombo-embolische complicaties na chirurgische correctie van mitrale regurgitatie incidentie, voorspellers, en klinische implicaties. J Am Coll Cardiol 2008;51:1203-11.
- Butnaru A, Shaheen J, Tzivoni D, Tauber R, Bitran D, Silberman S. Diagnosis and treatment of early bioprosthetic malfunction in the mitral valve position due to thrombus formation. Am J Cardiol 2013;112:1439-44.
- Makkar RR, Fontana G, Jilaihawi H, et al. Possible Subclinical Leaflet Thrombosis in Bioprosthetic Aortic Valves. N Engj J Med 2015;373:2015-24.
- Pache G, Schoechlin S, Blanke P, et al. Early hypo-attenuated leaflet thickening in balloon-expandable transcatheter aortic heart valves. Eur Heart J 2016;37:2263-71.
- Hansson NC, Grove EL, Andersen HR, et al. Transcatheter Aortic Valve Thrombosis: Incidence, Predisposing Factors, and Clinical Implications. J Am Coll Cardiol 2016;68:2059-69.
- Laschinger JC, Wu C, Ibrahim NG, Shuren JE. Reduced Leaflet Motion in Bioprosthetic Aortic Valves–The FDA Perspective. N Engj J Med 2015;373:1996-8.
- Global Study Comparing a rivAroxaban-based Antithrombotic Strategy to an antipLatelet-based Strategy After Transcatheter aortIc vaLve rEplacement to Optimize Clinical Outcomes (GALILEO) (ClinicalTrails.gov website). 2016. Beschikbaar op: https://clinicaltrials.gov/ct2/show/NCT02556203. Accessed 11/29/2016.
Clinical Topics: Antistollingsmanagement, Aritmieën en Klinische EP, Hartchirurgie, Hartfalen en Cardiomyopathieën, Invasieve Cardiovasculaire Angiografie en Interventie, Niet-invasieve Beeldvorming, Valvulaire Hartaandoeningen, Antistollingsmanagement en Atriumfibrilleren, Atriumfibrilleren/Supraventriculaire Aritmieën, Aortachirurgie, hartchirurgie en aritmieën, hartchirurgie en hartfalen, hartchirurgie en VHD, acuut hartfalen, interventies en beeldvorming, interventies en structurele hartaandoeningen, angiografie, echocardiografie/ultrasound, nucleaire beeldvorming
Keywords: Aortaklep, Aortaklepstenose, Atriumfibrilleren, Aspirine, Bioprothese, Case-Control Studies, Angiografie, Constrictie, Pathologisch, Echocardiografie, Transesophageale, Elektrocardiografie, Hartfalen, Hartklepaandoeningen, Hartklepprothese, Mitralisklep, Mitralisklepstenose, Heroperatie, Risicofactoren, Beroerte, Hechtingen, Trombose, Ticlopidine, Transkatheter Aortaklepvervanging, Vitamine K, Warfarine
< Terug naar overzichten