Zoals we gezien hebben, bevat ons dieet veel koolhydraten, en je vraagt je misschien af of er een manier is om een monster te analyseren om te zien of het sucrose is, of een van de synthetische zoetstoffen zoals sorbitol of hoge fructose maïssiroop, of zelfs een verbinding zoals vitamine C, die wordt gesynthetiseerd uit suikers en net als die suikers alleen C, H, en O bevat. Er is zo’n manier, en het is een van de meest fundamentele vormen van analyse, genaamd elementaire analyse. Het is een van de eerste methoden die onderzoekers gebruiken om een nieuwe verbinding te identificeren.
Tot nu toe hebben we alle stoichiometrische verhoudingen verkregen uit de coëfficiënten van uitgebalanceerde chemische vergelijkingen. Chemische formules geven echter ook relatieve hoeveelheden stof aan, en stoichiometrische verhoudingen kunnen ook daaruit worden afgeleid. Zo vertelt de formule CO2 ons dat, ongeacht de grootte van het monster koolstofdioxide, er altijd 2 mol zuurstofatomen zal zijn voor elke mol koolstofatomen. Dat wil zeggen, uit de formule CO2 volgt de stoichiometrische verhouding
We kunnen ook bepalen dat voor CO2
(De reciprocalen van deze stoichiometrische verhoudingen gelden ook voor CO2.)
Stoichiometrische verhoudingen afgeleid van formules in plaats van vergelijkingen zijn betrokken bij de meest voorkomende procedure voor het bepalen van de empirische formules van verbindingen die alleen C, H, en O bevatten. Een afgewogen hoeveelheid van de te analyseren stof wordt in een verbrandingstrein geplaatst en verhit in een stroom van droge O2. Alle H in de verbinding wordt omgezet in H2O(g) dat selectief wordt gevangen in een vooraf gewogen absorptiebuis. Alle C wordt omgezet in CO2(g) en dit wordt selectief geabsorbeerd in een tweede buis. De massatoename van elk buisje geeft respectievelijk aan hoeveel H2O en CO2 er bij de verbranding van het monster is ontstaan
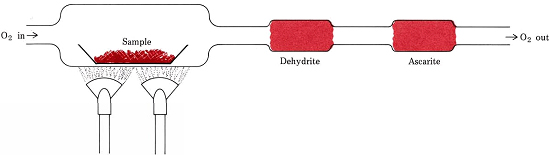
Figuur Een verbrandingstrein. H2O en CO2, ontstaan door de combinatie van O2 met H en C in het monster, worden selectief geabsorbeerd door buizen met dehydriet en ascariet (NaOH op asbest).
Voorbeeld: Empirische formule van ascorbinezuur
Een monster van 6,49 mg ascorbinezuur (vitamine C) werd verbrand in een verbrandingstrein. Er werd 9,74 mg CO2 en 2,64 mg H2O gevormd. Bepaal de empirische formule van ascorbinezuur.
Oplossing We moeten de hoeveelheid C, de hoeveelheid H, en de hoeveelheid O in het monster weten. De verhouding van deze geeft de subscripts in de formule. De eerste twee kunnen worden verkregen uit de massa’s van CO2 en H2O met behulp van de molaire massa’s en de stoichiometrische verhoudingen
Thus
De verbinding kan ook zuurstof hebben bevat. Om te zien of dat zo is, bereken je de massa’s van C en H en trek je die af van de totale massa van het monster
en
De verhoudingen van de hoeveelheden van de elementen in ascorbinezuur zijn dus
Aangezien nC:nH:nO 3 mol C:4 mol H:3 mol O is, is de empirische formule C3H4O3.
Een tekening van een molecuul ascorbinezuur is hier afgebeeld. Door de atomen te tellen kun je vaststellen dat de molecuulformule C6H8O6 is – precies het dubbele van de empirische formule. Het is ook duidelijk dat er meer te weten valt over een molecuul dan alleen hoeveel atomen van elke soort aanwezig zijn. In ascorbinezuur, zoals in andere moleculen, de manier waarop de atomen zijn met elkaar verbonden en hun rangschikking in drie-dimensionale ruimte zijn heel belangrijk. Een beeld dat toont welke atomen met welke zijn verbonden wordt een structuurformule genoemd. Empirische formules kunnen worden verkregen uit samenstellingspercentages of verbrandingsexperimenten, en als het molecuulgewicht bekend is, kunnen uit dezelfde gegevens molecuulformules worden bepaald. Om structuurformules te vinden zijn gecompliceerdere experimenten nodig. In voorbeeld 2 hebben wij de massa van O verkregen door de massa’s van C en H af te trekken van de totale massa van het monster. Hierbij werd aangenomen dat alleen C, H en O aanwezig waren. Soms kan een dergelijke veronderstelling onjuist zijn. Toen penicilline voor het eerst werd geïsoleerd en geanalyseerd, werd over het hoofd gezien dat het zwavel bevatte. Deze fout werd pas na enige tijd ontdekt, omdat het atoomgewicht van zwavel bijna precies twee keer zo hoog is als dat van zuurstof. Twee zuurstofatomen werden vervangen door één zwavelatoom in de formule.
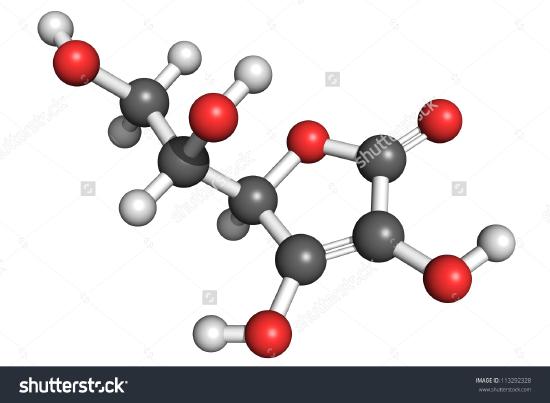
Figuur Een 3D voorstelling van L-Ascorbinezuur 1
Van ChemPRIME: 3.4: Analyse van verbindingen