Een adduct (van het Latijnse adductus, “naar zich toe getrokken”, alternatief, een samentrekking van “additieproduct”) is een product van een directe additie van twee of meer afzonderlijke moleculen, resulterend in een enkel reactieproduct dat alle atomen van alle componenten bevat. Het resultaat wordt beschouwd als een afzonderlijke moleculaire soort. Voorbeelden zijn de additie van natriumbisulfiet aan een aldehyde om een sulfonaat te verkrijgen. Het kan gewoon worden beschouwd als één enkel product dat het resultaat is van de directe combinatie van verschillende moleculen en dat alle atomen van de reagerende moleculen omvat.
Er vormen zich vaak adducten tussen Lewiszuren en Lewisbasen. Een goed voorbeeld is de vorming van adducten tussen het Lewiszuur boraan en het zuurstofatoom in de Lewisbasen, tetrahydrofuraan (THF): BH3-O(CH2)4 of diethylether: BH3-O(CH3CH2)2. Veel Lewiszuren en Lewisbasen die in de gasfase of in niet-waterige oplosmiddelen reageren om adducten te vormen, zijn in het ECW-model onderzocht. Trimethylboron, trimethyltinchloride en bis(hexafluoroacetylacetonato)koper(II) zijn voorbeelden van Lewiszuren die adducten vormen die sterische effecten vertonen. Bijvoorbeeld: trimethyltinchloride, wanneer het reageert met diethylether, vertoont sterische afstoting tussen de methylgroepen op de Sn en de ethylgroepen op zuurstof. Maar wanneer de Lewis base tetrahydrofuraan is, wordt de sterische afstoting verminderd. Het ECW-model kan een maat voor deze sterische effecten opleveren.
-
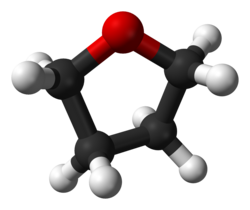
THF-molecuul
-
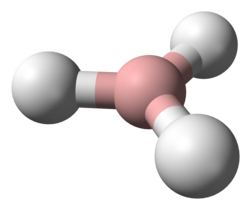
BH3-molecuul
-
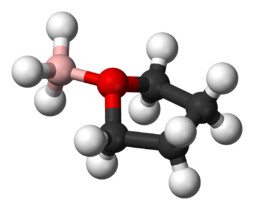
Lewis adduct tussen BH3 en THF
Verbindingen of mengsels die geen adduct kunnen vormen vanwege sterische hinder worden gefrustreerde Lewisparen genoemd.
Adducten zijn niet noodzakelijk moleculair van aard. Een goed voorbeeld uit de vastestofchemie zijn de adducten van ethyleen of koolmonoxide van CuAlCl4. Dit laatste is een vaste stof met een uitgebreide roosterstructuur. Bij de vorming van het adduct wordt een nieuwe uitgebreide fase gevormd waarin de gasmoleculen worden opgenomen (ingevoegd) als liganden van de koperatomen binnen de structuur. Deze reactie kan ook worden beschouwd als een reactie tussen een base en een Lewiszuur met het koperatoom in de elektron-ontvangende rol en de pi elektronen van het gasmolecuul in de elektron-donerende rol.


