Het meest algemene principe dat de zuursterkte bepaalt kan als volgt worden gesteld: sterke zuren hebben relatief stabiele conjugaatbasen. In het algemeen geldt: hoe stabieler de geconjugeerde base, hoe sterker het zuur. Een belangrijk ding om te onthouden is dat stabiliteit en reactiviteit omgekeerd evenredig zijn. Hoe stabieler een stof is, hoe minder reactief hij is, en omgekeerd. Daarom is een andere manier om de bovenstaande regel uit te drukken dat sterke zuren zwakke geconjugeerde basen hebben. HCl en H3O+ zijn sterke zuren. Dienovereenkomstig zijn de overeenkomstige geconjugeerde basen, Cl- en H2O, zwak (zeer stabiel). Het chloride-ion is stabiel omdat de negatieve lading zich op een zeer elektronegatief atoom bevindt. Het watermolecuul is een van de meest stabiele stoffen die we kennen.
Hoe weten we welk proton het zuurst is in een molecuul (zoals azijnzuur) dat meer dan één type proton bevat? Bedenk dat hoe hoger de graad van positief karakter van het proton, hoe zuurder het is. Bestudering van een pKa-tabel onthult enkele tendensen voor zure protonen. De volgende richtlijnen kunnen worden gebruikt om de zuurgraad te voorspellen.
1. Hydrogenen die direct zijn gekoppeld aan zeer elektronegatieve atomen zoals zuurstof, zwavel en de halogenen hebben een aanzienlijke zuurgraad.
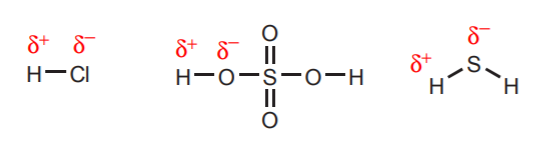
2. Hydrogenen die zijn gekoppeld aan een positief geladen stikstof, zuurstof, of zwavel zijn zuur. De hoge elektronegativiteit van deze atomen maakt dat zij zich ongemakkelijk voelen bij de positieve lading. Zij proberen de lading te verdelen over de naburige atomen door elektronendichtheid aan hen te onttrekken. Dit kan worden aangetoond door resonantiestructuren te tekenen zoals afgebeeld.
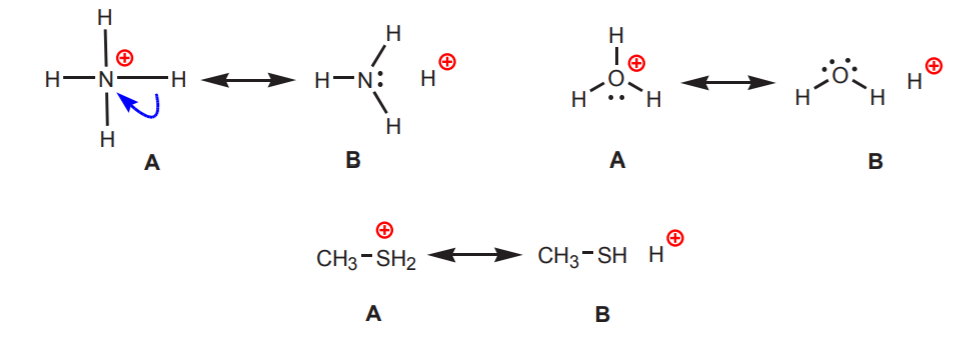
In alle gevallen onthult structuur B het positieve karakter van waterstof, en dus zijn zure aard.
3. Zoals blijkt uit de pKa-waarden van alkanen en alkenen, zijn hydrogenen die aan koolstof zijn gebonden van zeer lage zuurgraad. Dergelijke stoffen worden normaal gesproken helemaal niet als zuren beschouwd. Sommige koolwaterstoffen kunnen echter zwak zuur zijn als hun geconjugeerde basen stabiele ionen zijn. Dit kan gebeuren in de volgende gevallen.
a) Er bevinden zich een of meer elektronegatieve atomen in de buurt van het proton in kwestie. Door de inductieve werking van deze elektronegatieve atomen blijven de hydrogenen in de nabijheid verstoken van elektronendichtheid, en hebben daardoor een partieel positief karakter.
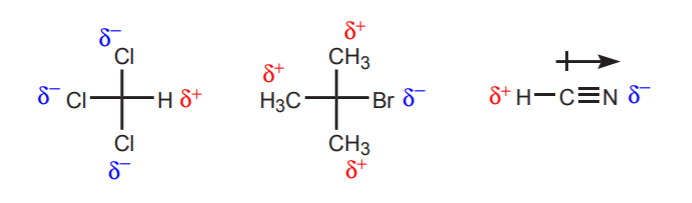
b) Een waterstofatoom gebonden aan een koolstof die op zijn beurt gebonden is aan een andere koolstof die een partiële of een volledige positieve lading draagt, is zuur.
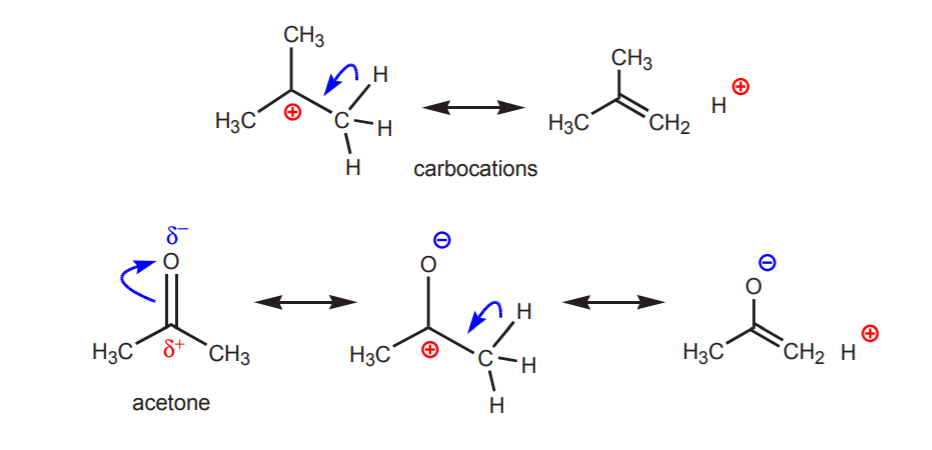
De zuurgraad van de weergegeven protonen wordt duidelijk in eliminatiereacties (hoofdstuk 6) en in de chemie van enolen (hoofdstuk 22), wanneer de aanwezigheid van een base leidt tot de vorming van alkenen of enolaat-ionen via een stap waarbij een protonoverdracht plaatsvindt.
c) De geconjugeerde base is resonantiestabiliserend. Dit effect is het belangrijkst wanneer er een andere factor is die de zuurgraad verhoogt, zoals de aanwezigheid van een dipool of een elektronegatief atoom (zoals in de nitril functionele groep, -CN). Anders is resonantiestabilisatie alleen niet voldoende om de zuurgraad van een aan koolstof gebonden waterstof dramatisch te verhogen (zoals in tolueen, waar de pKa slechts 40 is).
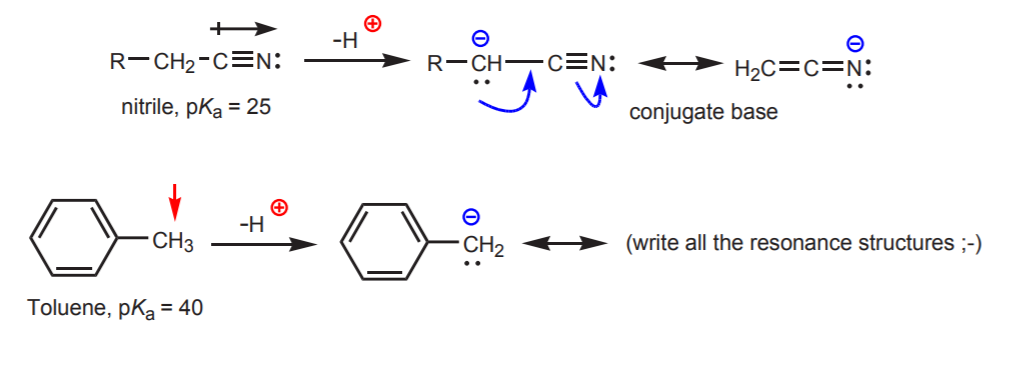
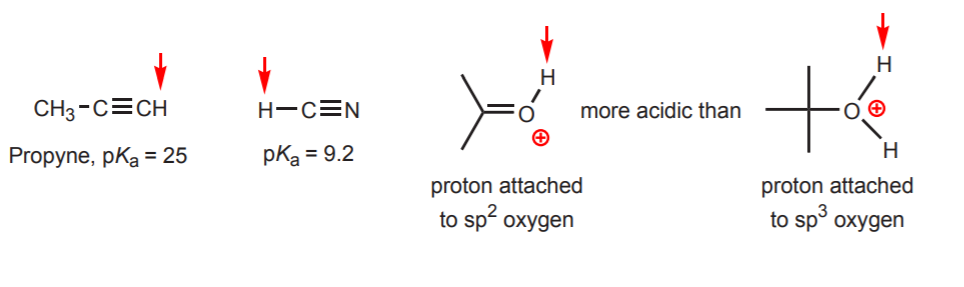
d) De waterstof is gebonden aan een sp-gethybridiseerde koolstof. Hybridisatie-effecten op de zuurgraad worden besproken in hoofdstuk 9. De hybridiseringstendensen kunnen worden uitgebreid tot zuurstof en stikstof naast koolstof, zoals in het voorbeeld hiernaast.