化学元素の水素は、非金属として分類されます。 非常に高い圧力で金属になることができます。 1766年にHenry Cavendishによって発見されました。

データゾーン
| 分類 | Hydrogen is the nonmetal is a classification. 非常に高い圧力で金属になることがあります。 |
| 色 | 無色 |
| 原子量 | 1.0079 |
| 状態 | 気体 |
| 融点 | |
| 沸点 | |
| 電子: | 1 |
| プロトン: | 1 |
| 最も多い同位体に中性子が存在する。 | 0 |
| 電子殻 | 1 |
| 電子配置 | 1s1 |
| 密度@20oC | 0.0000899 g/cm3 |
以下を含む、もっと表示する。 熱、エネルギー、酸化、
反応、化合物、半径、導電率
| 原子容積 | 14.4 cm3/mol | |||
| 構造 | hcp:六方最密充填(低温で固体として) | |||
| 硬度 | – | |||
| 比熱容量 | 14.0 | 14.0 | ||
| 融解熱 | 0.117 kJ mol-1 of H2 | |||
| 霧化熱 | 218 kJ mol-1 | |||
| 蒸発熱 | 0.0 kJ mol-1 of H2 | 0.904 kJ mol-1 H2 | ||
| 第1イオン化エネルギー | 1312 kJ mol-1 | |||
| 第2イオン化エネルギー | kJ mol-1 | |||
| 第3イオン化エネルギー | 11815.0 kJ mol-1 | |||
| 電子親和力 | 72.0kJ・mol-1。7711 kJ mol-1 | |||
| 最小酸化数 | -1 | |||
| 最小共通酸化数 | -1 | |||
| 最大酸化数 | 1 | |||
| 最大の共通酸化数… | 1 | |||
| 電気陰性度(Pauling Scale) | 2.18 | |||
| 分極率体積 | 0.1 | 0.7 Å3 | ||
| 空気との反応 | 旺盛な反応。 ⇒ H2O | |||
| 15M HNO3との反応 | なし | |||
| 6M HClとの反応 | なし | なし | ||
| 酸化物(s) | H2O | |||
| ヒドリド(s) | H2 | |||
| 塩化物(s) | HCl | |||
| 原子半径 | 25 pm | |||
| イオン半径(1+イオン) | – (単位:百万分の一) | |||
| – (単位:百万分の一) | ||||
| HCL | ||||
| イオン半径(2+イオン) | – | |||
| イオン半径(3+イオン) | – | |||
| イオン半径(1-イオン) | – イオン半径(2+イオン) – | |||
| – | – | |||
| イオン半径(3-イオン) | – | |||
| 熱伝導率 | 0.1805 W m-1 K-1 | |||
| 電気伝導率 | – | |||
| 氷点/融点:- 259.14 oC, 14.01 K |

Nasaイメージ図です。

Theophrastus Paracelsus – 最初に水素を発生させた人:「空気は風のように発生し、吹き出す。”
水素の発見
学校の化学実験で好きなのは、酸にマグネシウムなどの金属を入れることです。 この金属は酸と反応して塩を作り、酸から水素を放出します。 人間の行為によって初めて水素が作られたという記録は、1500年代の前半に、現在学校で使われているのと同じような方法によって残されている。 彼はこの実験について、”空気が発生し、風のように吹き出す “と言ったと伝えられている。 しかし、彼は水素の性質を発見することはできなかった(1)
Turquet De Mayerneは1650年にパラケルススの実験を繰り返し、そのガスが可燃性であることを発見した(2) パラケルススもド・メイヤーヌも水素が新しい元素であると提案することはなかった。 実際、パラケルススは、元素は塩、硫黄、水銀の3つしかなく、他の物質はすべてこの3つの組み合わせでできていると考えていた。 (3) (化学はまだまだこれから!)
1670年、イギリスの科学者ロバート・ボイルは、硫酸に鉄を加えた。 その結果、(水素)ガスは空気があるときだけ燃え、空気の一部(今でいう酸素)が燃焼によって消費されることを示した。 (4)
水素は1766年にイギリスの科学者ヘンリー・キャベンディッシュが塩酸と亜鉛を反応させて作ったもので、初めて別の元素として認識されるようになった。 彼は水素を「金属から発生する引火性の空気」と表現し、どの金属とどの酸を使って製造しても同じ物質(反応とその密度によって)であることを立証した(1) キャベンディッシュは、この物質を燃焼させると水が発生することも観察した。 この名前は、ギリシャ語で水を意味する「ハイドロ」と、形成することを意味する「ジーン」に由来し、水素は水を形成する2つの元素のうちの1つです。
1806年、水素が元素として確立されると、イギリスの化学者ハンフリー・デイヴィが精製水に強い電流を流し、その結果、水素は水を形成しました。
彼は、水素と酸素が生成されることを発見しました。 この実験により、電気は物質を構成する元素に引き離すことができることが証明された。 デイヴィは、物質が電気的な現象によって結合していることに気づき、化学結合の本質を発見したのです。 (5)

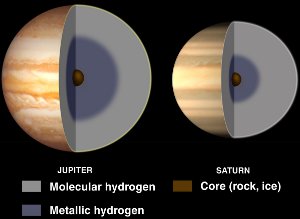
木星と土星の内部、液体金属水素がある様子。

Nasa:

水素自動車は汚染物質ではなく、水を排出します

実験室で水の電気分解をします。 電気エネルギーで水を分解する。 一方の試験管に水素、もう一方の試験管に酸素が集まる。
外観と特徴
有害な影響。
水素は非常に燃えやすく、ほとんど見えない炎を持っているので、誤って火傷をすることがあります。
特徴:水素はすべての元素の中で最も単純で、最も軽い元素です。 また、宇宙で最も一般的な元素でもあります。
最も一般的な形として、水素原子は陽子1個、電子1個、中性子1個で構成されています。
水素は無色、無臭の気体で、標準的な温度と圧力では、2原子分子であるH2として存在します。
空気中で燃焼して爆発性の混合物を形成し、酸化剤と激しく反応するのです。 水素は非常に軽いので、地球の重力に保持されないため、地球上にはほとんど自由な水素は存在しない。 形成された水素は、最終的に大気圏から宇宙空間へと逃げていきます。
通常、水素は非金属ですが、大きな圧力がかかると液体金属になります。 木星の強磁場(地球の14倍)は、電気を通す金属水素が自転しながら循環することで生じるダイナモ効果によるものと考えられている。
水素の用途
ハーバー法(アンモニアの製造)、油脂の水素化、メタノール製造、水素分解、水素脱硫などで大量の水素が使われている。
液体水素はロケット燃料として使われ、例えばスペースシャトルの離陸と軌道への上昇の動力源となっている。 スペースシャトルの大型外部燃料タンクには、液体水素と酸素が貯蔵されています。 (左図参照)
水素の重い同位体である重水素と三重水素は、核融合に利用されます。
現在の炭化水素(石油、ガス、石炭)ベースの経済に代わるものとして、水素経済が提唱されている。
水素経済の基本は、水素が酸素と燃焼するときにエネルギーが発生し、その反応による副産物は水だけである。 太陽エネルギーや風力エネルギーなどを使って、水を水素と酸素に分けることができるようになれば、真の水素経済が実現する。
存在量と同位体
存在量 地殻:重量で1400ppm(0.14%)、モル比で2.9%
存在量 太陽系:重量75%、モル比で93%
コスト、純粋:100gあたり12ドル
コスト、バルク:100gあたり8ドル
原典はこちら。 水素は、過熱した水蒸気をメタンや炭素と反応させることで商業的に調製されます。 実験室では、亜鉛やマグネシウムなどの金属に酸を作用させたり、水の電気分解(左図)でも水素を発生させることができる。 水素には、1H(プロチウム)、2H(重水素)、3H(トリチウム)の3つの同位体がある。 そのうちの重い2つの同位体(重水素と三重水素)は核融合に利用される。 プロチウムが最も多く、トリチウムは最も少ない同位体である。 トリチウムは不安定で、半減期は約12年4カ月です。 天然に存在する水素は、1Hと2Hの2つの同位体の混合物で、天然での存在量はそれぞれ99.99%と0.01%である。

- Peter Hoffmann, Tomorrow’s Energy: Hydrogen, Fuel Cells, and the Prospects for a Cleaner Planet., (2001) p22. MIT Press, Cambridge, MA.
- P. リザーランド・ティード「水素の化学と製造」, (2008) p2. Dabney Press.
- John S. Davidson, Annotations to Boyle’s “The Sceptical Chymist”.
- Andreas Züttel, Andreas Borgschulte, Louis Schlapbach, Hydrogen as a future energy carrier., (2008) p8.日本科学未来館。 Wiley-VCH, Weinheim.
- Kendall Haven, 100 Greatest Science Discoveries of All Time., (2007) p62.を参照。 Libraries Unlimited.
このページを引用する
オンラインでリンクする場合は、次のいずれかをコピーして貼り付けてください:
<a href="https://www.chemicool.com/elements/hydrogen.html">Hydrogen</a>
or
<a href="https://www.chemicool.com/elements/hydrogen.html">Hydrogen Element Facts</a>
学術文書でこのページを引用するには、次のMLA準拠の引用文を使用してください:
"Hydrogen." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/hydrogen.html>.
。