これまで見てきたように、私たちの食事には多くの炭水化物が含まれています。サンプルを分析して、それがスクロースか、ソルビトールや高果糖コーンシロップなどの合成甘味料か、あるいはビタミン C など、糖から合成されそれらと同様に C、H、O しか含まない化合物を判別する方法はないだろうかと思われるでしょう。 そのような方法があり、それは元素分析と呼ばれる最も基本的に重要な分析形態の一つです。
ここまでで、私たちはすべての化学量論比を平衡化学方程式の係数から求めました。 しかし、化学式も物質の相対量を示すものであり、化学量論比も化学式から求めることができる。 例えば、CO2という式は、どんなに大量の二酸化炭素があっても、炭素原子1モルに対して酸素原子2モルが必ず存在することを示している。 つまり、CO2という式から、化学量論比
は、CO2では
(これらの化学量論比の逆数もCO2では成り立つ)と求まる。)
方程式の代わりに式から得られる化学量論比は、C、H、およびOのみを含む化合物の経験式を決定するための最も一般的な手順に関与している。 化合物中のHはすべてH2O(g)に変換され、あらかじめ秤量しておいた吸収管に選択的に捕捉される。 CはすべてCO2(g)に変換され、これは2番目の管に選択的に吸収される。 それぞれの管の質量の増加から、試料が燃焼してH2OとCO2がどれだけ発生したかがわかる
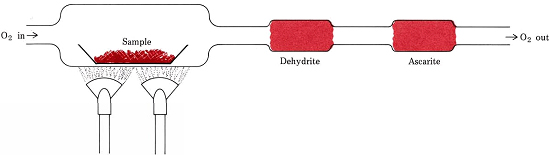
Figure \(\PageIndex{1}) A combustion train. 試料中のO2とH、Cが結合して生じたH2OとCO2は、Dehydriteとascarite(NaOH on asbestos)を含むチューブに選択的に吸収される。 アスコルビン酸の経験式
アスコルビン酸(ビタミンC)6.49mgを燃焼列車で燃焼させた。 9.74mgのCO2と2.64mgのH2Oが生成された。 アスコルビン酸の経験式を求めよ。
解答 試料中のCの量、Hの量、Oの量を知ることが必要である。 これらの比率が式の添え字となる。 最初の2つはCO2とH2Oのモル質量と化学量論比から求めることができる
Thomas
Thomas
化合物は酸素も含んでいる可能性があるので、酸素を含む化合物を選択する。 その場合、CとHの質量を計算し、sampleの全質量から差し引くと
and
アスコルビン酸の元素量の比は
Since nC.H.
であるから、
Shinpei
となり、
Shinpei となる。nH:nOは3mol C:4mol H:3mol Oなので、経験式はC3H4O3となる。
ここにアスコルビン酸の分子の図面がある。 原子を数えてみると、分子式はC6H8O6、つまり経験式のちょうど2倍であることがわかります。 このように、分子には原子の数だけでなく、いろいろな種類の原子があることがわかります。 アスコルビン酸も他の分子と同様、原子のつながり方と三次元空間での配置が非常に重要である。 どの原子がどのようにつながっているかを表した図を構造式と呼びます。 経験式は組成パーセントや燃焼トレインの実験から求めることができ、分子量が分かれば同じデータから分子式を求めることができる。 構造式を求めるには、より複雑な実験が必要である。 例2では、試料の全質量からCとHの質量を差し引いてOの質量を求めました。 これは、C,H,Oだけが存在すると仮定したものです。 このような仮定が正しくない場合があります。 ペニシリンが初めて単離され、分析されたとき、硫黄を含むという事実が見落とされた。 硫黄の原子量は酸素のほぼ2倍であるため、この間違いはしばらく発見されなかった。
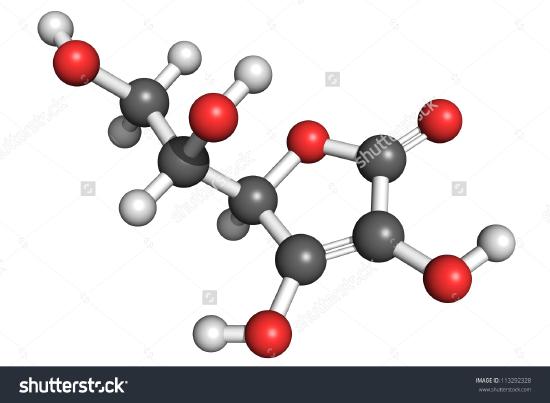
Figure \(A \PageIndex{2}) A 3D representation of L-Ascorbic Acid 1
From ChemPRIME: 3.4: 化合物の分析
より