酸の強さを決める最も一般的な原則はこうです:強い酸には比較的安定した共役塩基があります。 一般に、共役塩基が安定であればあるほど、酸は強くなります。 ここで重要なことは、安定性と反応性が逆であることだ。 安定な物質ほど反応性が低く、その逆もまた然りである。 したがって、上記の法則を別の言葉で表現すると、「強い酸には弱い共役塩基がある」ということになります。 HClとH3O+は強酸である。 したがって、対応する共役塩基であるCl-とH2Oは弱い(非常に安定)である。 塩化物イオンは、電気陰性度の高い原子に負電荷を持つため、安定である。 水分子は最も安定な物質の1つです。
2種類以上のプロトンを含む分子(酢酸など)において、どのプロトンが最も酸性であるかは、どのようにしてわかるのでしょうか。 プロトンの正の性質の度合いが高いほど酸性であることを思い出してください。 pKa表を見ると、酸性のプロトンにはいくつかの傾向があることがわかります。 酸素、硫黄、およびハロゲンのような非常に電気陰性原子に直接接続されている水素は、かなりの酸性度を運ぶ。 これらの原子の高い電気陰性度は、正電荷を不快にさせる。 そのため、隣接する原子から電子密度を奪って電荷を拡散させようとします。 これは、図のような共鳴構造を描くことで示すことができる。
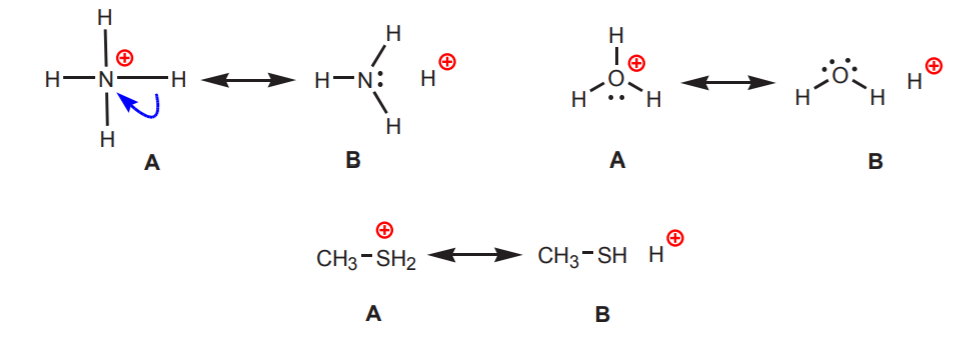
すべての場合において、構造Bは水素の正の性格、したがってその酸性の性質を明らかにする。 アルカンとアルケンのpKa値からわかるように、炭素に結合した水素は非常に低い酸性度である。 このような物質は通常、まったく酸とはみなされない。 しかし、炭化水素の中には、その共役塩基が安定なイオンであれば、弱酸性になるものもある。 これは次のような場合に起こりうる。
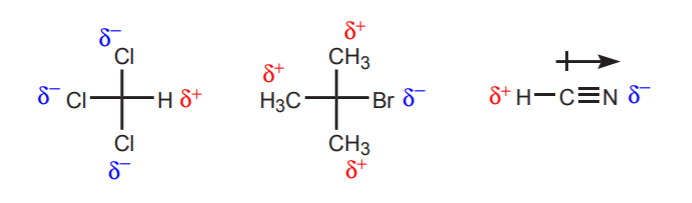
a) 考慮されるプロトンの近くに1つ以上の電気陰性原子があること。 これらの電気陰性原子の誘導効果により、近傍の水素は電子密度を奪われ、部分的に正の性質を持つ。
b) ある炭素に結合した水素原子が、今度は別の炭素に結合して部分的または全面的に正の電荷を持っていると酸性を示す。
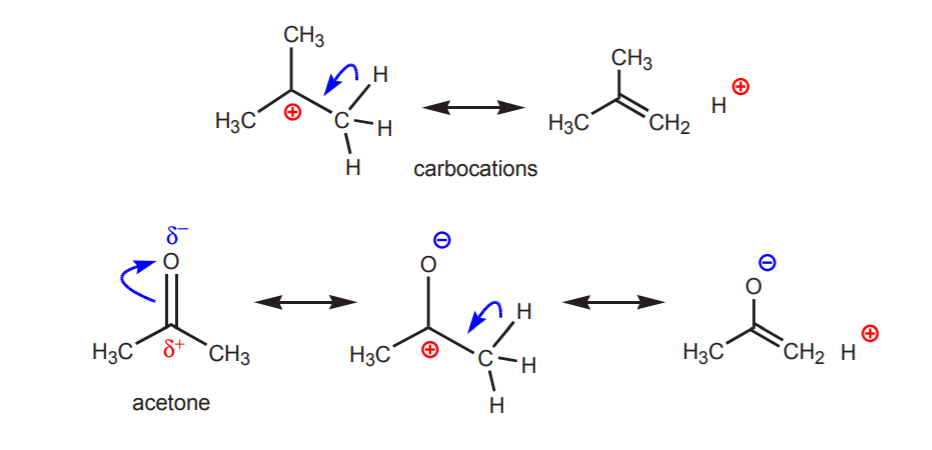
示されたプロトンの酸性度は、脱離反応(6章)およびエノールの化学(22章)において明らかになり、プロトン移動を伴う段階を通じて塩基の存在がアルケンまたはエノラートイオンの形成をもたらす。
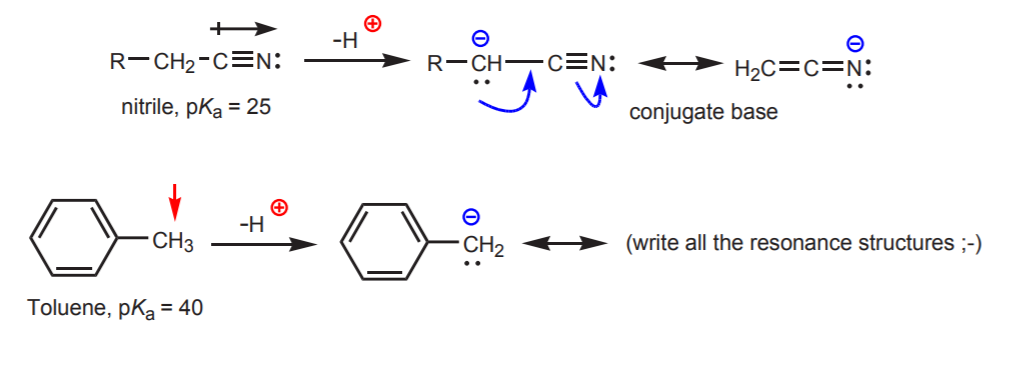
c) 共役塩基は共鳴安定化される。 この効果は、双極子や電気陰性原子の存在(ニトリル官能基、-CNのように)など、酸性度を高める別の要因がある場合に最も重要である。 そうでなければ共鳴安定化だけでは、炭素に結合した水素の酸性度を劇的に高めることはできない(pKaが40しかないトルエンのように)
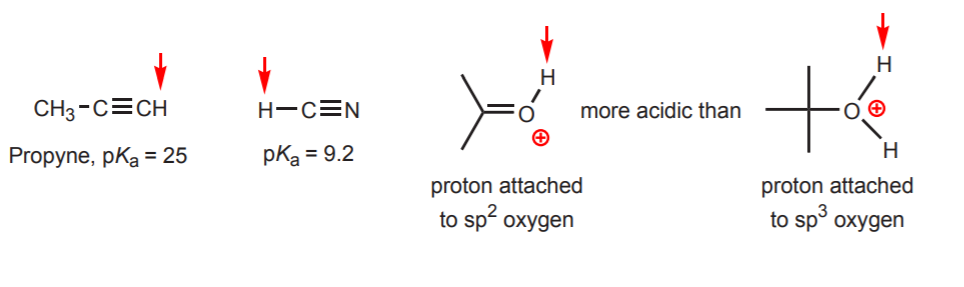
d) spハイブリッド炭素に水素が結合している場合。 酸性度に対するハイブリダイゼーションの効果については第9章で述べる。 混成の傾向は右の例のように炭素以外の酸素や窒素にも拡張できる。