Harvard Extensionの細胞生物学コース第4講のノートです。
分泌経路とは、小胞体、ゴルジ装置、その間を移動する小胞、細胞膜、ライソゾームなどのことを指します。 細胞がタンパク質を細胞外に分泌する経路であることから、「分泌」と名付けられた。 しかし、いつものように、語源は物語のほんの一部しか語っていない。 この経路は、膜結合タンパク質(細胞膜、小胞体膜、ゴルジ体膜など)やライソゾーム酵素、分泌経路で一生を終えるタンパク質も処理します。
サイトゾルと「内腔」(分泌経路を満たす液体)は異なる化学環境であり、通常は決して混ざり合うことはない。 サイトゾルは還元的(サイトゾルにいると、電子を提供したい分子に出会い続ける)、ER、ゴルジ体、細胞外環境は酸化的(電子を求める分子がどんどん近づいてくる)。 まだよくわからない場合は、酸化還元を参照してください。 例えば、ジスルフィド結合は通常、酸化的な条件下でのみ形成されます。 さらに、異なるタンパク質が分泌経路にのみ、あるいは細胞質のみに存在することもあります。 分泌経路は、細胞質にあるのが好ましくないもの、あるいは、望ましい相互作用パートナーとともに特殊な区画に集中させておくと最も有用なものを、細胞が取り扱うためのルートを提供します。 肝細胞(肝臓)は、薬物や毒素を平滑小胞体内に封じ込め、そこで分解して体外に排泄している。
分泌経路を通る多くのタンパク質は、細胞質側に突き出た膜タンパク質の部分を除いて、細胞質に触れることはありません。 多くのタンパク質は、本来の機能を発揮するために、折りたたみを助けるシャペロンや、一連の翻訳後修飾を必要としますが、分泌経路はそのすべてを提供することに特化しています。
本日の講義では、タンパク質がどのようにERに翻訳され、小胞の中で、どのように小胞とゴルジ体の間を移動するかを中心に説明します。 これは「細胞の一生」のビデオで見事に描かれています。
小胞体は分泌経路の最初のステップです。 その膜は核外膜と連続しているが、なぜそれが重要なのかは不明である。 なぜなら、タンパク質は核で誕生するわけではないからだ。むしろ、mRNAは細胞質内を漂い、翻訳に興味を持つリボソームに拾われる。 翻訳後翻訳」では、新しいタンパク質は翻訳された後、小胞体に移される。 共翻訳」と呼ばれる興味深い現象では、リボソームは他のタンパク質と同じように翻訳を開始するが、最初の16から30アミノ酸のどこかでシグナルペプチド(別名シグナル配列)にぶつかる。 このシグナルのモチーフは、正電荷を持つアミノ酸が1個、疎水性アミノ酸が6〜12個続くものが多い。 このモチーフは、シグナル認識粒子(SRP、「リボ核タンパク質」またはRNAとタンパク質のハイブリッド分子)に認識され、結合してリボソームが翻訳を続けるのを阻止する。 リボソームとSRPの複合体は、小胞体膜上のSRP受容体に出会うまで翻訳を停止する。 このとき、SRPとその受容体はそれぞれ小胞体膜のGTP1分子と結合し、相互作用が強まるらしい。 幸運なことに、この現象はすべて、ER膜を横断するチャネルを形成するタンパク質複合体であるSec61トランスロコンの近傍で起こっている。 トランスロコンは実際には3種類のタンパク質(遺伝子:SEC61A1またはSEC61A2、SEC61B、SEC61G)の複合体で、そのうちSec61aサブユニットには膜をまたぐ10個のαヘリックスがあり、これがチャネルを形成しているのだ。 リボソームが膜に結合すると、翻訳を続け、シグナルペプチドを押し出し、最終的にはタンパク質全体がチャネルを通ってER内腔に入る。 翻訳が停止すると、SRPとSRP受容体はGTPを加水分解して、互いにリボソームの荷物を解放し(最初の結合は下り坂だったので、これはGTPのエネルギーを必要とする)、シグナルペプチダーゼが新生タンパク質からシグナルペプチドを切断し、タンパク質はER内で自由に折りたたみを開始する。 オリゴ糖転移酵素は新生タンパク質中のアスパラギンに糖鎖を付加する酵素で、トランスロコン複合体の一部であり、新しいタンパク質がまだ翻訳されている間に実際に糖鎖付加を実行する。 つまり、糖鎖付加を「翻訳後修飾」と呼んでいますが、この場合、実際には翻訳中に行われているのです。 また、タンパク質によっては、正しい構造を得るために、完全に翻訳されてからフォールディングを開始する必要がある。もし、N末端部分が内腔に入った途端にフォールディングを開始させたら、全体として間違った構造になってしまうだろう。 これを防ぐために、シャペロンであるBiPがタンパク質と結合して、しばらくの間アンフォールド状態を維持することがあるのです。 BiPは、ミトコンドリア標的化プロセスにおけるHsc70(先週参照)のように、タンパク質を直線状に保つために噛み砕くもう1つのパックマンだと想像してください。
ここで、そのビデオをご覧ください。 その後、すぐに紹介する、より複雑なシナリオに移行します。 参考までに、このビデオでは、上記の説明には含まれていない2つの「議論を呼ぶ」事柄が描かれています。 (1)シグナルペプチドが膜で分解されること、(2)翻訳前/翻訳後にチャネルを止める「プラグタンパク質」である。
分泌経路を通ることがわかっているすべてのタンパク質は、タンパク質が細胞内のどこにあるかを調べる局在化実験によって、そこに特定されたものです。 ERについての奇妙な事実は、細胞をミキサーにかけると、その後ERがそれ自体に再接続し始め、核に付着していない小さな「ミクロソーム」を形成し、ERの連続した気泡を形成することです。 そして、タンパク質を分解するプロテアーゼと、ER膜を可溶化する界面活性剤で、ゲームを始めることができる。 目的のタンパク質が翻訳されていると仮定して、(1)プロテアーゼ処理に耐えられるが、(2)プロテアーゼ+洗剤処理に耐えられない場合は、分泌経路タンパク質であることを確認することができます。 (1)の場合はERの中で保護されていたが、(2)の場合はERを溶かしたからプロテアーゼに食われた、という理屈だ。 8101>
また、このような手法を使って、新しいタンパク質のうち70アミノ酸しか翻訳されないと、そのタンパク質がERで終わるには手遅れになることを突き止めた人々もいます。 シグナルペプチドは最初の16-30アミノ酸にあり、ERへの移動はSRPの存在に依存していることを思い出してください。 リボソームの翻訳速度は予測可能なので、リボソームにいくつかのmRNAの翻訳を開始させ、一定時間待ってからSRPを加えて、SRPがもはやその役割を果たせなくなるまでにどれだけ翻訳が行われるかを確認したのです。 実際、細胞膜の膜タンパク質(クラス02参照)でさえ、分泌経路で処理される。 これらの多くは、数個から数十個の膜貫通ドメイン(それぞれ20-25個の疎水性アミノ酸)を持ち、正しい順序と方向で挿入されなければならない(例えば、イオンチャネルやトランスポーターは、細胞の中へ、あるいは外へ、正しい方向に向けたいものである)。 したがって、これらのタンパク質を膜に正しく挿入するために、さまざまな巧妙な生物学的メカニズムが存在します。 8101>
ここでトートロジーですが、いくつかのタンパク質は、膜内での向きを決定するトポジェニック配列を持っています。 この配列は2種類のシグナル配列で構成されています。
- ストップトランスファー配列(なぜかSTAと略される)は、タンパク質の中央部にある22-25個の疎水性アミノ酸配列で、アルファヘリックスを形成しています。 この配列に出会うと、膜に押し込まれ、タンパク質の残りの部分の翻訳は細胞質で継続される。
- シグナルアンカー配列(SAと略す)も22-25aaの疎水性αヘリックスであるが、その左または右に正に帯電したアミノ酸が3個ほど連なっている。 シグナルペプチドと同様にSRPによって認識され、リボソームをERに運んでくる。 しかし、シグナルペプチドとは異なり、このαヘリカル配列はER膜に挿入されることになる。 挿入の方向は、3つの正電荷を持つアミノ酸によって決定される。 正電荷は常に細胞質側を向いていなければならないので、疎水性配列の後(つまりC末端)に来ると、タンパク質はC末端を細胞質に向けられ、疎水性配列の前(つまりN末端)に来ると、タンパク質はN末端を細胞質に向けられ、終了する。
この2つのシグナルをビルディングブロックとして、一連の停止転移配列とシグナルアンカー配列を持つタンパク質が、ミシンで縫うように膜に一連の前後膜貫通ドメインを作ることが想像できます。 8101>
- タイプIはシグナルペプチドがあるだけで、あとは真ん中にストップトランスファーが1つある。 したがって、その(親水性の)N末端は内腔に、その(疎水性の)中間は膜に、その(親水性の)C末端は細胞質にあることになる。 他のタンパク質と同じように始まるが、真ん中にシグナルアンカー配列があり、++アミノ酸が先に来て、疎水性シリーズが後に来る。 このため、タンパク質は翻訳の途中で移動し、すでに翻訳されているN末端部分は細胞質に突き出し(++は細胞質にとどまる必要があるため)、これから翻訳されるC末端部分は直接ERに翻訳されることになるのです。
- III型はII型と同じで、シグナルペプチドはなく、シグナルアンカーが中央にあるだけですが、この場合は疎水性配列の後に+αが来るので、向きが逆になります。 そのため、N末端がERに、C末端が細胞質にある。 タイプIIとは逆に、タイプIと同じであるが、ERで切断されるシグナルペプチドがない。
- タイプIVまたは「マルチパス」タンパク質は、シグナル配列と停止伝達配列が交互に並んでいる。 これらは明らかに1つ以上の「タイプ」であるが、組み合わせの想像力が許す限り、それほど多様性はない。 最初のシグナル配列の向きによって、N末端が細胞質側と小胞体側のどちらに位置するかが決まり、停止転移配列とシグナルアンカー配列の総数によってC末端がどこに位置するかが決まる:偶数=N末端と同じ側、奇数=N末端と反対側。 STA配列とSA配列は厳密に交互に並んでいなければならない。例外として、最初のシグナルアンカー配列がN末端を細胞質側に向けている場合は、2つのシグナルアンカー配列でスタートしてもよい。 IVa型はN末端が細胞質側にあり(つまりII型タンパク質のように始まる)、IVb型はN末端が内腔側にある(III型タンパク質のように始まるが、ERに戻るために別のSA配列を持っている)。 Class 02のGLUT1はIVa型である。
- GPIアンカー型タンパク質は5番目のタイプだがType Vとは呼ばれず、シグナルペプチドで始まり、疎水性のC末端で終わり、膜に埋め込まれたままである。 この疎水性末端は切断され、GPIに置き換わるが、これも膜に埋め込まれたままである。 PrPもその一つで、詳しくは後述します。
ここまでで、タンパク質がどのようにして小胞体内腔や小胞体膜に入り込むかを説明してきました。 ほとんどのタンパク質は数分以内にERを離れ、ゴルジ体に向かう小胞で運ばれ、その後、リソゾームや細胞膜に排泄される。 ゴルジ体から小胞体へ逆行するのが逆行性輸送である。
どちらのタイプの輸送も、膜結合小胞の中で行われる。 これらの小胞は、どこから来るにせよ膜から芽を出し、後にどこへ向かうにせよ膜に融合します。上の「Life of the Cell」ビデオの2分25秒あたりから、その様子が美しく描かれています。 小胞が形成される本体は「ドナー区画」であり、後に融合する先は「アクセプター区画」です。
出芽のプロセスでは、膜のGタンパク質がコートタンパク質をリクルートすることが必要です。 具体的には、前向きの輸送にはGタンパク質Sar1(遺伝子:SAR1A)がCOPII(「コップ2」と発音する)を、逆向きの輸送にはARFのGタンパク質がCOPI(「コップ1」と発音する)をリクルートしている。 これらのGタンパク質は、GEFがGDPと入れ替わりにGTPをロードすると、この仕事をするために活性化されます。
したがって、例えば前向性輸送のステップは次のようになります。
- Sec12-GEF (Sec はsecretoryの略) がSar1にGTPをロードします。 GDPと結合しているときは、Sar1はドナーコンパートメントをただ漂っているだけですが、GTPと結合すると、構造変化を起こして、それまで埋もれていたN末端の疎水性テールが突出し、膜に張り付くようになり、COPIIタンパク質がそのテールをとても好むので蓄積され始めます。 同時に、輸送が必要な膜結合タンパク質(細胞質部分に結合部位を形成するDXE(アスパラギン酸-グルタミン酸)アミノ酸配列で識別される)が、新しく形成される小胞に集められる。 膜結合タンパク質は受容体として働き、ゴルジ体に結合している内腔タンパク質が、小胞が形成されると、その凹んだ空間にたむろするように誘導するのである。
- COPIIが十分に到着すると、小胞は芽を出し、その時点でSar1はGTPを加水分解し、疎水性尾部を自分自身に吸い戻し、COPIIを切り離すためのエネルギーを提供します。
- さて、うまく説明できない(あるいは理解できない?)理由により、COPII の被膜は分解され、被膜の下に、小胞の標的化を指示する受容体が露出します。 小胞が目的地に到着すると、小胞膜に埋め込まれたRab-GTPが受容体区画の膜に埋め込まれたRabエフェクターと相互作用する。 横目で見ていると、興味が湧いてくる。 まもなく小胞は膜に融合する。
- 小胞と標的膜の両方に存在するSNAREタンパク質(それぞれV-SNAREとT-SNARE)は、膜をさらに近づけるために相互作用する。 この例では、VAMP(VAMP_遺伝子)をV-SNAREとし、Syntaxin(STX__遺伝子)とSNAP25(SNAP25遺伝子)をT-SNAREと考えることにする。 SyntaxinとSNAP25は共に膜タンパク質であり、Syntaxinは1つのαヘリックス、SNAP25は2つのαヘリックスを持ち、全て細胞質側に存在する。 このαヘリックスがVAMPとの相互作用を駆動している。 相反する側のαヘリ同士が非常に強い親和性を持っているため、膜が融合するほど接近する。 いったん融合が起こると、V-SNAREとT-SNAREを再び引き離すには、2つのタンパク質が必要である。 NSF(遺伝子:NSF、NEM sensitive factorの略)とα-SNAP(遺伝子:NAPA)は、可溶性のNSF付着タンパク質である。 NSFはATPaseであり、エネルギー的に上り坂となる複合体の分解を駆動するためにATPを燃やす。
次に逆行性輸送について。 なぜ逆行性輸送があるのでしょうか。
- 膜タンパク質の中には、小胞体でその一生を終え、ゴルジ体で修飾され、再び小胞体に戻る必要があるものがあります。
- また、いくつかの内腔タンパク質のC末端にはKDELアミノ酸配列があり、これはERに留まるように考えられていますが、完全ではありません-時にはゴルジ体に行き着き、その場合はKDEL配列に依存して逆行輸送でERに戻されます。 KDELを認識して結合するタンパク質は、低いpHでのみ結合します。ゴルジ体のpHはERよりも低いので、ゴルジ体でKDELを結合し、より中性pHのERに戻るとそれを放出するのです。 –
- まもなく見るように、ゴルジ体は、さらに下流からの酵素の添加に依存する複数のステージで来ます。 Sar1の代わりにARFを使い、COPIIの代わりにCOPIを使いますが、仕組みは同じです。GTPを搭載したARFは疎水性の尾部を膜に張り付け、COPIの注意を引きます。 COPIには、COPIαとCOPIβという2つの成分があり、どちらもこのKKXXX配列と相互作用して、逆行性輸送に向かう膜結合型タンパク質をリクルートしている。 いくつかのタンパク質はまた、逆行性輸送のためのフラグとなるRR配列(タンパク質内の任意の場所)を持っています。 ゴルジ体は連続しておらず、嚢またはシステルナと呼ばれる別々のサブコンパートメントが積み重なった構造になっています。 区画によって性質が異なり、タンパク質は特定の順序でそこを訪れる。 ERから細胞膜に向かう順に、シス、メディアル、トランス、トランスゴルジネットワークと呼ばれる。
しかし、タンパク質がゴルジ体で成熟すると、ある区画から小胞で芽を出して次の区画に移動するようなことはないのです。 むしろ、新しい酵素が逆行性輸送によって(ゴルジ体鎖のさらに下から)追加されると、すでにある区画が外側に移動して「成熟」するのです。 変でしょう? 小学校、中学校、高校と移動する代わりに、子供時代から思春期までずっと一つの校舎で過ごし、毎年新しい教科書と先生を導入して、あなたとクラスメートが到達した学年にふさわしい環境を維持しているようなものです。
そのため、ゴルジ体内では前向きの輸送はほとんどありませんが、新しい酵素を取り込むための逆向きの輸送は十分にあります。 タンパク質がゴルジ体ネットワークの12カ月のカリキュラムをすべて終えると、最終目的地へ向かうために輸送が行われます。 8101>
- エキソサイトーシス(Exocytosis)- 細胞膜との融合。
- 分泌小胞 – 必要になるまで小胞として細胞内にとどまります。 神経細胞では、活動電位がシナプスへの分泌を要求するまで、ここに神経伝達物質が保管されます。
- ライソゾーム – 誤って折り畳まれたタンパク質が分解される場所。
トランスゴルジネットワークからこれらの目的地への輸送は、上で述べた他の輸送とは異なり、しばしばクラスリン (CLT__ 遺伝子) が関与しています。 出芽する小胞は2層の被膜を持ち、アダプタータンパク質(AP)複合体が内層、クラスリンが外層である。 アダプタータンパク質は、YXXhモチーフ(h = Φ = 任意の疎水性アミノ酸)を持つ標的シグナルを持つ。 クラスリンは、ここに示すようないわゆる「クラスリン・トリスケリオン」形成を行う:

(Image thanks to Wikimedia Commons user Phoebus87)クラスリンはまた、エンドサイトーシス、すなわち細胞外のもの(および細胞膜タンパク質)の小胞が出芽して細胞の中に入って来ることを担っている。 これはクラスリンを介したエンドサイトーシスと呼ばれています。 細胞膜の受容体は非常に頻繁にエンドサイトーシスされます。ホルモン受容体の全集団は、特にホルモンが受け取られるときには、約1時間ごとに入れ替わります。 受容体を小胞に取り込むことは、細胞にとって、入ってきたシグナルを処理できるまで遮断する一つの方法である。
細胞膜のノートでは、嚢胞性線維症について簡単に述べている。 CFTRはABCトランスポーターであり、Cl-を細胞外に送り出す役割を担っている(Na+も取り込む)。 機能欠損変異体では、Cl-を汲み上げることができず、浸透圧の駆動力が失われ、粘液が濃くなり、呼吸障害を引き起こす。 少なくとも127種類のCFTR機能喪失型変異体があり(少なくともNateraが検査した数)、(対立遺伝子の両方が無効な場合)嚢胞性線維症の原因となる。 最も一般的な変異はΔF508で、これはヨーロッパ人のCFTR対立遺伝子全体の約3%、変異型では約70%である。 その1つのフェニルアラニンの損失は、CFTRの構造を変化させ、CFTRをエキソサイト性小胞に向ける二酸の出口コード(アミノ酸D565およびD567)がもはや正しく露出されず、タンパク質が細胞膜に到達することは決してない。 その証拠は、ほとんどタンパク質間相互作用から得られたものです。 というのも、ハンチンチンのタンパク質間相互作用を示す論文はこれまでにも何百と出ているが、誰もそのすべてを信じてはいないし、ハンチンチンが何をするのか、ハンチントン病で何がうまくいかないのかを知ることに、必ずしも近づいてはいないからである。 しかし、Hu教授は、アトラースチンと網様体との相互作用が、ER形成に関与していることをかなり明確に説明できるようになったようだ。 物理的(結合的)相互作用に加えて、「遺伝的相互作用」を示すことができたのが救いである。 遺伝的相互作用」とは、「2つの遺伝子の変異が、それぞれの変異の影響に照らして驚くべき表現型を生み出すことがある」ことを意味する。 この現象は遺伝的相互作用を定義するもので、遺伝子とパスウェイの機能的関係を明らかにすることができる。” .PrP
10年前のものなので、古くなっているものもあるかもしれませんが、Harris 2003 (ft) のPrP細胞生物学のレビューは非常にわかりやすく、参考になりました。 Kim & Hegde 2002も参考になりました。 PrPは分泌経路のタンパク質である。 その最初の22アミノ酸(MANLGCWMLVLFVATWSDLGLC)はシグナルペプチドであり、ERへの共変換を引き起こす。 通常、PrPはC末端でGPI結合を受けるだけで、膜の外側に固定される。 しかし、アミノ酸111-134(HMAGAAAAGAVVGGLGGYMLGSAM)は一種の弱いシグナルアンカー配列(タイプII、++アミノ酸がシグナルアンカーの前に来る)で、常にではないが時には膜貫通ドメインとなり、C末端を内腔側に反転させる。 さらに紛らわしいことに、この配列は反転せずに膜貫通ドメインとして終わることもあり、その場合、N末端は内腔にある。 つまり、PrPには3つの膜トポロジーがある。通常のGPIアンカー型と、Harris 2003 Fig 3に描かれているような2つの膜貫通型である:
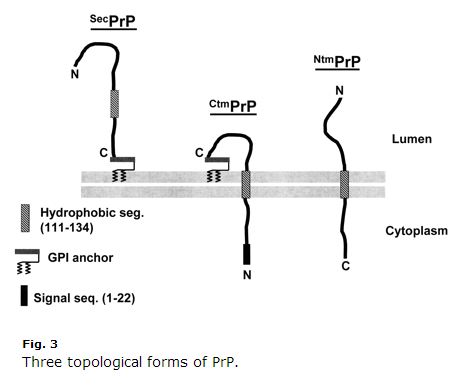
CtmPrPがいかに奇妙であるかに注目してほしい。 膜貫通型でありながらGPIアンカー型でもあり、N-末端のシグナルペプチドは決して切断されない。 通常、膜貫通型はPrP全体の<10%である。 GSSを引き起こす2つの変異(A117VとP105L)により、CtmPrPの割合が20-30%に増加することもある。 これらの3つの形態のうち、CtmPrPは毒性があり、プリオン形成に関与しているかもしれないという十分な証拠がありますが、ほとんどの遺伝的プリオン病変異(FFI D178Nを含む)は、PrPの膜トポロジーやCtmPrPの割合に影響しないようです
PrPがゴルジ体を経由してから、細胞膜にターゲットされるのですが、その際、CtmPrPは細胞膜に存在することが分かっています。 しかし、Harris教授によれば、PrPはそこに留まっているのではなく、クラスリンを介したエンドサイトーシスにより、細胞内を60分ごとに循環し、そのたびにいくつかの分子が切断されるという。 銅は、このPrPのエンドサイトーシスを刺激する。 ほとんどの遺伝的プリオン病の突然変異は、PrPの局在を変化させる。通常、突然変異が存在する場合、細胞表面上のPrPは少なくなり、ERに多く蓄積される。