14.1 Introduction to Neuropeptides and Nitric Oxide
古典的神経伝達物質(例:グルタミン酸やACh)はシナプス前の放出部位とシナプス後の受容体のクラスター間で情報の方向転換を行うことにより機能します。 このプロセスは一般に空間的によく組織化されており、隣接するシナプス間の伝達物質の「スピルオーバー」はごく限られたものである。 神経ペプチドと一酸化窒素(NO)を介した伝達では、状況はまったく異なる。 これらの分子は情報の流れの方向性を無視し、その代わりに放出された地点からある範囲の領域に影響を及ぼす。 この特徴は、ペプチドホルモンが血流に放出され、遠方の部位に運ばれて効果を発揮することに似ている。 例えば、シナプス後神経細胞で産生されたNOは、シナプス前神経細胞や隣接する他の神経細胞へ拡散し、その後の伝達物質の放出に影響を与えることができる。 この特性は、信号が古典的な神経伝達の方向性とは逆方向(後→前)に伝わるため、逆行性伝達と呼ばれている。
14.2 神経ペプチド
多くの神経ペプチドはもともとホルモン(例えばソマトスタチンやコレシストキニン)として記述されたが、一度特徴づけられた後、CNS内のニューロンにも見出されるようになった。 神経ペプチドは一般に、ゆっくりとした発現と長い持続時間を持つ神経細胞反応を引き起こす(図14.1)。また、神経ペプチドの受容体はすべてGPCR(G-protein coupled receptor)クラスに分類される。 比較のために、図14.1にイオン性受容体と神経ペプチドを作用させた古典的な神経伝達物質(グルタミン酸)の典型的な反応を示す。 グルタミン酸放出ニューロンであるニューロン1(緑色)で誘発される活動電位は、グルタミン酸を介したシナプス伝達で典型的な高速(5ミリ秒)のEPSPを生成する。 一方、神経ペプチドを放出するニューロン2(紫色)の活動電位は、遅いオンセット(ピークまで5秒)と長い持続時間(10秒)のEPSPを発生させる。 すべての神経ペプチド受容体はGタンパク質結合型であるため、これらの遅いEPSPは神経ペプチドの作用に典型的なものです。
図14.1
さらに、多くの神経ペプチドはシナプス後神経細胞に明らかな電気生理学的変化を与えない。 例えば、ニューロン3(図14.1;ピンク)の活動電位は、他の手段で神経ペプチドが放出されたことを確認できても、シナプス後ニューロンに何の反応も生じません。 しかし、Cと書かれたパネルに示された例では、シナプス後ニューロンに変化が生じていることがわかります。 まず、ニューロン1を刺激してグルタミン酸応答を測定すると(C1)、典型的な応答が見られる。 ニューロン3を刺激すると、先ほどと同様に応答は得られない(C2)。 しかし、ニューロン3を刺激した後に再びニューロン1を刺激すると、シナプス後のニューロンで測定されるEPSPが増強される(C3)(元のEPSPを実線、ニューロン3刺激後のEPSPを破線で示す)。 このように、ニューロン3から放出された神経ペプチドは、別の神経伝達物質に対するシナプス後ニューロンの反応を変化させたのである。 このような神経ペプチドは、第二の伝達物質の作用を増強または抑制する作用があるため、ニューロモジュレータと言われている。 このようなヘテロシナプス可塑性の他の例については、第7章第2節で説明する。
14.3 ペプチドのファミリーによる分類
神経ペプチドは、そのアミノ酸配列の類似性に基づいてファミリーに分類できる(表Iおよび表II)。
表I
神経ペプチドファミリー
タキキニン:サブスタンスP、ボンベシン、サブストレート
インシュリン:インシュリン、インシュリン様成長因子
ソマトスタチン:ソマトスタチン、膵ポリペプチド
ガストリン:。 ガストリン、コレシストキニン
オピオイド:オピオコルチン、エンケファリン、ダイノルフィン
例えばオピオイドは、それぞれのN末端に見られるTyr-Gly-Gly-Phe–(表II)の同一アミノ酸配列によりファミリーとしてグループ化されています。
| Table II Opiate Family-Sequence Identity in Italics |
|||
| 名称 | アミノ酸配列 | ||
| Leu-> | |||
| Opiate family-> Opiate family-Sequence Identity in Italics |
Table II Opiate Family-Sequence Identity in Italicsエンケファリン |
Tyr-Gly-Gly-Phe-Leu-OH | |
| Met-enkephalin | Tyr-Gly-Gly-Phe-Met-OH | ||
| Beta- | Tyr-Gly-Gly-Phe-OH | Met-enkephalin | Tyr-Gly-Gly-Phe-Met-Thr-Ser-Glu-Lys- Ser-Gln-Thr-Pro-Leu-Val-Thr-Leu- Phe-Lys-Asn-Ala-Ile-Val-Lys-Asn-Ala- His-Lys-Gly-Gln-His-OH |
| Dynorphin | Tyr-Gly-Gly-Phe-Leu-Arg-Ile-Arg- Pro-Lys-Leu-Lys-Trp-Asp-Asn-Gln-OH |
||
14.4 生合成と制御
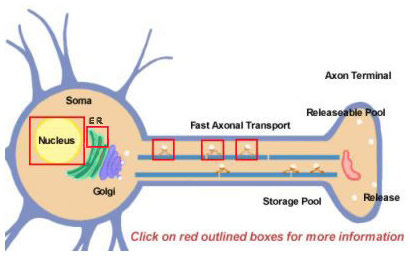
Figure 14.2
神経ペプチドはタンパク質分解処理により大きな前駆体から誘導されます。 これらはすべて最初にソーマの中で合成される(図14.2)。 前駆体は最初、細胞体近くの小胞体に付着したポリリボソーム上で翻訳されて形成される。 そこからゴルジ体を経て、グリコシル化などさらなる修飾が行われる。 そして、分泌顆粒となり、高速軸索輸送により末端まで運ばれる。 しかし、高速というのは相対的な表現であり、いくつかの神経ペプチドは比較的長い距離を移動しなければならないからである。 放出可能な神経ペプチドのプールを補充するためには、何時間もかかるかもしれない。 神経末端まで輸送される間に、小胞内にパッケージされたプロテアーゼが前駆体の神経ペプチドを最終的な成熟型に切断し始める。 前駆体は生物学的に不活性であるため、この処理は神経ペプチドの活性化には不可欠である。 小胞内では少なくとも3種類のプロセシングが行われる(図14.2;詳しくはボックスをクリックして下さい)。 まず、エンドペプチダーゼが前駆体を切断し、2つの新しい産物を生成する(軸索の最初のボックス)。 多くの前駆体では、この切断は塩基性残基(LysやArgなど)の後に起こり、トリプシン様プロテアーゼによって達成される。 次に、すべての神経ペプチドではないが、カルボキシペプチダーゼが新しいペプチドのC-末端から塩基性残基を切断する(軸索の2番目のボックス)。 最後に、第3の酵素が、多くの神経ペプチドのC末端に存在するGly残基のCOOH(カルボキシ)基をNH2(アミド)基に変換し、成熟した活性型の神経ペプチドを生成する。
14.5 神経ペプチドの多様性を生み出すには複数のメカニズムが利用される
ほとんどのタンパク質は、核内で前駆体RNAから最終形態にスプライシングされるmRNA分子から生成されます。 スプライシングの違いは、神経細胞がさまざまな種類の神経ペプチドを生成するために用いる方法の一つである。 mRNAのサブスタンスKの部分を差動スプライシングして、結果として生じるmRNAがサブスタンスPのみを生成できるようにすることができます(図14.2の核上のボックスをクリック)
Figure 14.3
神経ペプチドはタンパク質分解処理によって長い前駆タンパク質から生産されています。 優れた例は、ペプチドのオピオイドファミリーである(例えば、プロオピオメラノコルチコトロピン、POMC及びエンケファリンのプロセシング;図14.3参照)。 前述のように、タンパク質分解処理は輸送小胞内で行われ、最も頻繁に塩基性残基(アルギニンおよびリジン)のN末端側で前駆体を切断することにより起こるが、他の切断部位も同定されている。 エンケファリン前駆体タンパク質のように、同じ最終的な生理活性ペプチドのコピーが複数存在する例もある。 図14.3の上部に示した1つの前駆体分子は、Met-エンケファリン(ME)の6つのコピーとLeu-エンケファリン(LE)の1つのコピーを含んでいる。
したがって、多様性は、差動スプライシングによって切断部位の配列を変更すること、輸送小胞に異なるプロテアーゼ(切断のための異なる配列を認識)を生成および/またはパッケージングすること、あるいは翻訳後修飾によってタンパク質分解部位を隠すことによって生成することが可能である。 後者の例としては、特定の切断部位が、プロテアーゼがその部位にアクセスするのを立体的に阻止する糖鎖の付加によって隠されることがある。 もう一つの共通の発見は、一つの前駆体分子がいくつかの異なった神経ペプチドを含んでいることである(図14.3参照)、したがって、どのような処理が行われるかが、最終的にニューロンから放出される神経ペプチドを決定する。 POMC前駆体タンパク質は切断されてACTH(オレンジ)とβ-リポタンパク質(水色)になり、それぞれはさらに切断されて追加の生理活性神経ペプチドを生成することができる(図14.3)。 例えば、β-リポ蛋白質(水色)は、さらに切断されてγ-リポ蛋白質(緑色のストライプ)とβ-エンドルフィン(濃紺)の両方になることができる。 このように、前駆体タンパク質がどのように処理されるかによって、劇的に異なる生物学的反応を示す神経ペプチドを生成することができるのである。
14.6 放出
Figure 14.4
ペプチドはカルシウム依存性のエキソサイトーシスにより放出されるが、古典的な神経伝達物質の放出とはいくつかの重要な違いがある。 一般に、神経ペプチドを放出する小胞は、低分子神経伝達物質(例えば、グルタミン酸)を含む小胞よりはるかに大きく、放出にシナプス前特異化を必要としない(図14.4の電子顕微鏡写真を参照)。 グルタミン酸を含む小胞とは対照的に、大小胞は膜にドッキングしていないように見える。 この観察は、低分子神経伝達物質が(シナプス結合部で)短時間の局所的な効果をもたらすのに対し、神経ペプチドはゆっくりと長く続く効果をもたらし、放出部位の周囲の広い範囲をしばしば包含するという考えと一致する。 また、神経ペプチドはシナプスの局所ではなく、細胞のソーマで合成されるため、持続的な放出によって供給が枯渇した場合、放出可能なプールを補充するのに数時間かかるかもしれないことを思い出してほしい。 例えば、運動神経細胞は、細胞体が脊髄にあり、シナプスは足にあるが、軸索の長さは1メートルもある。 軸索の高速輸送を利用すれば、新たに合成された神経ペプチドがソーマからこのシナプスに到達するのに1日以上かかる可能性がある。 また、β-エンドルフィンのような内因性の鎮痛神経ペプチドは、持続的な刺激によって「使い果たされて」しまい、もはや内因性のメカニズムによって痛みを制御できない状況に陥る可能性があることも明らかであろう。
典型的な成熟神経細胞は、しばしば1つの低分子神経伝達物質と1つ以上の神経ペプチドを放出します(図14.4の例のように)。 複数の神経ペプチドが放出される場合、それらはほとんどの場合、同じ1つの前駆体分子から来ている。 例えば、脊髄運動ニューロンからAChとカルシ トニン遺伝子関連ペプチドが共に放出される例がある。 CGRPはアデニル酸シクラーゼを活性化し、 cAMPレベルを上昇させ、ニコチン性ACh受容体のACh活性化 によって生じる収縮力を増強させる。 この場合、神経ペプチドは図14.1で説明したように調節性である。 しかし、この例では、EPSPの大きさを増加させるのではなく、筋収縮を増強させる効果がある。 どちらの例でも、増強された反応は、放出された神経伝達物質の一定量に対するシステムの感度が増加することに起因する。
14.6 作用の終了
神経ペプチドは細胞外空間からゆっくりと除去される;この特徴は、その効果が比較的長く続くことにも寄与している。 不活性化は拡散と細胞外のプロテアーゼによる分解の両方によって起こる。 ペプチドの作用を停止させる方法として、ペプチドの再取込みを示す証拠は見つかっていない。
14.7 Receptors are all G-protein Linked
すべての既知の神経ペプチド受容体は、細胞内セカンドメッセンジャーのレベルを変化させることによってその効果を発揮する。 これらの受容体は7つの膜貫通タンパク質で、Gタンパク質(GPCR)を介して他の細胞内酵素の活性化を変化させるために連結されています。 この性質は、神経ペプチドがゆっくりとした反応を誘導することと一致し、調節的な役割を果たすのに適している。 低分子伝達物質と神経ペプチド分子伝達物質の重要な違いの1つは、低分子神経伝達物質(グルタミン酸など)で測定されるマイクロまたはミリモルの親和性に対し、神経ペプチド受容体は高い結合親和性(ナノモル)を持つことである。 神経ペプチドはシナプスの限られた容積の中で方向性を持って放出されないため、その濃度はあまり高くならず、受容体はこれらの小さな濃度に反応するために高い親和性を持たなければならない。 この高い親和性は、神経ペプチドとその受容体の解離を遅らせ、また、これらの分子の持続的な効果に寄与している。
14.8 一酸化窒素(NO)
一酸化窒素は新しいクラスのガス状メッセンジャー分子の創設メンバーとして広く注目されている。 一酸化窒素は、狭心症の緩和のために、舌下ニトログリセリンが血管拡張を増加させるために生成する活性分子である。 NOの他の重要な生物学的効果は、現在認識されています。 例えば、神経系では、NOは脳血流の調節、神経伝達の調節、および様々な病的状態に伴う毒性に重要である。
14.9 NOの特徴
NOの性質のまとめ
- 膜を自由に拡散する気体
- 半減期が短い。
- 反応性の高いフリーラジカル
- 高濃度では有毒
NOは短命のガスで、比較的安定した麻酔ガスの亜酸化窒素(笑気)と混同しないようにすること。 NOは実際にはフリーラジカルであり、したがって非常に反応性の高い化合物である。 その毒性は、NOがスーパーオキシドと反応して破壊的なラジカルであるペルオキシナイトレートを生成することに起因すると考えられている。 NOはエキソサイトーシスによって放出されず、従来の受容体分子を介して作用しないため、非従来型の神経伝達物質と考えられている。
前述したように、神経細胞のコミュニケーションに関する典型的な説明では、伝達は一方向であると考えられている。 シナプス前神経伝達物質が放出され、それがシナプス後神経細胞に変化をもたらす。 シナプス後神経細胞で産生されたいくつかの化合物(神経ペプチドやNOなど)は、局所環境に拡散し、周囲の細胞に影響を与える。 NOは自由に拡散する気体であるため、生成された地点からどの方向へも素早く移動する可能性がある。 例えば、グルタミン酸受容体の刺激によりシナプス後細胞で生成されたNOは、局所環境中に放出され、シナプス前細胞に信号を送り返す可能性があります(図14.5)。 このような活動は、信号がシナプス後神経細胞からシナプス前神経細胞へ逆行することから、逆行性シグナル伝達と呼ばれる。
図14.5
図14.6
NO合成の主要点をまとめた図が14.5, 14.6, 14.7, 14.7 である. この例では、シナプス前末端から放出されたグルタミン酸がシナプス後膜のNMDA受容体に結合し、受容体を開かせてCa2+の流入を許可しています。 このCa2+はカルモジュリンを活性化し、カルモジュリンは一酸化窒素合成酵素(NOS)に結合して活性化させる。 NOSはアルギニンを基質として、NOと第二反応生成物であるシトルリンを生成する。 NOはその後、環境中に自由に拡散し、最初にグルタミン酸を放出したシナプス前末端や、局所環境中の他の細胞と相互作用することができる。 細胞内Ca2+を上昇させるいかなるプロセスも、NOSを活性化する可能性があることを認識すること。 グルタミン酸によるNMDA受容体の活性化は、よく知られた例のひとつに過ぎません。
図14.7
14.10 一酸化窒素合成酵素(NOS)による合成と放出
NOは一酸化窒素合成酵素(NOS)により産生されます。 この酵素は神経細胞の亜集団(大脳皮質では神経細胞の1-2%)に存在し、ほとんどの内皮細胞に存在する。 図14.5、14.6、14.7に示すように、これらの細胞におけるNOSの少なくとも1つの形態は、活性化についてカルシウムとカルモジュリンに依存している。 また、チトクロームP-450に類似した補酵素を含んでいる。 これらの補酵素はNADPH(ニコチンアミドアデニンジヌクレオチドリン酸)、FAD(フラビンアデニンモノヌクレオチド)、FMN(フラビンモノヌクレオチド)である。 これらの補酵素は、不安定で短命な生成物であるNOを生成する電子の授受に必須である。 この反応の基質は一般的なアミノ酸であるアルギニンであり、生成物はシトルリンとNOである(図14.5)。 NOは短寿命であるため、直接測定することは極めて困難である。 しかし、実験的な準備では、神経内Ca2+を増加させNOSを活性化するNMDAの適用と、NOSの酵素活性の副産物であるシトルリンの生成との間に優れた相関がある(図14.8参照)。 シトルリン産生は、NO産生の信頼できる指標である。 また、メチルアルギニンと呼ばれるNOSの代謝されない基質を細胞に与えることにより、シトルリン(およびNO)の産生をブロックすることも可能である(図14.9)、そのような化合物は、NOの産生を減少させ、その生物学的効果を終了させるために使用されてきた。
|
図14.8 |
図14.9 |
14.11 NOの「受容体」
図14.10
NOの主要ターゲットの1つは、酵素グアニリルシクラーゼのように思われる。 この発見は、NOS産物であるシトルリンの蓄積をモニターしながら、酵素グアニリルシクラーゼの産物であるcGMPの産生をモニターすることで間接的に行われました(図14.8および図14.9)。 この実験では、NOSを活性化するために、神経細胞の調製液にNMDAが加えられた。 NOSはアルギニンを基質としてNOを生成するが、前述のようにメチルアルギニンのような加水分解しないアナログを添加すると、シトルリンとcGMPの蓄積が同じように用量依存的に終了することがわかった。 これらの強い相関関係から、グアニリルシクラーゼがNOの主要な標的であることが発見された。
グアニリルシクラーゼは、その構造の一部として鉄分子を伴うヘム環を持つという珍しい酵素である。 NOはヘム中の鉄に結合してこの酵素を活性化し、酵素の構造変化を通じてGTPからサイクリックGMPの生産を開始する(図14.10)。 cGMPは次にcGMP依存性タンパク質キナーゼおよび以下に述べる他の酵素を活性化する。 cGMP依存性プロテインキナーゼの活性化によって生じる様々な作用は、現在ようやく解明されつつあるところです。
14.12 NOの生物学的効果
NOは様々な生物学的効果をもたらす。 残念ながら、神経系における細胞プロセスの調節におけるNOの役割については、特に知られていない。 血管系の調節におけるNOの役割はよく知られているが、神経系でも同様に重要な役割を果たしているようである。
14.13 血管拡張剤
図14.11
この画像の拡大図を見るにはここをクリック
通常の状況下で、NOは脳血管系の血流制御に寄与している。 脳のより活発な領域に必要な栄養素を供給するために、迅速なフィードバック機構が必然的に存在する。 これは、脳のエネルギー貯蔵量が少ないために必要な機構である。 NOは、持続的に活動しているNOSを含む神経細胞で産生される。 このような状況では、NOの産生を引き起こすことが知られているNMDA受容体が活性化されやすくなります。 NOは、神経細胞の活動が活発な局所的な領域から周囲の微小血管に拡散し(図14.11)、血管拡張と血流増加を引き起こす。
NOが血管拡張をもたらす正確なメカニズムはまだ定義されていませんが、平滑筋細胞におけるcGMP依存性プロテインキナーゼの活性化が、血管の弛緩を引き起こすことは知られています。 NOの主要な標的の一つがグアニリルシクラーゼ(cGMPを産生し、cGMP依存性プロテインキナーゼを活性化する)であることから、NOの血管拡張作用の主要経路の一つは、cGMP依存性プロテインキナーゼを介していると推測される。 このキナーゼの活性化は、間接的に平滑筋細胞内のCa2+レベルの低下をもたらし、その後、ミオシン収縮装置の脱リン酸化を引き起こし、弛緩を引き起こす(図14.12)。 平滑筋細胞では、NOはまた、おそらくK+チャネルを活性化することによって細胞を直接的に過分極させ、Ca2+チャネルの二次的な閉鎖を引き起こし、これも筋弛緩をもたらすようである。 このように,NOの主な機能は,神経細胞の活動レベルと局所的な脳血流の変化を統合し,代謝の活発な組織への適切な血流を維持することにあると考えられる.
図14.12
14.14 Neuromodulator
NOも局所的に拡散するメッセンジャーとして作用すると考えられている。 NOSを含む細胞のCa2+を上昇させる作用、例えばグルタミン酸によるNMDA受容体の刺激などによって産生される。 その後、グアニリルシクラーゼが活性化され、cGMPが産生されることにより、NOの産生は様々な二次的プロセスに影響を与える。 例えば、イオンチャネルの直接的な調節、cGMP依存性プロテインキナーゼの刺激、cAMP-ホスホジエステラーゼのアップレギュレーションまたはダウンレギュレーションなどである。 さらに、Ca2+チャネルのアップ/ダウン制御、興奮性の増大(神経細胞の発火率の上昇)、神経伝達物質放出の増大/減少、神経細胞の形態変化など、下流への影響も多岐にわたります。
14.15 毒性
過剰のNOは細胞に対して毒性がある。 しかし、NOの毒性にはパラドックスが存在する。 NOを大量に生産する細胞は、その毒性作用に対して耐性がある。 例えば、マクロファージや好中球は、腫瘍細胞や細菌を殺す仕組みとして、NOの毒性を利用している。 しかし、NOを産生する細胞は、どちらもNOの毒性に弱い。 この知見は、中枢神経系の神経細胞にも当てはまります。 ハンチントン病やアルツハイマー病などの病気、あるいは急性脳梗塞や外傷の後では、過剰なグルタミン酸が脳内の神経毒性を誘導し、神経細胞死の主因になると考えられている。 NOは過剰に生成されると毒性を示すため、この神経細胞消失に何らかの役割を果たすと考えられている。 興味深いことに、これらの疾患に罹患した脳の変性領域では、NOSという酵素の染色が陽性である細胞が温存されている。 これらの細胞の抵抗性は、上述の免疫細胞の抵抗性と類似しているようである。
知識を試す
- 問題1
- A
- B
- C
- D
- E
神経ペプチドとはシナプス端末に存在しているからである。
A. 末端で合成される
B. 軸索の高速輸送によって運ばれる
C. 拡散によって運ばれる
D. 遅い軸索輸送によって運ばれる
E. 細胞外から取り込まれる
神経ペプチドがシナプス末端に存在する理由は、以下の通りである:
A. 末端で合成される。 この回答は不正解です。
ペプチドやタンパク質の合成に必要な合成装置は、軸索末端には存在しない。B. 軸索の高速輸送によって運ばれる
C. 拡散によって運ばれる
D. 遅い軸索輸送によって運ばれる
E. 細胞外から取り込まれる
神経ペプチドがシナプス末端に存在する理由は、以下の通りである:
A. 末端で合成される。
B. 高速軸索輸送によって運ばれる この回答は正解です!
神経ペプチドは細胞体で合成され、小胞で処理され、高速軸索輸送によって微小管に沿って軸索末端に運ばれる。C. 拡散によって運ばれる
D. 遅い軸索輸送によって運ばれる
E. 細胞外から取り込まれる
神経ペプチドがシナプス末端に存在する理由は、以下の通りである:
A. 末端で合成される
B. 軸索の高速輸送によって運ばれる
C. この答えは間違っています。
また、拡散は短い距離(数ミクロン)で分子を動かすには優れたメカニズムですが、神経細胞のソーマと軸索の末端を分けるような距離で分子を動かすには非効率的です。D. 遅い軸索輸送によって運ばれる
E. 細胞外から取り込まれる
神経ペプチドがシナプス末端に存在するのは、次のような理由による:
A. 末端で合成される
B. 軸索の高速輸送によって運ばれる
C. 拡散によって運ばれる
D. この答えは不正解です。
また、末端への神経ペプチドの供給をできるだけ早く補充することが重要です。 この例では、より速い方が良い。E. 細胞外から取り込まれる
神経ペプチドがシナプス末端に存在するのは、次のような理由からである:
A. 末端で合成される
B. 軸索の高速輸送によって運ばれる
C. 拡散によって運ばれる
D. 遅い軸索輸送で運ばれる
E. 細胞外空間から取り込まれる この回答は不正解である。
神経ペプチドを細胞外空間から取り出す取り込み機構は知られていない。 その作用機構は拡散と細胞外プロテアーゼによる酵素分解で終了する。
- 質問2
- A
- B
- C
- D
- E
A. 寿命が長い
B. 膜透過性
C. 非反応性
D. 笑気ガスとも呼ばれる
E.
一酸化窒素:
A. この回答は不正解です。
NOは半減期が秒単位で測定され、非常に不安定です。B. 膜透過性である
C. 非反応性
D. 笑気ガスとも呼ばれる
E.
一酸化窒素:
A. 長寿命
B. 膜透過性である。 この回答は正解です!
NOは自由に膜を透過し、その生成点からある半径内のすべての細胞に影響を与える。C. 非反応性である
D. 笑気ガスとも呼ばれます。
E.
一酸化窒素:
A. 長寿命
B. 膜透過性がある
C. この回答は不正解です。
NOは非常に反応性の高いフリーラジカルです。 タンパク質、脂質、核酸と反応し、特に還元金属(グアニリルシクラーゼのヘム基のFe2+など)に対して高い親和性を持っている。D. 笑気ガスとしても知られています。
E.
一酸化窒素:
A. 長寿命
B. 膜透過性
C. 非反応性
D. 笑気ガスとしても知られている。
笑気ガスは一酸化窒素ではなく亜酸化窒素です。 反応性がなく毒性もないが、膜の性質に影響を与える。E.
一酸化窒素:
A. 長寿命
B. 膜透過性
C. 非反応性
D. 笑気ガスとも呼ばれる
E. 細胞に対して無毒である。
NO は過剰に生成されると、細胞に対して非常に毒性が高い。 実際、NOの過剰産生はある種の神経変性疾患を引き起こすと考えられています。 また、NOはマクロファージが侵入してきた細菌を殺すための毒性産物として産生されます。