Struttura, dinamica e funzione delle acquaporine
 Vincitore 2004 del Visualization Challenge in Science and Engineering,
Vincitore 2004 del Visualization Challenge in Science and Engineering, Organizzato dalla National Science Foundation e Science Magazine. (Vedi l’articolo relativo su Science.)
Il nostro film sulla permeazione dell’acqua e il premio Nobel 2003 per la chimica
L’arte del trasporto dell’acqua nelle acquaporine
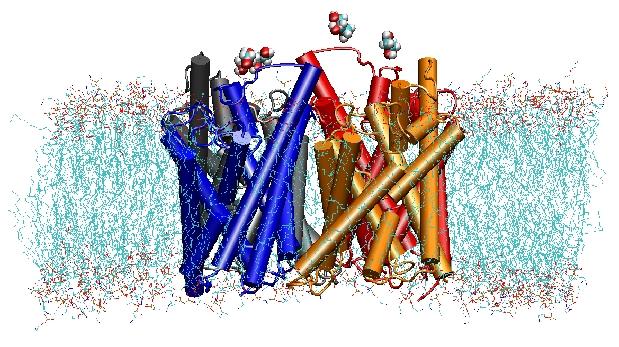
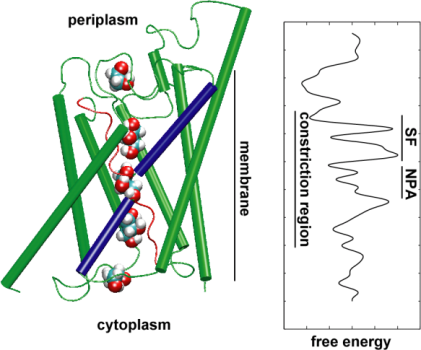
Le acquaporine sono canali d’acqua di membrana che svolgono ruoli critici nel controllo del contenuto di acqua delle cellule. Questi canali sono ampiamente distribuiti in tutti i regni della vita, compresi i batteri, le piante e i mammiferi. Più di dieci diverse acquaporine sono state trovate nel corpo umano, e diverse malattie, come la cataratta congenita e il diabete insipido nefrogeno, sono collegate alla funzione alterata di questi canali. Essi formano tetrameri nella membrana cellulare e facilitano il trasporto di acqua e, in alcuni casi, di altri piccoli soluti attraverso la membrana. Tuttavia, i pori dell’acqua sono completamente impermeabili alle specie cariche, come i protoni, una proprietà notevole che è critica per la conservazione del potenziale elettrochimico della membrana, ma paradossale allo stesso tempo, poiché i protoni possono essere trasferiti facilmente attraverso le molecole d’acqua. I risultati delle nostre simulazioni hanno ora fornito nuove informazioni sul meccanismo alla base di questa affascinante proprietà. Le molecole d’acqua che passano il canale sono costrette, dalle forze elettrostatiche della proteina, a capovolgersi al centro del canale (vedi l’animazione), rompendo così la disposizione alternativa donatore-accettore che è necessaria per la traslocazione del protone (leggi la storia completa nel nostroSciencepaper).

Implicazione funzionale di una peculiare architettura proteica
Nel 2000, il laboratorio di Stroud alla UCSF è riuscito a risolvere la prima struttura ad alta risoluzione di un’acquaporina tramite la cristallografia a raggi X. La struttura studiata era quella dell’E. coliglycerol uptake facilitator (GlpF), che è un’acquagliceroporina, cioè il canale è permeabile anche a piccole molecole di zucchero lineare come il glicerolo. Simulazioni MD a nanosecondi di GlpF tetramerico in un patch disidratato del bilayer lipidico POPE caratterizzato il percorso completo di conduzione del substrato nel canale. L’analisi delle interazioni di legame a idrogeno del substrato con l’interno del canale ha anche spiegato per la prima volta perché questi canali incorporano nella loro architettura due loop caratteristici, tra cui elementi di struttura secondaria energeticamente sfavorevoli, che sono conservati in tutta la famiglia aquaporinfamily (Jensenet al., Structure, 2001).
Energetica della permeazione dello zucchero
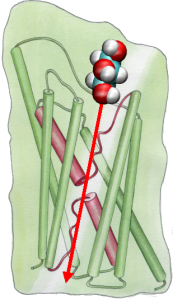
Poi, abbiamo esplorato l’energetica del transportevent per capire quali barriere un substrato deve superare durante il suo passaggio attraverso il canale. Per descrivere il profilo dell’energia libera, abbiamo calcolato il potenziale della forza media per l’evento di conduzione completo dalle traiettorie in cui il movimento del glicerolo attraverso il canale è stato accelerato applicando forze esterne. Questa tecnica, conosciuta come steeredmolecular dynamics (SMD), permette di osservare eventi lenti entro la scala temporale accessibile delle simulazioni MD. Tuttavia, a causa della natura non equilibrata delle traiettorie, nell’analisi dei risultati si affronta il problema del lavoro irreversibile che deve essere contabilizzato. Usando l’identità di Jarzinsky, l’uguaglianza tra l’energia libera e il lavoro nei sistemi di non-equilibrio, abbiamo potuto descrivere completamente l’energetica del trasporto del glicerolo attraverso il canale. Il potenziale calcolato della forza media cattura i principali siti di legame e le barriere nel canale in stretto accordo con i risultati delle simulazioni MD di equilibrio e la struttura cristallina. Inoltre, mostra una pronunciata asimmetria nella sua forma, suggerendo che la struttura asimmetrica della proteina può essere funzionalmente importante per un efficiente assorbimento di molecole nutrienti dall’ambiente. (Jensen, etal., PNAS, 2002).
Cosa rende un’acquaporina un canale di glicerolo
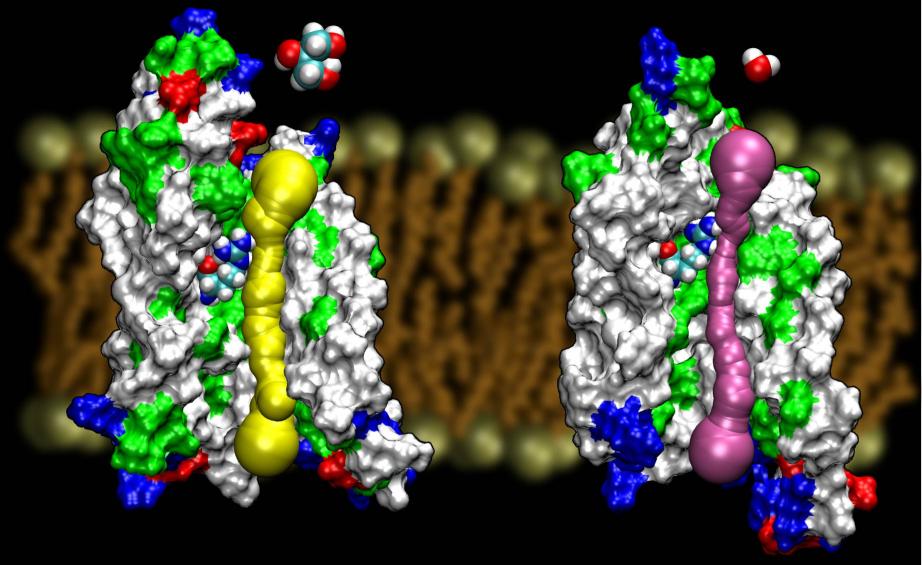
Le acquaporine sono una famiglia molto fortunata di proteine di membrana, che sono notoriamente resistenti alla determinazione della struttura. Abbiamo visto le strutture ad alta risoluzione di diverse AQP: GlpF, AQP1, AQP0 e AqpZ. Altre strutture dovrebbero emergere presto. La disponibilità della struttura di due AQP di E. coli, uno che è un canale per l’acqua pura (AqpZ) e l’altro che è un canale per il glicerolo (GlpF) ci ha fornito un’opportunità unica di capire i principi di selettività impiegati dalla natura nell’usare due canali geneticamente e strutturalmente altamente omologhi per il traffico di membrana di materiali diversi. Infatti, il poro è complessivamente più stretto di GlpF (vedi figura sotto). Sembra che la natura si sia rivolta a un meccanismo molto elementare, cioè la regolazione delle dimensioni del poro del canale, per far sì che due proteine della stessa famiglia mostrino proprietà di conduzione diverse. Leggi l’intera storia in Wang, etal., STRUCTURE, 2005.
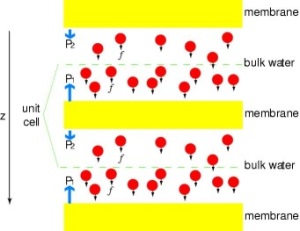
Mettere i canali sotto pressione
Per confrontare direttamente i risultati delle simulazioni MD con le misure biochimiche della conduttività dei canali d’acqua di membrana, in cui i gradienti di pressione osmotica sono usati per indurre il flusso di acqua attraverso la membrana, abbiamo sviluppato una nuova metodologia per le simulazioni MD. Applicando piccole forze sulle molecole d’acqua nella regione di massa (vedi figura), si genera un gradiente di pressione idrostatica attraverso la membrana. Il gradiente di pressione induce tassi di conduzione che possono essere studiati con simulazioni MD, che sono solitamente limitati a pochi nanosecondi. Il metodo è stato applicato nella simulazione della permeazione dell’acqua attraverso la GlpF, e ha dato come risultato una correlazione lineare tra la pressione applicata e il flusso (Zhu et al., Biophys. J., 2002).
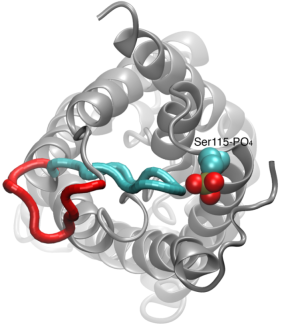
Gating dei canali d’acqua
La permeazione dell’acqua attraverso le acquaporine è un processo passivo che segue la direzione della pressione osmotica attraverso la membrana. Anche se molte acquaporine funzionano come canali sempre aperti, un sottogruppo di acquaporine, in particolare nelle piante, ha evoluto un sofisticato meccanismo molecolare attraverso il quale il canale può essere chiuso in risposta a condizioni ambientali difficili, in cui lo scambio di acqua può essere dannoso per l’organismo. Esempi di tali condizioni sono lo stress da siccità e le inondazioni, che innescano alcuni segnali cellulari (defosforilazione e cambiamento di pH) che portano alla chiusura del canale. Una struttura recentemente risolta di un’acquaporina da spinaci è stata simulata in diverse condizioni per studiare il meccanismo molecolare di gating in questi canali di membrana. Si è scoperto che un ciclo citoplasmatico allungato nelle acquaporine gating-competenti occlude fisicamente l’ingresso del poro dell’acqua nel canale chiuso e blocca l’accesso delle molecole d’acqua al poro. Lo spostamento di questo anello in risposta alla fosforilazione, come osservato nelle simulazioni, rimuove l’anello dall’ingresso citoplasmatico del poro. Inoltre, un aminoacido idrofobico che è conformazionalmente strettamente accoppiato a questo ciclo sarà tirato indietro dal canale come risultato del movimento del ciclo. Insieme, questi eventi molecolari risultano in un canale aperto che è permeabile alle molecole d’acqua. Lo studio è apparso su Nature2006.

Gating e conduttività ionica del poro tetramerico
Gli AQP sono generalmente conosciuti per la loro alta permeabilità all’acqua. Tuttavia, il loro coinvolgimento in altre funzioni cellulari, compresa la permeazione di piccole molecole diverse dall’acqua, così come la comunicazione cellula-cellula è stata suggerita. Tetramerizzazione è una caratteristica strutturale comune di AQPs. Il fatto che i quattro monomeri formano ciascuno un poro d’acqua funzionalmente indipendente, ma richiedono un’organizzazione tetramerica per la funzione, suggerisce un beneficio sinergico di oligomerizzazione, e, quindi, costringe ulteriori analisi del ruolo potenziale del poro centrale in AQPs. Una proposta interessante è il possibile coinvolgimento della conduzione ionica del poro centrale all’attivazione del cGMP. Utilizzando simulazioni MD di modelli di membrana incorporati di AQP1, abbiamo indagato questa proprietà di AQP1, per determinare come, e in quali condizioni di conformazione e idratazione, il poro centrale potrebbe condurre e come la conducibilità è regolata. Uno dei cicli del citoplasma, cioè il ciclo D ricco di arginina, è stato suggerito dalle nostre simulazioni per svolgere un ruolo chiave nell’attivazione mediata dal cGMP del poro centrale. Il ruolo suggerito di loop D è stato verificato sperimentalmente da un mutante progettato di loop D che mostra una perdita completa di conduttività ionica (Yu et al.,Structure, 2006).
Le molecole di gas fanno la spola nella cellula
Ogni mattina, molte persone vanno al lavoro in macchina, mentre altre possono andare in bicicletta, prendere l’autobus o la metropolitana. Ad esempio, per attraversare la membrana cellulare, le piccole molecole di gas idrofobiche diffondono attraverso lo strato lipidico, mentre le molecole d’acqua passano attraverso le acquaporine (AQPs).È interessante notare che, proprio come si può arrivare al lavoro sia in autobus che in auto, è stato scoperto di recente che alcune molecole di gas possono avere più di un modo per attraversare la membrana, cioè, Oltre alla diffusione attraverso i lipidi, anche l’ossigeno e l’anidride carbonica possono passare attraverso le AQPs. Tuttavia, i percorsi che queste molecole di gas prendono sono rimasti elusivi. Utilizzando la dinamica molecolare eseguita con NAMD, abbiamo studiato la permeabilità ai gas della AQP1 con due metodi complementari (simulazione esplicita della diffusione dei gas e campionamento implicito dei ligandi). I risultati della simulazione suggeriscono che mentre i pori fourmonomeric di AQP1 funzionano come canali d’acqua, il poro centrale di AQP1 può servire come un percorso per le molecole di gas per attraversare la membrana (Wang et al., Journal of Structural Biology, 2007 ).
Corso ad ostacoli molecolare
Le cellule biologiche proteggono il loro interno attraverso le loro membrane cellulari, ma si affidano all’importazione di nutrienti. Si sono evolute per questa importazione di canali di conduzione veloci che comprendono punti di controllo affidabili che distinguono i composti desiderabili e indesiderabili. Un checkpoint mette su un vero e proprio percorso ad ostacoli che solo i composti giusti possono passare rapidamente. Comprendere il design del canale è difficile a causa della mancanza di dati sperimentali dettagliati sulla dinamica dei nutrienti. Attualmente, le informazioni più dettagliate provengono dalla visualizzazione computazionale della dinamica del canale, partendo da strutture cristallografiche statiche. Uno studio recente ha indagato su come i gliceroli, piccole molecole nutrienti necessarie ad alcuni batteri, passano attraverso i punti di controllo realizzati attraverso il canale GlpF del glicerolo. GlpF fornisce quattro canali paralleli che sono stati monitorati computazionalmente usando NAMD e un nuovo algoritmo che esplora l’energetica del canale abbastanza velocemente da essere metodologicamente fattibile sui computer di oggi. I risultati mostrano come le caratteristiche fisiche del glicerolo, la loro capacità di formare i cosiddetti legami a idrogeno, i loro momenti di dipolo elettrici, la loro mobilità diffusiva e la loro flessibilità intrinseca sono sondati lungo il canale (Henin et al, Biophysical Journal, in stampa).
La nostra ricerca sulle acquaporine nelle notizie
|
Aquaporin Team
|
Pubblicazioni
-//W3C//DTD XHTML 1.0 Transitional//EN” “http://www.w3.org/TR/xhtml1/DTD/xhtml1-transitional.dtd”>Publications Database Diffusione di glicerolo attraverso Escherichia coli aquaglyceroporin GlpF.Jerome Henin, Emad Tajkhorshid, Klaus Schulten, e Christophe Chipot. Biophysical Journal, 94:832-839, 2008. Esplorare la permeabilità ai gas delle membrane cellulari e dei canali di membrana con la dinamica molecolare.Yi Wang, Jordi Cohen, Walter F. Boron, Klaus Schulten, e Emad Tajkhorshid. Journal of Structural Biology, 157:534-544, 2007. Meccanismo di gating e conduttività ionica di un possibile poro tetramerico in Aquaporin-1.Jin Yu, Andrea J. Yool, Klaus Schulten, e Emad Tajkhorshid. Struttura, 14:1411-1423, 2006. Meccanismo strutturale della pianta aquaporin gating.S. Törnroth-Horsefield, Y. Wang, K. Hedfalk, U. Johanson, M. Karlsson, E. Tajkhorshid, R. Neutze, e P. Kjellbom. Natura, 439:688-694, 2006. Cosa rende un’acquaporina un canale per il glicerolo: Uno studio comparativo di AqpZ e GlpF.Yi Wang, Klaus Schulten, e Emad Tajkhorshid. Structure, 13:1107-1118, 2005. Teoria cinetica e simulazione del trasporto di acqua a singolo canale.Emad Tajkhorshid, Fangqiang Zhu, e Klaus Schulten. In S. Yip, editore, Manuale di modellazione dei materiali, Vol. I: Metodi e modelli, pp. 1797-1822. Springer, Paesi Bassi, 2005. Verso la comprensione dei canali di membrana.Emad Tajkhorshid, Jordi Cohen, Aleksij Aksimentiev, Marcos Sotomayor, e Klaus Schulten. In Boris Martinac e Andrzej Kubalski, editori, canali ionici batterici e i loro omologhi eucariotici, pp. 153-190. ASM Press, Washington, DC, 2005. Modello di diffusione collettiva per la permeazione dell’acqua attraverso canali microscopici.Fangqiang Zhu, Emad Tajkhorshid, e Klaus Schulten. Physical Review Letters, 93:224501, 2004. (4 pagine). Studi computazionali di canali di membrana.Benoit Roux e Klaus Schulten. Structure, 12:1343-1351, 2004.