Oltre 200.000 persone sono state sottoposte a sostituzione transcatetere della valvola aortica (TAVR), e ogni anno circa 140.000 pazienti ricevono una valvola bioprotesica chirurgica.1,2 Nonostante questo volume crescente, la strategia ottimale di anticoagulazione postoperatoria è spesso poco chiara. In particolare, due domande sottolineano la difficoltà del processo decisionale per questi comuni scenari clinici:
- Nei mesi iniziali dopo la sostituzione della valvola bioprotesica, quali complicazioni stiamo cercando di ridurre con l’anticoagulazione?
- L’anticoagulazione deve essere fornita a tutti i pazienti per ridurre queste complicazioni? O dovremmo avere un approccio più selettivo basato sui fattori di rischio?
Rischi trombotici dopo la sostituzione della valvola bioprotesica
Tradizionalmente, il razionale per l’anticoagulazione nei primi mesi dopo la sostituzione chirurgica della valvola è stato quello di mitigare le complicazioni trombotiche, presumibilmente legate al materiale di sutura e ad un anello di cucitura che non è ancora coperto da biofilm ed endotelizzato.3,4 Le possibili complicazioni trombotiche successive sono tre: eventi tromboembolici, trombosi manifesta della valvola e trombo organizzato subclinico che può compromettere la funzione della valvola a lungo termine. Nonostante la frequenza della sostituzione della valvola bioprotesica, i dati relativi a queste complicazioni sono limitati, in parte perché questi eventi sono apparentemente poco frequenti.
Una recente meta-analisi ha evidenziato il basso tasso di eventi dopo la sostituzione della valvola bioprotesica. In questa analisi di 31.740 pazienti, prevalentemente con sostituzione chirurgica della valvola aortica, eventi tromboembolici precoci si sono verificati in 145 pazienti (1%) che assumevano antagonisti della vitamina K e 262 pazienti (1,5%) che non assumevano antagonisti della vitamina K (odds ratio 0,96; intervallo di confidenza 95%, 0,60-1,52).5 Se ipotizziamo che ci sia effettivamente un aumento dello 0,5% di complicazioni tromboemboliche nei primi mesi dopo la sostituzione chirurgica della valvola aortica nei pazienti che non assumono antagonisti della vitamina K, allora uno studio controllato randomizzato adeguatamente alimentato richiederebbe circa 15.500 pazienti.6 Ad oggi, sono stati eseguiti 2 studi randomizzati, per un totale di 268 pazienti.7,8 Dato il piccolo numero di pazienti, la mancanza di una differenza statisticamente rilevabile nei 2 gruppi non è sorprendente.
In assenza di grandi studi controllati randomizzati, i clinici devono rivolgersi a studi osservazionali per capire, come l’analisi del registro nazionale danese dei pazienti.9 In questo studio di 4.075 pazienti con sostituzione della valvola aortica bioprotesica, la sospensione del warfarin è stata associata a un aumento degli eventi tromboembolici e dei decessi cardiovascolari 1-6 mesi dopo l’intervento. È interessante notare che, anche se il tasso di ictus è stato aumentato nei primi 3 mesi nel gruppo di trattamento, il numero di ictus tra 3 e 6 mesi non era diverso tra i pazienti che hanno continuato o interrotto il warfarin, anche se ci sono stati solo 21 eventi durante questo periodo. Inoltre, non c’era alcuna differenza negli eventi di sanguinamento tra 3 mesi e 1 anno. Questa osservazione è in contrasto con i rapporti precedenti e l’esperienza clinica secondo cui i pazienti che assumono warfarin hanno maggiori probabilità di essere ricoverati in ospedale per emorragie.5 Pertanto, le conclusioni degli autori riguardo alla mortalità cardiovascolare e agli eventi tromboembolici potrebbero essere state legate a un confondimento residuo. In particolare, potrebbe non esserci stata alcuna differenza negli eventi emorragici perché i medici erano meno propensi a iniziare o continuare l’anticoagulazione nei pazienti a più alto rischio.
Purtroppo, rispetto agli eventi tromboembolici, i dati pubblicati forniscono ancora meno indicazioni sulle associazioni inferenziali per la trombosi della valvola bioprotesica. Sono stati riportati pochi eventi e la maggior parte della letteratura si limita a serie di casi ed esperienze di un solo centro.10 Di conseguenza, l’incidenza della trombosi della valvola bioprotesica non è ben definita, anche se in uno studio, solo 8 dei 4.568 pazienti con valvole aortiche bioprotesiche hanno richiesto un nuovo intervento per stenosi aortica legata al trombo.11 Allo stesso modo, il ruolo della trombosi clinicamente silente e della possibile degenerazione accelerata della valvola bioprotesica è in gran parte sconosciuto.
Anticoagulazione selettiva dopo la sostituzione della valvola bioprotesica
Sulla base di un’entità non chiara del beneficio e di un rischio di sanguinamento ben accettato, l’anticoagulazione universale dopo la sostituzione della valvola aortica bioprotesica è difficile da giustificare; questa incertezza si riflette nella raccomandazione di classe IIb nelle linee guida 2014 dell’American College of Cardiology and American Heart Association (ACC/AHA) sulle malattie cardiache valvolari.12 Tuttavia, possono presentarsi situazioni cliniche specifiche in cui l’anticoagulazione dovrebbe essere presa in maggiore considerazione. Ad esempio, in un recente studio caso-controllo comprendente 46 pazienti con reintervento per trombosi della valvola aortica bioprotesica, un aumento >50% dei gradienti Doppler medi all’ecocardiografia dal basale, un aumento dello spessore delle cuspidi e una mobilità anomala delle cuspidi erano tutti associati alla trombosi della valvola.13 Pertanto, in questi pazienti si potrebbe considerare un trial di anticoagulazione e un’ecocardiografia di follow-up per valutare i gradienti Doppler,14 sebbene non sia chiaro in che misura la funzione della valvola a breve e lungo termine sia modificata dall’anticoagulazione.
Inoltre, i pazienti con una valvola mitrale bioprotesica sembrano essere a più alto rischio di eventi tromboembolici e di trombosi valvolare (vedere il Caso Illustrativo, con le Figure 1-2 e i Video 1-2, di seguito). Poiché la sostituzione della valvola mitrale bioprotesica è molto meno comune della sostituzione della valvola aortica, i dati sono ancora più limitati. Tuttavia, in uno studio monocentrico su 216 pazienti con sostituzione della valvola mitrale bioprotesica, 10 (5%) hanno avuto un ictus ischemico entro 6 mesi.15 Inoltre, in un altro studio su 149 pazienti consecutivi, 9 (6%) hanno sviluppato una trombosi della valvola mitrale bioprotesica.16 Pertanto, i pazienti con sostituzione della valvola mitrale bioprotesica sembrano essere a più alto rischio, e l’anticoagulazione di routine dovrebbe essere considerata per 3-6 mesi, ancora una volta riflessa dalla raccomandazione di classe IIa nelle linee guida sulle cardiopatie valvolari ACC/AHA del 2014.12
Caso illustrativo: trombosi della valvola mitrale bioprotesica
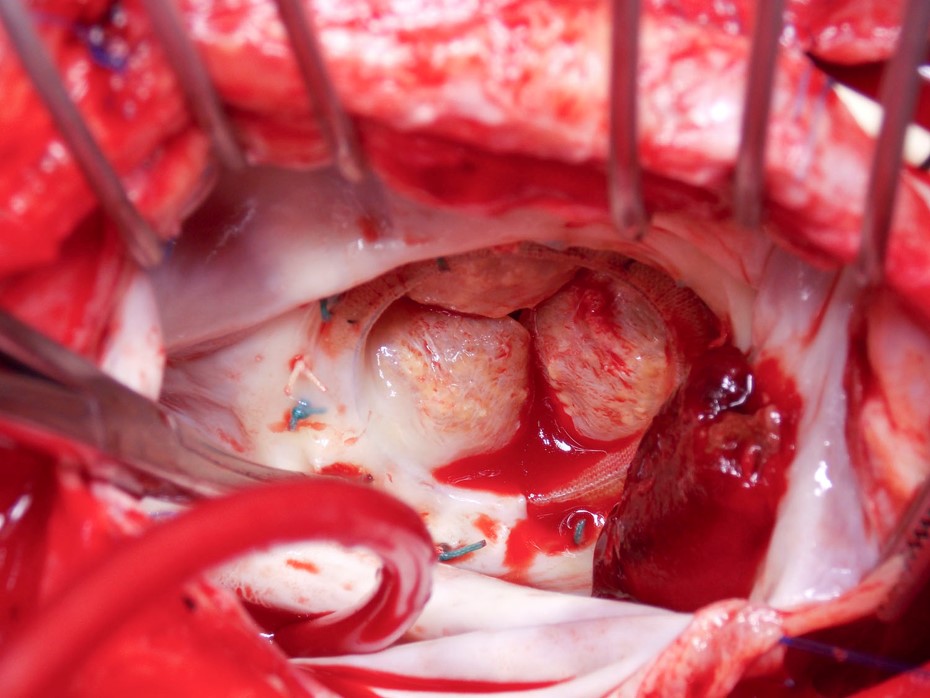
Una donna di 71 anni si è presentata con insufficienza cardiaca 8 mesi dopo la sostituzione della valvola mitrale bioprotesica per stenosi mitralica reumatica. Postoperatoriamente, era stata trattata con coumadin per 3 mesi e ha continuato con l’aspirina. Non aveva una storia di fibrillazione atriale ed era stata afebrile, e le colture del sangue erano negative.
Video 1
Figura 1
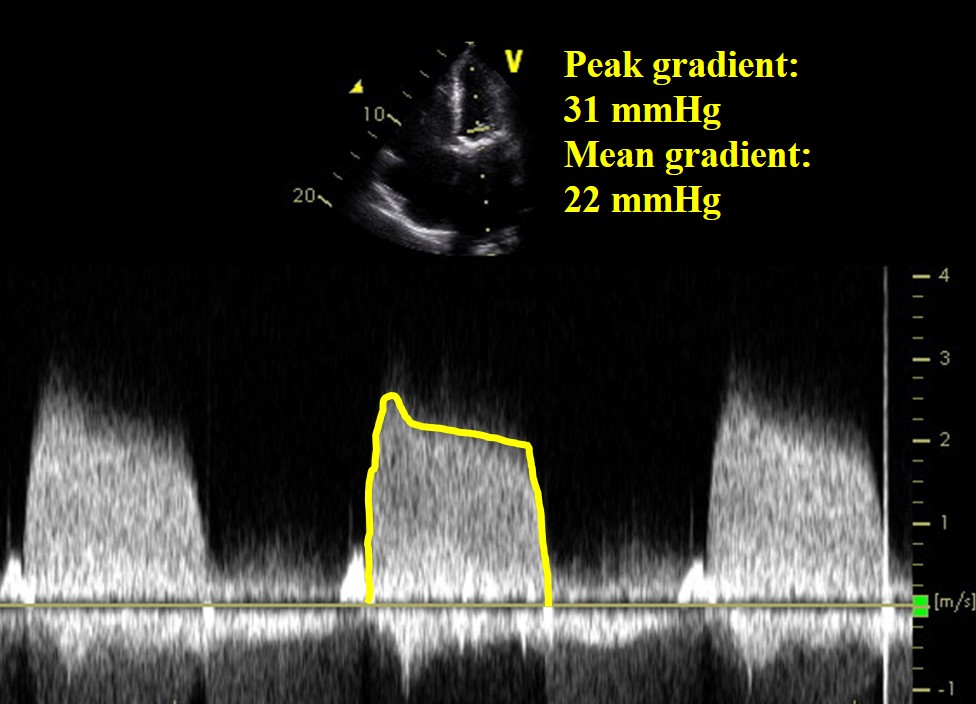
Video 2
Figura 2
Infine, e forse il più controverso, è se il nostro approccio all’anticoagulazione debba essere diverso per i pazienti che hanno avuto TAVR. Il default iniziale è stato quello di trattare questi pazienti con aspirina e clopidogrel perché questo era l’approccio intrapreso negli studi randomizzati. Più recentemente, con l’angiografia a tomografia computerizzata quadridimensionale (CTA) elettrocardiografica, sono stati descritti una ridotta mobilità del lembo della valvola aortica bioprotesica e un ispessimento ipoattenuato del lembo, che implica una trombosi della valvola.17,18 Spesso questi pazienti sono asintomatici e hanno gradienti Doppler normali all’ecocardiografia, suggerendo che questi risultati possono essere subclinici. È importante notare che queste anomalie CTA possono risolversi con il warfarin, e la mancanza di anticoagulazione iniziale sta emergendo come un possibile fattore di rischio.19 Al momento, tuttavia, questi risultati di imaging non sono di chiaro significato clinico.20 Fortunatamente, uno studio randomizzato, GALILEO (Global Study Comparing a Rivaroxaban-Based Antithrombotic Strategy to an Antiplatelet-Based Strategy After Transcatheter Aortic Valve Replacement to Optimize Clinical Outcomes) che confronta il rivaroxaban alla terapia antipiastrinica dopo TAVR è in corso e dovrebbe fornire informazioni preziose.21 Tuttavia, nonostante un arruolamento stimato di 1.520 pazienti, lo studio potrebbe non essere adeguatamente alimentato per gli eventi clinici.
Conclusioni
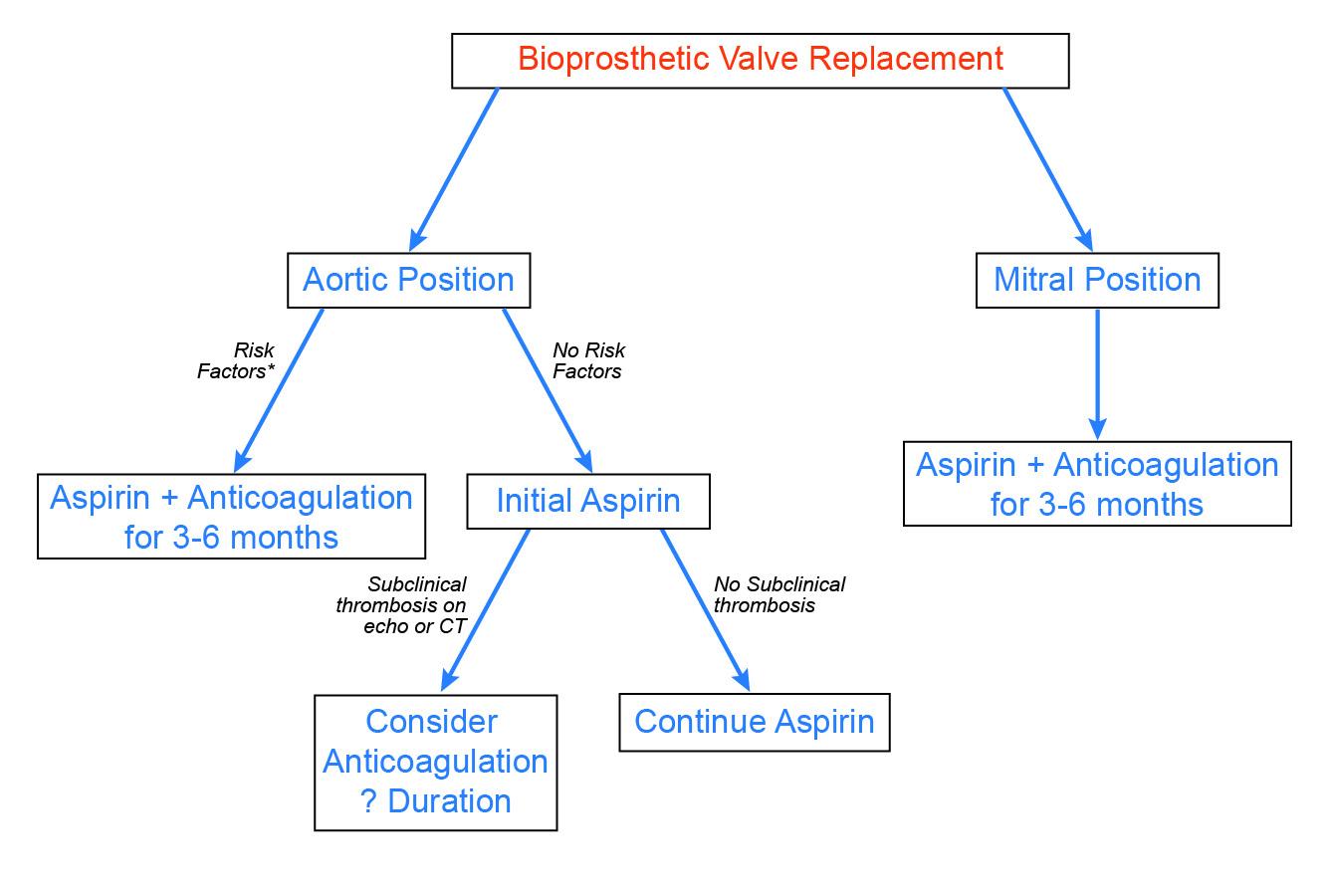
In generale, nei pazienti con valvole bioprotesiche, i primi eventi tromboembolici non procedurali non sono comuni. Inoltre, l’incidenza della trombosi valvolare manifesta è probabilmente bassa, e l’effetto della trombosi valvolare subacuta sulla durata della valvola è ancora in fase di definizione. Date queste osservazioni, insieme all’aumento del rischio di sanguinamento con il warfarin, sosteniamo un approccio selettivo all’anticoagulazione postoperatoria (Figura 3). Per i pazienti con valvole aortiche bioprotesiche, l’anticoagulazione per 3-6 mesi è indicata nei pazienti con fattori di rischio accertati, come la fibrillazione atriale. Sulla base delle recenti evidenze emergenti, l’anticoagulazione e un attento follow-up dovrebbero essere considerati nei pazienti con risultati ecocardiografici o CTA anormali, come un aumento inspiegabile dei gradienti valvolari Doppler o un ispessimento ipoattenuato del lembo. Infine, anche se sono disponibili meno dati, i pazienti con valvole mitrali bioprotesiche sembrano essere a più alto rischio di complicazioni trombotiche, e si raccomanda l’anticoagulazione di routine per 3-6 mesi.
Figura 3: Approccio proposto all’anticoagulazione dopo la sostituzione della valvola bioprotesica
Questo articolo contiene materiale didattico destinato ai professionisti sanitari autorizzati ed è destinato ad essere utilizzato esclusivamente per scopi educativi e informativi. Mentre il contenuto può riguardare specifiche questioni mediche e sanitarie, non è un sostituto o una sostituzione di consigli medici personalizzati e non è destinato ad essere utilizzato come unica base per prendere decisioni mediche o sanitarie individualizzate. I punti di vista e le opinioni espresse sono quelli degli autori e dei redattori che hanno contribuito e non rappresentano necessariamente le opinioni dell’ACC. Il materiale non è inteso a presentare gli unici, o necessariamente i migliori, metodi o procedure per le situazioni mediche affrontate, ma piuttosto è inteso a rappresentare un approccio, punto di vista, dichiarazione o opinione.
- Pibarot P, Dumesnil JG. Valvole cardiache protesiche: selezione della protesi ottimale e gestione a lungo termine. Circolazione 2009;119:1034-48.
- Mack MJ, Douglas PS, Holmes DR. Shedding More Light on Valve Thrombosis After Transcatheter Aortic Valve Replacement. J Am Coll Cardiol 2016;67:656-8.
- Heras M, Chesebro JH, Fuster V, et al. High risk of thromboemboli early after bioprosthetic cardiac valve replacement. J Am Coll Caridol 1995;25:1111-9.
- Roudaut R, Serri K, Lafitte S. Trombosi delle valvole cardiache protesiche: diagnosi e considerazioni terapeutiche. Heart 2007;93:137-42.
- Masri A, Gillinov AM, Johnston DM, et al. Anticoagulazione contro antipiastrinici o nessuna terapia in pazienti sottoposti a impianto di valvola bioprotesica: una revisione sistematica e meta-analisi. Cuore 2017;103:40-80.
- R Core Team (2015). R: Un linguaggio e un ambiente per il calcolo statistico. R Foundation for Statistical Computing; Vienna, Austria. Disponibile presso: https://www.R-project.org/. (Utilizzando la funzione power.prop.test α = 0,05 e β = 0,8)
- Aramendi JI, Mestres CA, Martinez-León J, Campos V, Muñoz G, Navas C. Triflusal versus oral anticoagulation for primary prevention of thromboembolism after bioprosthetic valve replacement (trac): prospective, randomized, co-operative trial. Eur J Cardiothorac Surg 2005;27:854-60.
- Colli A, Mestres CA, Castella M, Gherli T. Confronto tra warfarin e aspirina (WoA) dopo sostituzione della valvola aortica con la bioprotesi della valvola cardiaca St. Jude Medical Epic: risultati dello studio pilota WoA Epic. J Heart Valve Dis 2007;16:667-71.
- Mérie C, Køber L, Skov Olsen P, et al. Associazione della durata della terapia con warfarin dopo la sostituzione della valvola aortica bioprotesica con rischio di mortalità, complicazioni tromboemboliche e sanguinamento. JAMA 2012;308:2118-25.
- Cremer PC, Rodriguez LL, Griffin BP, et al. fallimento della valvola bioprotesica precoce: Approfondimenti meccanicistici attraverso la correlazione tra risultati ecocardiografici e operativi. J Am Soc Echocardiogr 2015;28:1131-48.
- Brown ML, Park SJ, Sundt TM, Schaff HV. Rischio di trombosi precoce in pazienti con valvole biologiche in posizione aortica. J Thorac Cardiovasc Surg 2012;144:108-11.
- Nishimura RA, Otto CM, Bonow RO, et al. 2014 AHA/ACC linea guida per la gestione dei pazienti con malattia cardiaca valvolare: un rapporto dell’American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2014;63:e57-185.
- Egbe AC, Pislaru SV, Pellikka PA, et al. Trombosi della valvola bioprotesica rispetto al fallimento strutturale: Predittori clinici ed ecocardiografici. J Am Coll Cardiol 2015;66:2285-94.
- Stewart WJ. Trombosi delle valvole bioprotesiche: Possiamo permetterci di ignorarlo? J Am Coll Cardiol 2015;66:2295-7.
- Russo A, Grigioni F, Avierinos JF, et al. Complicazioni tromboemboliche dopo la correzione chirurgica del rigurgito mitralico incidenza, predittori, e implicazioni cliniche. J Am Coll Cardiol 2008;51:1203-11.
- Butnaru A, Shaheen J, Tzivoni D, Tauber R, Bitran D, Silberman S. Diagnosi e trattamento del malfunzionamento bioprotesico precoce nella posizione della valvola mitrale dovuto alla formazione di trombi. Am J Cardiol 2013;112:1439-44.
- Makkar RR, Fontana G, Jilaihawi H, et al. Possibile trombosi subclinica del foglietto nelle valvole aortiche bioprotesiche. N Engj J Med 2015;373:2015-24.
- Pache G, Schoechlin S, Blanke P, et al. Early hypo-attenuato ispessimento del foglietto in palloncino espandibile valvole cardiache aortiche transcatetere. Eur Heart J 2016;37:2263-71.
- Hansson NC, Grove EL, Andersen HR, et al. Transcatheter Aortic Valve Thrombosis: Incidence, Predisposing Factors, and Clinical Implications. J Am Coll Cardiol 2016;68:2059-69.
- Laschinger JC, Wu C, Ibrahim NG, Shuren JE. Ridotto movimento del foglietto nelle valvole aortiche bioprotesiche – La prospettiva della FDA. N Engj J Med 2015;373:1996-8.
- Global Study Comparing a rivAroxaban-based Antithrombotic Strategy to an antipLatelet-based Strategy After Transcatheter aortIc vaLve rEplacement to Optimize Clinical Outcomes (GALILEO) (ClinicalTrails.gov website). 2016. Disponibile a: https://clinicaltrials.gov/ct2/show/NCT02556203. Accessed 11/29/2016.
Temi clinici: Gestione dell’anticoagulazione, Aritmie e EP clinico, Chirurgia cardiaca, Insufficienza cardiaca e cardiomiopatie, Angiografia e intervento cardiovascolare invasivo, Imaging non invasivo, Cardiopatia valvolare, Gestione dell’anticoagulazione e fibrillazione atriale, Fibrillazione atriale/aritmie sopraventricolari, Chirurgia aortica, Chirurgia cardiaca e aritmie, Chirurgia cardiaca e insufficienza cardiaca, Chirurgia cardiaca e VHD, insufficienza cardiaca acuta, Interventi e imaging, Interventi e malattie cardiache strutturali, angiografia, ecocardiografia/ultrasuoni, imaging nucleare
Parole chiave: Valvola aortica, Stenosi della valvola aortica, Fibrillazione atriale, Aspirina, Bioprotesi, Studi caso-controllo, Angiografia, Costrizione, Patologica, Ecocardiografia, Transesofagea, Elettrocardiografia, Insufficienza cardiaca, Malattie delle valvole cardiache, Protesi valvolari cardiache, Valvola mitrale, Stenosi della valvola mitrale, Intervento chirurgico, Fattori di rischio, Ictus, Suture, Trombosi, Ticlopidina, Sostituzione transcatetere della valvola aortica, Vitamina K, Warfarin
< Torna agli elenchi